ГРС є дуже поширеним станом, що головним чином лікується в закладах первинної медичної допомоги. Поширеність варіюються від 6 до 15% в залежності від параметрів дослідження, хоча у дослідженнях, що стосуються ГРС, зазначаються 6-12%, причому поширеність РГРС було розраховано як 0.035%. Головною причиною ГРС є віруси, причому лише у 0.5-2.0% пацієнтів розвивається гострий бактеріальний риносинусит у результаті перенесеної вірусної інфекції. Поширеність ГРС змінюється в залежності від сезону (більш висока у зимові місяці) та кліматичних варіацій та збільшується у вологому середовищі та при забрудненому повітрі.
Очевидно існує безмежна кількість обґрунтувань у підтримку гіпотези щодо того, що тривале алергічне запалення та куріння провокують виникнення у пацієнтів ГРС, можливо, через зміни у циліарній рухливості та функції. Проте, роль ларингофарингеального рефлюксу при ГРС є нечіткою. Хронічна супутня хвороба у дітей, слабке психічне здоров'я та анатомічні зміни були асоційовані із підвищеною вірогідністю ГРС. Хоча циліарна функція при ГРС змінюється, доказів стосовно ролі ГРС у розвитку первинної циліарної дискінезії існує мало.
Існує негайна потреба в додаткових дослідженнях для пояснення механізмів, що лежать в основі, задіяних у збільшенні чутливості до ГРС через тривалу алергію та куріння. У цьому огляді ми визначили, що бракує досліджень, які характеризують пацієнтів із ГРС та супутніми хворобами. Для визначення можливих супутніх та сприяючих хвороб, окрім алергії, куріння та, можливо, ларингофарингеального рефлюксу, існує потреба в описових дослідженнях.
ГРС є дуже поширеною хворобою, що впливає на 6-15% населення.
Частота виникнення гострого синуситу або риносинуситу (ГРС) є дуже високою, як ми зазначали(8) раніше та вказали у Таблиці 3.1.1. Було визначено, що у дорослих виникає від двох до п'яти епізодів вірусного ГРС (або застуд) на рік, а діти шкільного віку можуть хворіти застудою від семи до десяти разів на рік.(8, 30) Приблизно 0.5-2% гострих вірусних інфекцій верхніх дихальних шляхів ускладнюються бактеріальною інфекцією.(8, 31) Нещодавно Uijen та ін.(32) провели аналізи дитячих проблем, що знаходяться в компетенції оториноларингологів, використавши голландські загальні практики, що брали участь у Нідерландській інформаційній мережі загальної практики з 2002 р. до 2008 р. Вони виявили стійкі показники захворюваності - 18 випадків синуситу на 1000 дітей віком 12-17 років на рік, та 2 випадки на 1000 дітей віком 0-4 роки. У дітей віком 5-11 років Uijen та ін. спостерігали зниження частоти захворюваності з 7 випадків на 1000 дітей у 2002 р. до 4/1000 у 2008 р. (р<0.001). І навпаки, на підставі даних з 240 447 консультацій стосовно інфекції дихальних шляхів, отриманих з бази даних системи Електронних історій хвороби Swedestar, Neumark та ін. (33) заявили про зменшення частоти звернень до лікаря стосовно синуситу лише на 2.5% за період з 1999 р. до 2005 р. У невеликому дослідженні Oskarsson та Halldorsson (34) вказали захворюваність - 3.4 випадки гострого синуситу у 100 жителів на рік, виявлених у популяції з трьох медичних центрів Ісландії.
У Німеччині з липня 2000 р. до червня 2001 р. було діагностовано 6.3 мільйони окремих випадків ГРС, що стали причиною 8.3 мільйонів випадків призначення лікування.(30) У трирічному досліджені випадок-контроль за участю населення Голландії vanGageldonk - Lafeber оцінили, що щорічно 900 000 окремих пацієнтів звертались до лікарів загальної практики із гострою інфекцією дихальних шляхів.(35)
У США інфекція верхніх дихальних шляхів є третьою за частотою причиною звернення до медичних спеціалістів загального профілю. При цьому приблизно третю частину становить ГРС.(36) У 2009 р. на підставі даних американського Національного анкетування з питань охорони здоров'я, проведеного впродовж 1997 - 2006 рр., ВЬайасЬагауа заявив про річну поширеність хвороби 15.2%, хоча автор також заявляє, що у цей показник входить як ГРС, так і ХРС. Згідно з американськими протоколами наслідки риносинуситу спостерігаються у 1 з 7 дорослих.(37-39) Стосовно конкретно ГРС, у середньому на 8.4% населення Голландії приходився принаймні один епізод ГРС на рік у 1999 р.,(8) а в період з січня до березня 2002 р. 9% (23 з 266 пацієнтів) до того здорових пацієнтів звернулись із ГРС до клініки при Медичному центру у Сан-Франциско, США.(40) У дослідженні Стратегій протимікробного лікування (МІКБТКЛ), яке проводили у період з 1998 р. до 1999 р., у 12% (1 601 з 13 740) діагностували гострий гайморит.(41) На підставі тої самої бази даних КаШакогрі (42) заявив, що 12% звернень стосовно інфекції було пов'язано із синуситом. В Азії приблизно 6-10% пацієнтів, які звертались до лікарів загальної практики, отоларингологів та до амбулаторних дитячих відділень, мали ГРС.(9) Можна вважати, що РГРС відрізняється від ГРС та ХРС. Згідно із даними з бази медичних звітів на 13.1 мільйонів пацієнтів з 2003 р. до 2008 р. поширеність у певний період часу РГРС складала 0.035%, що було значно нижче, ніж у ГРС.(43) Стосовно того, чи вважати РГРС формою ГРС або ХРС, є потреба в додаткових обговореннях.
У ряді досліджень було описано пацієнтів, які звертались до спеціалізованих медичних відділень з приводу ГРС, як показано у Таблиці 3.1.2. У Північно-західній Нігерії 195 зі 1 661 пацієнта, які звернулись до спеціалізованих медичних відділень отоларингологій, мали риносинусит, із яких у 16.4% був ГРС.(44) Доля пацієнтів із гострим ринітом була значно вищою, ніж заявлена раніше Ogunleye та ін. у 1999 р.(45) У ретроспективному дослідженні з 90 пацієнтів, які звертались до спеціалізованих клінік в Ібадані (Нігерія) було зазначено, що лише у 7% з 90 пацієнтів було діагнастовано ГРС.(45) У дослідженні інфекцій верхніх дихальних шляхів за участю 292 пацієнтах, що звернулись до шпиталю Сірірай (Таїланд) з квітня до жовтня 2004 р., частота виникнення ГРС склала 1.4%.(46) Така низька частота виникнення може бути результатом того, що більшість пацієнтів з ГРС звертались скоріше до медичного закладу загального профілю, а не до шпиталів. Все більша поширеність синуситу спостерігалась у Турку у південно-західній Фінляндії, де збільшення у 3.14 рази кількості пацієнтів, які звернулись із гострим фронтитом до спеціалізованого медичного закладу, спостерігалась у період 1977-1981 рр. (134 пацієнти) та 1982-1986 рр. (421 пацієнт).(47) Хоча це може бути результатом покращення діагностики та бажання звертатися до спеціалізованих відділень, Suonpaa та Antila (47) стверджують, що збільшення забруднення повітря у міській території Турку може бути частковою причиною цього.
|
Автор, рік, посилання |
Докази |
Тип дослідження |
|
Uijen 2011(32) |
Захворюваність ГРС впродовж 20022008 р: |
Ретроспективне популяційне дослідження |
|
Oskarsson 2011(34) |
Захворюваність ГРС 3.4 випадки на 100 мешканців в рік, чи 1 з 29.4 візитів пацієнтів до лікаря загальної практики з приводу ГРС |
Ретроспективне |
|
Wang 2011(9) |
6-10% пацієнтів лікарів загальної практики та лікарів отоларингологів чи педіатрів амбулаторного прийому хворіли на ГРС |
Багатонаціональне дослідження за даними анкетування |
|
Bhattacharyya |
Поширеність рекурентних ГРС впродовж 2003-2008 років склала 0.035% |
Ретроспективне когорт не дослідження |
|
Meltzer, Kaliner, Kaliner 2011, |
В США 1 з 7 дорослих страждає на ГРС |
Настанова |
|
Neumark 2009 (33) |
7.5% консультацій з приводу інфекцій верхніх дихальних шляхів (або 1 з 13.3) були пов’язані з синуситом. 19.3 консультацій на 1000 пацієнтів на рівні первинної медичної допомоги були пов’язані з синуситом |
Проспективне популяційне дослідження |
|
Bhattacharyya 2009 (37, 48) |
Для 1997-2006, поширеність синуситу (всі форми) склала 15.2% на рік |
Ретроспективне когорт не дослідження |
|
Fokkens 2007 (8) |
Станом на 1999 рік 8.4% населення Нідерландів мали принамні один епізод ГРС |
Настанова |
|
van Gagel donk-Lafeber 2005 (35) |
Захворюваність на гострі інфекції дихальних шляхів (у тому числі ГРС) впродовж 2000-2003 років склала 54.5 випадків на 1 000 людино-років або 1 з кожних 18.3 консультацій |
Проспективне дослідження з дизайном випадок-контроль |
|
Cherry 2005 (36) |
У США інфекції верхніх дихальних шляхів є третьою з найбільш частих причин консультацій в закладах первинної медичної допомоги; з них третина припадає на ГРС |
Національне дослідження |
|
Louie 2005 (40) |
За даними дослідження, проведеного в США в січні-березні 2002 року у 9% пацієнтів, попередньо визнаних здоровими, було діагностовано ГРС |
Проспективне дослідження |
|
Varonen, Rautakorpi 2004, 2001 (41, 42) |
Впродовж 1998-1999 рр. у 12% пацієнтів було діагностовано ГРС. Впродовж цього часу 12% консультацій з приводу інфекційних захворювань були пов’язані з ГРС |
Поперечне мультицентрове епідеміологічне дослідження |
|
Bachert 2003 (30) |
Між липнем 2000 та червнем 2001 в Німеччині було діагностовано 6.3 млн. випадків ГРС, в результаті чого було зроблено 8.3 млн. призначень |
Огляд |
Визначивши фактори, що спричиняють виникнення ГРС та/або гострої інфекції респіраторного шляху, ми змогли б сформувати інформаційну базу.
На підставі проекту парного дослідження випадок-контроль, що проводилось за участю населення Голландії впродовж 2000-2003 рр., van Gageldonk-Lafeber та ін.(50) заявили, що вплив на індивідуума(ів), які скаржаться на проблеми із респіраторним шляхом, факторів його домашнього оточення та за його межами є незалежним фактором ризику для звернення до їх ЛЗП з приводу гострої респіраторної вірусної інфекції (скореговане ВШ=1.9 та скореговане ВШ=3.7 відповідно). І навпаки, пацієнти із дітьми середнього шкільного віку, які контактують з вологим середовищем або пліснявою вдома, або які піддаються дії пасивного куріння, менш вірогідно відвідують своїх ЛЗП порівняно із пацієнтами без дітей, плісняви, вологи або дії пасивного куріння, відповідно. Збільшений рівень вологи, але не плісняви, вдома було пов'язано із синуситом.(51)
Було відмічено сезонні тенденції у проявах ГРС. У дослідженні респіраторних інфекцій Neumark та ін.(33) заявили про сезонні мінливості у захворюваності синуситом з 1999 р. до 2005 р., при чому у першому кварталі кожного року спостерігалась підвищена захворюваність. Стосовно гострих респіраторних захворювань у 2000-2003 рр. van Gageldonk-Lafeber та ін.(35) спостерігали аналогічні сезонні тенденції, що і у Neumark. Порівняно з періодом з липня до вересня van Gageldonk-Lafeber та ін. заявили, що відносний ризик захворіти гострим респіраторним захворінням склав 2.9 (95% ДІ: 2.8-3.0) у січні- березні, 1.8 (95% ДІ: 1.7-1.9) у жовтні-грудні та 1.4 (95% ДІ: 1.3-1.5) у квітні-червні. Під час дослідження ускладнень від ГРС Babar-Craig та ін.(52) заявили, що 69% пацієнтів звертались під час зимових місяців з листопада до квітня. Аналогічні моделі спостерігались при загостреннях ХРС(53) та інфекцій верхніх респіраторних шляхів.(54)
Було зафіксовано, що зміна клімату викликає біль в ділянці обличчя, аналогічний до ГРС. Чинук або фьон - погодне явище, при якому теплий вітер із високим тиском, що різко рухається, напрямляється до конкретного місця. Зміни тиску, що виникають при чинуку, викликають біль в ділянці обличчя, аналогічний до болю при синуситі. Rudmik та ін. (55) заявили, що порівняно до контрольних суб'єктів, наявність бульозної деформації середньої носової раковини та клиновидно-гратчастих клітин (клітина Оноді; р=0.004) та крупніша за розміром гайморова пазуха (права р=0.015; ліва, р=0.002) пов'язані із скаргами на головний біль, викликаний чинуком.
Проте, оскільки показник Лунд-Маккей був вищим у контрольній групі, автори дійшли висновку, що ХРС навряд чи пов'язаний із болем в ділянці обличчя, викликаним чинуком.
Дія забрудненого повітря,(47, 48, 56) подразники, що використовуються у складі фармацевтичних препаратів,(57) у фотокопіюванні(58) та дим від лісних пожеж(59) пов'язані із посиленням схильності до симптомів ГРС.
Анатомічні фактори, у тому числі клітини Галлера, бульозна деформація середньої носової раковини, викривлення перегородки, атрезія хоан, НП та гіпоплазія пазух пов'язані із ГРС. Під час дослідження комп'ютерної томографії пазух при РГРС порівняно із контрольною групою без риносинуситу Alkire та Bhattacharyya (60) виявили достовірно вищій бал Лунда (2.25 порівняно із 1.27; р<0.001), частіше виявлення клітин Галлера на рентгенограмі (39.9% порівняно із 11.9%; р=0.006) та менша середня ширина гіпофізу (0.591 мм порівняно із 0.823 мм; р<0.001) порівняно з контролем. Вони також відмітили більш високу частоту виникнення бульозної деформації середньої носової раковини (41.7% порівняно із 28.6%) та перегородкових шпор, що травмують (27.8% порівняно із 19.0%), ніж у контрольних суб'єктів, хоча ні один із цих показників не досяг рівня статистичної значущості.
Suonpaa та Antila(47) відмітили ріст частоти виникнення НП у своєму дослідженні ГРС між 1977-1981 рр. та 1982-1986 рр.
У пацієнтів з РГРС слід брати до уваги анатомічні відхилення, у тому числі клітини Галлера та викривлення перегородки, НП, викривлення перегородки та хоанальну закупорку доброякісною лімфоїдною тканиною або одонтогенні джерела інфекції.
У літературі зазначено, що одонтогенні інфекції або інфекції, що походять від зубів визивають гострий гайморит. Bomeli та ін. (61)зазначили, що ороантральний свищ та хвороби періодонту та/або коренів зубів, що виступають, або периапікальний абсцес вважаються серйозними джерелами гострого гаймориту. Окрім того, вони підтвердили, що чим більший ступінь затемнення рідини та потовщення слизової оболонки, тим більша вірогідність джерела зубної інфекції. При рентгенологічному дослідженні гайморових пазух за допомогою комп'ютерної томографії (КТ) у літніх пацієнтів (із зубами та без них) Mathew та ін. (62) відмітили більшу поширеність потовщення слизової оболонки (74.3 на відміну від 25.6; р<0.05) та кіст слизової оболонки (2.1% на відміну від 0) у пацієнтів із зубами порівняно до контрольних суб'єктів без зубів.
У дослідженнях за участю 76 дітей із ГРС Eyigor та Basak (63) заявили, що у 16 (21.1%) було викривлення перегородки, а 25 (32.9%) мали хоанальну закупорку доброякісною лімфоїдною тканиною.
|
Автор, рік, посилання |
Докази |
Тип дослідження |
|---|---|---|
|
Iseh 2010 (44) |
Північно-західна Нігерія, 16.4% зі 1 661 пацієнтів із захворюваннями носа і горла мали ГРС |
Ретроспективний огляд випадків |
|
Treebupachatsakul 2006 (46) |
Таїланд, 1.4% з 292 пацієнтів, які відвідували лікарню Бігіга] з квітня по жовтень 2004, мали ГРС |
Проспективне когортне дослідження |
|
Ogunleye 1999 (45) |
Ібадан, Нігерія, 7% з 90 пацієнтів, які отримали вторинну медичну допомогу, мали ГРС |
Ретроспективний огляд випадків |
|
Suonpaa 1990 (47) |
Частка пацієнтів з гострим фронтитом у клініці вторинної медичної допомоги у Турку, південно- західна Фінляндія, зросла у 3.14 рази між 1977-1981 і 1982-1986 роками |
Ретроспективний огляд випадків |
Роль алергії при ГРС є предметом багатьох суперечливих питань у літературі, що підтримує та оскаржує роль алергії у схильності до ГРС, як показано у Таблиці 3.1.3. У 1989 р. Savolainen(64) заявив, що 25% з 224 пацієнтів із гострим гайморитом мали алергію, що підтверджується анкетуванням з приводу алергій, шкірними пробами та мазками з носа, при чому додаткові 6.5% пацієнтів мали імовірну алергію. Проте, при порівнянні суб'єктів із алергією та без неї різниці у кількості попередніх епізодів ГРС або у результатах бактеріологічних та рентгенологічних аналізів, які підтверджують, що наявність алергії може бути пов'язаною із ГРС, не спостерігалось. У 1993 р. Ciprandi та ін.(65) доказали, що експресія молекули адгезії запалення, ICAM-1, є підвищеною у пацієнтів з АР, схильних до алергії. Оскільки, як було доведено, ICAM-1 є рецепторною молекулою риновірусу, автори припускають, що підвищена експресія ICAM-1 може бути причиною підвищеної схильності до респіраторних інфекцій у пацієнтів із алергією.(66) Пізніше Melvin та ін.(67) показали, що пацієнти із АР та РГРС мали підвищену експресію толл-подібного рецептора 9 (ТПР9) у епітелії носа та пазух порівняно із пацієнтами тільки з АР, що може вказувати на те, що рівень ТПР9 може підвищуватись у відповідь на багаторазові атаки мікробів. Автори пропонують теорію, згідно із якою пошкодження експресії природженого імунного гену може викликати у деяких пацієнтів із АР схильність до подальшого розвитку РГРС. У мишачій моделі АР An та ін.(бв) заявили, що миші із значним набряком слизової оболонки та розширеними венулами через АР (та сенсибілізацію), викликаний овальбуміном, мали значно вищий рівень поліморфноядерних нейтрофілів та еозинофілів після дії S. pneumoniae, ніж миші із індукованим АР, до яких застосовували розчин натрію хлориду. Окрім того, миші без індукованого АР, але із чутливістю до овальбуміну, інфіковані S. pneumoniae, мали значно нижчій рівень поліморфноядерних нейтрофілів, але аналогічний рівень еозинофілов та ІЛ-5 порівняно із чутливими до овальбуміну мишами із АР. Це говорить про те, що має місце алергічна реакція, але не сенсибілізація, підвищує вірогідність інфекції пазух S. pneumoniae. Naclerio та ін. (б9) та Blair та ін. (70) заявили аналогічні результати.
Клінічно ГРС пов'язують із атопією та АР. В одномоментному когортному дослідженні за участю 100 дітей із ознаками рецидивуючих гострих вірусних респіраторних інфекцій порівняно із 1б4 здоровими представниками контрольної групи Mbarek та ін.(71) виявили суттєвий зв'язок між алергією та риносинуситом (р=0.001), а також рецидивуючими гострими вірусними респіраторними інфекціями (р=0.001), назофарингітом (р=0.02) та гострим середнім отитом (р=0.01). У порівняльному дослідженні (з дизайном випадок- контроль) ізраїльських пілотів військово-повітряних сил Ulanovski(72) виявив, що 33% пілотів із випадками АР в анамнезі та 21% з контрольної групи мали один або більше епізодів ГРС (р=0.09). При обмеженні віку пілотів до 2б років, результат склав 57% та 29% (p<0.001) відповідно. Стратифікація пілотів, що мали АР в анамнезі, за типом пілотів дала наступні результати: 54% транспортних пілотів, 34% льотчиків-винищувачів та 13% пілотів гелікоптерів також мали один або кілька епізодів ГРС, порівняно із 28%, 15% та 15% пілотів у контрольних групах. Автори припускають, що більш низька частота поширеності ГРС серед льотчиків-винищувачів порівняно із транспортними пілотами, які в анамнезі мали АР, може бути результатом вазоконстрикції через психологічне та фізіологічне навантаження під час польотних завдань. У ретроспективному аналізі пацієнтів із ознаками фронтального ГРС, проведеного з 1981 р. до 1990 р. у спеціалізованому медичному закладі у Куопіо, Ruoppi та ін.(73) виявили, що 22 з 91 (24%) ідентифікованих пацієнтів мали супутній АР. Schatz та ін. (74) заявили, що можливість появи епізодів ГРС у 4.4 рази вища у пацієнтів із ринітом, ніж у здорових контрольних суб'єктів. Стосовно симптомів Eccles вважав, що зв'язок із чиханням при АР та також при ГРС вказує на імовірний взаємозв'язок між двома станами через стимулювання трійчастого нерва носа.(75) Насправді, бали оцінки симптомів стосовно «чихання» були вищими у дітей із атопією та ГРС, ніж у дітей лише з риносинуситом,(7б) хоча при ГРС було виявлене формування двосторонньої великої гіперчутливості мієлінового нервового волокна трійчастого нерва порівняно із контрольною групою.(77)
Результати також вказують на те, що АР пов'язаний із порушеним мукоциліарним кліренсом.(78) У проспективному дослідженні 125 пацієнтів із АР з використанням сахаринового тесту Vlastos та ін.(78) визначили, що 23 пацієнти із АР та схильністю до синуситу, мали значно вищій час мукоциліарного кліренсу, ніж 102 пацієнти контрольної групи із АР, але без схильності до синуситу (12 та 15 хвилин, відповідно; р=0.02). Для вивчення цієї схильності до риносинуситу при АР є потреба в подальших дослідженнях.
E 2009 h/ Pant та ін.(79)зробили огляд інформації з алергії при риносинуситі. На відміну від вищезазначеної літератури, Pant та ін. дійшли висновку, що для підтвердження того, що сезонний або цілорічний АР є суттєвим провокуючим фактором ГРС, існує замало доказів. Проте, вони підтверджують, що між IgE, мастоцитами та еозинофільною інфільтрацією існує зв'язоку деяких підтипах ХРС, але не при ГРС. На відміну від цієї роботи Lin та колеги нещодавно виявили, що вірогідність розвитку ГРС у дітей із атопією дещо більша.(7б) Вони заявили, що атопічні діти із ГРС проявляли значно більші симптоми (у тому числі запаморочення, чихання, хропіння, свербіж або печія в очах, почервоніння очей та сльозотеча), а також мали значно вищий ступінь занепокоєння, ускладненого дихання, здавленості у грудях та нижчу максимальну швидкість назального вдиху, ніж неатопічні діти із ГРС. АШо(80) заявив, що впродовж вірусного ГРС (або застуди) більша кількість пацієнтів із супутнім АР мала порушене носове дихання, мукоциліарний кліренс та вищі бали іпсілатеральних навколоносових пазух на КТ, ніж пацієнти із РГРС в анамнезі або здорові представники контрольної групи.
|
Автор, рік, посилання |
Докази «за» |
Тип дослідження |
|
Lin 2011(76) |
У дітей з атопією та ГРС частіше зустрічається запаморочення, чхання, хропіння, свербіж та печія в очах, сльозотеча, неспокій, задишка і почуття стиснення у грудях, зниження пікового об’єму вдиху носом порівняно з дітьми без ГРС |
Когортне |
|
Eccles 2011(75) |
Чхання при АР та ГРС опосередковане подразненням трійчастого нерва |
Оглядова стаття |
|
Melvin 2010(67) |
Підвищені рівні ТЬЯ9 визначаються у пацієнтів з АР. Повторні епізоди ГРС порівнювалися тільки з пацієнтами з АР |
Когортне дослідження |
|
Vlastos 2009(78) |
У пацієнтів з АР та схильністю до синуситів відмічається збільшення часу мукоціліарного очищення, ніж у пацієнтів з АР без схильності до синуситів |
Когортне дослідження |
|
Ulanovski |
У пілотів з АР в анамнезі частіше реєструвався ГРС, ніж у пілотів без АР в анамнезі |
Ревізійна перевірка |
|
Mbarek 2008(71) |
У дітей з рецидивуючими інфекціями верхніх дихальних шляхів порівняно зі здоровими дітьми відмічався значний зв’язок між алергією та риносинуситом |
Перехресне когортне дослідження |
|
Schatz 2008 (74) |
Пацієнти з АР в 4.4 рази частіше мали ГРС порівняно з контрольною групою |
Ретроспективне когортне дослідження |
|
Ciprandi |
У дітей з алергією зустрічаються частіші та тяжчі респіраторні інфекції, ніж у дітей без алергії |
Когортне дослідження |
|
An 2007(68) Naclerio 2006(69) Blair 2001(70) |
У моделі на лабораторних мишах більш тривала локальна алергічна реакція спостерігається при поєднаній бактеріальній інфекції приносових пазух |
Доклінічне вивчення на тваринах |
|
Alho 2004(80) |
Порушеня носового дихання та мукоціліарного кліренсу були більш виражені у пацієнтів з АР ніж у пацієнтів з ГРС в анамнезі або в групі контролю |
Когортне дослідження |
|
Kirtsreesakul |
Бактеріальна інфекція пазухи (у мишей), що поєднується з локальною алергічною реакцією, може бути частково зупинена антагоністом Н1- рецепторів - дезлоратадином (модель на мишах) |
Доклінічне вивчення на тваринах |
|
Ciprandi 1999 |
Антигістамін, терфенадин зменшують експресію ІСАМ-1 та симптоми ГРС у дітей |
Рандомізоване |
|
Braun 1997 (83) |
Додавання лоратадину до стандартної схеми терапії ГРС на тлі АР зменшило вираженість симптомів порівняно з пацієнтами з АР та ГРС, що отримували плацебо |
Рандомізоване плацебо контрольоване клінічне дослідження |
|
Ciprandi 1993 |
Діти з алергією мають більшу адгезивну здатність ІСАМ-1, який є рецептором до риновірусу |
Когортне дослідження |
|
Ruoppi 1993 (73) |
24% пацієнтів, що звернулися з повторним фронтитом, мали супутній АР |
Ретроспективне когортне дослідження |
|
Savolainen 1989 |
25% з 224 пацієнтів з ГРС мали позитивні шкіряні алергічні тести та симптоми алергії з подальшим у 6.5% випадків прогресуванням алергії |
Клінічне дослідження |
|
Дослідження, автор, рік |
Докази «проти» |
Тип дослідження |
|
Iseh 2010 (44) |
Тільки у пацієнтів з ХРС, на відміну від пацієнтів з ГРС, визначено алергічну складову хвороби |
Ретроспективне когортне дослідження |
|
Pant 2009 (79) |
Недостатньо даних щодо ролі сезонного чи постійного АР у розвитку ГРС. IgE, тучні клітини та еозинофільна інфільтрація виявляється в деяких варіантах ХРС на відміну від ГРС |
Оглядова стаття |
|
Savolainen 1989 |
Відсутня вірогідна різниця між показниками рентгенологічного чи бактеріологічного обстеження у пацієнтів з алергією та без алергії |
Клінічне дослідження |
Коментар робочої групи: станом на 10.03.2015 року в Укаїні терфенадин (АТС-код: R06AX12) не зареєстрований.
Було доведено, що циліарне порушення є характерною рисою як вірусного, так і бактеріального риносинуситу.(8) Це порушення включає як втрату війок та війкових клітин, так і порушення нормального мукоциліарного транспорту. Факторами порушення функції війок є куріння та алергія. Насправді, порушений мукоциліарний кліренс у пацієнтів з АР робить їх схильними до ГРС.(78)
Циліарна функція слабшає при вірусному та бактеріальному риносинуситі. Також було доведено, що факторами порушення функцій війок є куріння та алергія, хоча, щоб глибше зрозуміти ці процеси, знадобиться проведення досліджень.
Пошкодження війок також пов'язують із курінням цигарок. Згідно із дослідженнями in vitro конденсат цигаркового диму та його екстракт порушує циліогенез у залежності від дозування.(84) Також клінічні дослідження показали, що дія пасивного куріння збільшує рівень матричної металопротеїнази 9 (ММП-9) у дітей,(85) що підвергнуті дії пасивного куріння, значно збільшується рівень желатинази, пов'язаної із моделюванням тканин, у назальному секреті. Оскільки при гострій алергічній реакції у носі та легенях було виявлено підвищене вироблення ММП-9, знадобляться додаткові дослідження ускладнень з точки зору залучення ММП-9, циліарної функції, алергічної реакції та куріння при ГРС.
Первинна циліарна дискінезія (ПЦД) є рідкісним аутосомно-рецесивним розладом, при якому цилії або нерухомі, або рухаються таким чином, що порушується транспорт слизової повітряних шляхів. ПЦД пов'язана із хронічними симптомами верхніх дихальних шляхів, у тому числі із виділеннями із носа (епізодичним болем в ділянці обличчя та втратою нюху) та бронхоектазами,(86) при чому у новонароджених проявляється тривала ринорея з першого дня життя.(87-89) Щодо поширеності ПЦД існує обмежена кількість інформації. У норвезькому дослідженні, що проводилось у 1947 р. та 1949 р. виявили поширеність ПЦД 1:40 000.(90) Проте, це рентгенологічне дослідження, скоріш за все, дає занижену оцінку через обмеженість стандартних рентгенограм грудної клітини при виявленні бронхоектазів, та через те, що бронхоектази, можливо, ще не проявилися у пацієнтів молодшого віку, які брали участь у досліджені. Згідно із даними за 1976 - 1990 рр. було встановлено, що поширеність у Швеції варіювала від 1:22 000 до 1:10 000,(91) різниця у показниках поширеності, можливо, була результатом недостатньої діагностики стану. Найвища поширеність, 1:4 100, була заявлена у дослідженні віддалених наслідків атомного бомбардування Хіросіми та Нагасакі.(92) Частота випадків ГРС у цих групах пацієнтів не наводилась.
У дослідженні за участю 38 пацієнтів із бронхіектазами стверджувалось, що ПЦД є відповідальною за 13% випадків та була більш поширеною серед пацієнтів з Північної Африки, ніж Європи.(93) Barbato та ін.(94) від Робочої групи з вивчення ПЦД Європейського респіраторного суспільства (ERS) заявляють, що РГРС у пацієнтів з ПЦД зустрічається рідко, хоча його прояви потрібно лікувати «тривалим курсом підходящого(их) антибіотика(ів)».(95-97) Зі згоди Робочої групи ERS Bush та ін. стверджують, що інфекції верхніх (та нижніх) дихальних шляхів потрібно лікувати агресивно, і що хвороби легень зазвичай стабілізуються одразу ж після початку лікування. Хоча й існують докази того, що лікування ГРС запобігає рецидиву або виникненню хронічного стану.(49) Невідомо чи можна застосовувати це до групи з ПЦД. За відсутністю інфекції нижніх дихальних шляхів вплив гострого або рецидивуючого ГРС на прогресування ПЦД, пов'язаного із брохоектатичною хворобою легень, невідомий.
Стосовно впливу куріння на ГРС існує небагато досліджень. На підставі даних Національного анкетування з питань здоров'я 1970 р. та після виключення родин із дітьми із хронічною респіраторною хворобою, Bonham та Wilson(98) заявили, що у дітей з сімей, в яких один чи кілька дорослих курять, було більше днів із обмеженою активністю та ліжковим режимом, ніж у дітей з родин, в яких дорослі не курять. Було виявлено, що різниця є результатом того, що діти з родин, в яких присутні активні курці, більш схильні до частіших епізодів гострого респіраторного захворювання (у тому числі ГРС). Аналогічні достовірні результати було виявлено при порівнянні родин, які споживають 45 або більше цигарок на день, із родинами, у яких дорослі не палять. Автори дійшли висновку, що підвищена схильність до гострого респіраторного захворювання пов'язана із активнішим споживанням цигарок. У дослідженні за участю 76 пацієнтів-дітей із гострим риносинуситом віком 4-18 років Eyigor та Ba§ak(63) виявили, що 51.3% (39 пацієнтів) піддавались дії пасивного куріння, а 2.6% (2 пацієнти) були активними курцями). На підставі своєї групи автори дійшли висновку, що активне та пасивне куріння є провокуючими факторами ГРС. Згідно із дослідженням, що характеризує респіраторні симптоми дорослих робітників поштової служби у Загребі, Хорватія, поширеність синуситу в активних курців склала 53.1% порівняно із 26.4% серед тих, хто не курить, хоча була відсутня інформація про те, який характер носив синусит: рецидивуючий гострий або хронічний.(99)
Активні курці із існуючим алергічним запаленням мають підвищену чутливість до ГРС порівняно до некурців із існуючим алергічним запаленням, це говорить про те, що куріння та алергічне запалення зумовлюються різними та, можливо, синергічними механізмами. Для вивчення цих механізмів потребуються дослідження.
Вплив пасивного табакокуріння на симптоми риносинуситу оцінювали у пацієнтів із АР.(100) Згідно із цим дослідженням пацієнти із АР, які піддаються дії пасивного куріння, мали більш симптомів, що вказують на риносинусит, у том числі біль в ділянці обличчя, приплив крові до обличчя або припухлість обличчя, та більша їх частина отримувала ліки від риносинуситу, у тому числі антибіотики від респіраторних проблем, за попередні 12 тижнів, порівняно із контрольними групами стосовно цієї хвороби. Хоча автори не оцінювали виникнення ГРС, більша частина пацієнтів, що потребувала антибіотиків від респіраторних проблем, вказує на те, що пацієнти, які піддаються дії пасивного куріння, можливо, мали більше епізодів ГРС або РГРС, хоча автори не розмежовують антибіотики на групи антибіотиків для лікування верхніх або нижніх дихальних шляхів.
Було доведено, що активне та пасивне куріння змінює нормальну бактеріальну флору, присутню у носоглотковому просторі, що призводить до колонізації більшої кількості можливих патогнеів, ніж у тих, хто не курить.(101) Як було показано, після припинення куріння популяція мікробів знову стає такою ж, як і у тих, хто не курить.(102) Вплив програм припинення куріння на захворюванність та поширеність ГРС невідомий.
Нещодавні дослідження in vitro та in vivo показали підвищене вироблення ММП- 9 у дітей, що піддаються впливу пасивного куріння,(85) та збільшену активацію компліменту у респіраторних епітеліальних клітинах людини та у мишей, що піддавались дії екстракту цигаркового диму.(103) Чи створює підвищене вироблення ММП-9 або активація компліменту через вплив цигаркового диму схильність до ГРС - невідомо та потребує додаткових досліджень.
Про зв'язок між ГРС та ларингофарингеальним рефлюксом відомо мало. Згідно із оглядом Pacheco-Galvan та ін.(104) епідеміологічні дослідження, проведені між 1997 р. та 2006 р., показали достовірні зв'язки між гастроезофагеальною рефлюксною хворобою та синуситом. Проте, у нещодавньому систематичному огляді Flook та Kumar довели лише слабкий зв'язок між кислотним рефлюксом, назальними симптомами та ГРС.(105)
Погане психічне здоров'я або тривогу та депресію значно пов'язують із ГРС.(106) У дослідженні за участю 47 202 студентів-колег віком від 18 до 24 років Adams та ін. (106) заявили, що поширеність гострих інфекційних захворювань, до яких відносяться бронхіт, інфекція вух, синусит та стрептококовий фарингіт, варіюється від 8% до 29%, а поширеність тривоги та депресії варіювалась від 12% до 20% відповідно.
Погане психічне здоров 'я, тривога або депресія пов 'язані із схильністю до ГРС, хоча механізми, що лежать в основі цього явища, невідомі.
До найбільш поширених бактеріальних патогенів, що спричиняють ГБРС, відносяться S. pneumoniae, H. influenzae, S. pyrogenes, M. Catarrhalis та S. aureus.(8) Для лікування легкого ГРС головним чином використовують такі антибіотики як амоксицилін/клавуланат. Незважаючи на стійкість до амоксициліну, було підраховано, що приблизно 80% випадків легкого ГРС реагують на амоксицилін при дозуванні 70-90 мг/кг/день. Насправді, Principi та Esposito стверджують, що більшість випадків H. influenzae та M. Catharralis та приблизно 15% S. pneumoniae регресують спонтанно.(107)
Амоксицилін є найпоширенішим антибіотиком, що використовується для лікування легкого ГРС. Проте, збільшення резистентності до амоксициліну, зокрема, при інфекціях, викликаних S. pneumoniae та H. influenzae, слід розглядати з обережністю. Окрім того, зміни у бактеріальній патогенності при гострому бактеріальному риносинуситу вимагають перегляду терапії з використанням антибіотиків.
Введення пневмококової кон'югованої вакцини призвело до змін у патогенному профілі ГРС. Brook та Gober(108)звітували про зменшення захворюваності на S. pneumoniae з 44% до 27% та про збільшення захворюваності на H. influenzae з 37% до 44%, S. pyrogenes - 7% до 12%, а S. aureus - з 4% до 8%, при чому змін щодо M. catharralis не сталось (з 13% до 14%).
Із введенням пневмококової кон'югованої вакцини (ПКВ7) зменшення частоти хвороб, викликаних S. pneumoniae, загальна резистентність та високий рівень бактеріальної резистентності пов'язують із високо поширеністю H. influenzae, що виробляє ß-лактамазу(109) Проте, починають з'являтися докази посилення резистентності до антибіотиків у серотипів S. pneumoniae, що не присутні у ПКВ7.(110) Rybak (111) межах американського елементу лонгітудінального глобального моніторингового дослідження резистентності до антибіотиків PROTEKT за 2000-2001 рр. виявив резистентність S. pneumoniae до бета-лактамів, макролідів та фторхінолону, але не до телітроміцину.
У 2004 р. Huang та ін. заявили про резистентність у 74.4% S. pneumoniae, 60.5% H. influenzae та 58.3% M. catharralis до антибіотиків першого ряду. Sahm та ін.(112) стверджують, що 40% із 847 ізолятів з пазух були резистентними до двох або більше антибіотиків, що тестувались, та повторювали резистентність до амоксициліну/клавуланату. У 2011 р. Lin та ін.(76) заявили, що 70% ізолятів S. pneumoniae та 71.4% ізолятів H. influenzae, отриманих від 69 дітей, були резистентними до амоксициліну/клавуланату.
Зміни бактеріальної патогенності при ГБРС вимагають перегляду щодо антибіотикотерапії.
Діти із хронічними хворобами, у яких проявляються грипоподібні симптоми, повинні знаходитись на обліку стосовно бактеріального ГРС. Вплив хронічної хвороби на вірогідність виникнення ГРС у дорослих невідомий.
Супутні хронічні хвороби (бронхіт, астма, серцево-судинні хвороби, цукровий діабет або злоякісний рак) у дітей пов'язують із підвищеним ризиком виникнення ГРС на фоні грипу.
Loughlin та ін.(113) заявили, що загальна захворюваність ГРС після грипу варіюється від 0.9 до 1.3 у дітей віком від 0 до 14 років. А захворюваність ГРС на фоні грипу у здорових дітей віком 5-14 років складала 1.2 (95% ДІ: 0.9-1.5), цей показник збільшується до 3.1 (95% ДІ: 1.5-5.8) у дітей з хронічними хворобами (відносний ризик: 2.7 (95% ДІ: 1.5-5.4). Може бути необхідним посилений нагляд за дітьми із хронічними хворобами, у яких з'явився грип.
Гострий риносинусит є поширеною хворобою та може бути поділений на гострий вірусний риносинусит та гострий бактеріальний риносинусит, йому часто передує вірусний риніт або звичайна застуда. У цьому дослідженні розглядаються механізми запалення, що лежать в основі вірусного риніту, гострого вірусного риносинуситу та гострого бактеріального риносинуситу. Перш за все, господар повинен визнати наявність мікроорганізмів через «розпізнання патерну», запустивши імунологічні захисні механізми через активацію кількох сигнальних шляхів. Імунологічні захисні механізми складаються з клітинної імунної реакції та вивільнення розчинних хімічних факторів, що функціонують в організмі за допомогою складної взаємодії із цитокінами та іншими медіаторами.
Теоретично ГРС можна поділити на вірусний (звичайна застуда), поствірусний та бактеріальний ГРС (ГБРС), вони зазвичай виникають у такому ж порядку. Проте, вірусний, поствірусний та бактеріальний ГРС проявляють значну паралельність у своїх механізмах запалення та у своїх клінічних проявах. Вірусна інфекція носа та пазух викликає багато змін, у тому числі поствірусне запалення, що збільшує ризик бактеріальної суперінфекції. До цих змін відноситься пошкодження епітелію та механічні, гуморальні та клітинні захисні механізми.
ГРС може викликатись вірусною або бактеріальною інфекцією.
Найбільш розповсюдженими вірусами, ізольованими при вірусному риніті та риносинуситі у дорослих, є риновіруси та коронавіруси. Вважається, що риновіруси нараховують приблизно 50% всіх застуд. До інших вірусів, ізольованих при звичайній застуді, відносяться віруси грипу, парагрипу, аденовірус, респіраторний синцитіальний вірус (РСВ) та ентеровірус.(114)
Гострому бактеріальному риносинуситу (ГБРС) зазвичай передує вірусний та/або поствірусний ГРС.
Найчастіше при ГБРС зустрічаються бактерії, що належать до «пекельної трійки» (S. pneumoniae, Haemophilus influenza та M. catarrhalis) та S. aureus. Також при ГБРС зустрічаються й інші види стрептококів та анаеробних бактерій.(115-117) Payne та Benninger провели мета-аналіз 25 досліджень з мікробіології ГБРС, в яких вивчається розповсюдженість бактерій, що найбільш часто зустрічаються у середній частині носового ходу та у гайморових пазухах. У гайморових пазухах містились 26% S. pneumoniae, 28% H. influenza, 6% M. catarrhalis та 8% S. aureus. Ці результати співвідносились із результатами стосовно середнього ходу та відповідно складали 34%, 29%, 11% та 14%.(115) У дослідженні, в якому порівнювались носоглоткові посіви, взяті у дітей до та після введення пневмококової кон'югатної вакцини, Brook та Gober(108) спостерігали зниження частоти виявлення S. pneumoniae з 44% до 27% та збільшення частоти виявлення H. influenza з 37% до 44%, S. pyrogenes з 7% до 12% та S. aureus з 4% до 8%, при чому у M. catarrhalis змін виявлено не було (з 13% до 14%).
Потраплянню інфекційних агентів до організму запобігають різноманітні фізичні та біохімічні бар'єри. Перш за все, в організмі людини містяться різноманітні фізичні бар'єри, що захищають від потрапляння мікроорганізмів. До найважливіших відноситься шкіра та слизова оболонка дихальних шляхів. Епітеліальні клітини є першим бар'єром, який контактує з вірусами або бактеріями. Вони виробляють та виділяють медіатори та рецептори для активації механізмів звільнення. Секреція слизі бокалоподібними клітинами запобігає зціпленню мікроорганізмів із епітеліальними клітинами, таким чином, запобігаючи їх потраплянню до організму. Мікроорганізми затримуються слиззю та механічно видаляються з дихальних шляхів рухами війок війкових клітин.(118)
По-друге, екосистема людини проводить відбір потенційних мікроорганізмів. Екосистема зумовлюється багатьма параметрами, такими як температура, рН або тиском О2. Вижити та інфікувати людину можуть лише мікроорганізми, що мають потребу в екосистемі, аналогічну екосистемі внутрішнього середовища організму людини (118).
Віруси - це виключно внутрішньоклітинні мікроорганізми, які для своєї репродукції мають потребу в клітинах господаря. Вони прикріплюються до клітин господаря за допомогою відносно специфічної міжмолекулярної взаємодії між нуклеокапсидами (у «роздягнутих» вірусів) або мембрани вірусу (в оболонкових вірусах) та молекулами мембрани клітини господаря, які діють в якості рецептора. Ця специфічна молекулярна взаємодія вказує на спостережувану специфічність між деякими типами вірусів та конкретними системами органів.(119)
Вірусна інфекція носа та пазух викликає багато змін, що збільшують ризик бактеріальної суперінфекції.
Риновіруси, наприклад, інфікують епітеліальні клітини дихальних шляхів, зв'язуючись із рецепторами ICAM-1 на поверхні клітини.(120, 121) Далі вірус проникає до клітини, починається репродукція вірусної РНК.(122, 123) Експресія ICAM-1 підвищується самим риновірусом, через (ОТ^-КВ-залежні механізми ІЛ-1 бета та ядерного фактора, таким чином збільшуючи свої власні інфекційні властивості та сприяючи інфільтрації клітини запалення. (120, 122, 124) Bianco та ін. показали, що експресія ICAM-1 збільшується ІЛ-13 цитокіну Th2 в атопічних дихальних шляхах.(125) При чому при риновірусі інфекція знижує рівень ICAM-1 на інфікованій клітині, зменшуючи кількість доступних ділянок зв'язування клітин, до яких кріпиться вірус, та обмежуючи інфекційні властивості господаря.(121)
Бактеріальна суперінфекція залежить як від особливостей господаря, так і від особливостей бактерії.(119)
Нормальний анатомічний, гістологічний та функціональний стан тканин господаря зазвичай запобігає бактеріальній інфекції.(119) До факторів, що пов'язані із ГБРС, відносяться патогени, пошкодження війок, алергія (див. далі), H. pylori, ларингофарингеальний рефлюкс та назотрахеальна інтубація або наявність назогастрального зонда.(8) Через вірусну інфекцію, алергію або інші фактори у носі та навколоносових пазухах можуть з'явитися численні зміни. Вірусна інфекція є причиною розривів епітелію, збільшує кількість бокалоподібних клітин та зменшує кількість війкових клітин.(126) Згодом, ці зміни сприяють закупорюванню отворів пазух у носовій порожнині.(127) У порожнині пазух з'являється тимчасове підвищення тиску через накопичення слизу. Після цього у порожнині пазух раптово виникає негативний тиск через пошкоджену вентиляцію пазух із швидким поглинанням кисню, який залишився у порожнині пазух (128). Далі це погіршується місцевим застоєм, сприяє подальшому затриманню слизу, порушує нормальний обмін газів у всій порожнині, знижує вміст кисню та рН, перешкоджає виведенню інфекційного матеріалу та продуктів розпаду запального процесу та підвищує ризик розвитку бактеріальної інфекції.(126, 127, 129, 130) Всі ці локальні зміни у носі та навкоголоносовому просторі формують ідеальне середовище для колонізації та росту бактерій.(131)
ГБРС головним чином викликається Streptococcus pneumoniae, Haemophilus influenza, Moraxella catarrhalis та Staphylococcus aureus.
Вірусна інфекція назальної тканини також може безпосередньо посилити зціплення бактерій із епітеліальними клітинами у носі. Wang та ін. помітили достовірне посилення зціплення S. aureus, S. pneumoniae та H. influenza із клітинами, інфікованими риновірусом.(132) Вони стверджували, що збільшена експресія молекул адгезії клітин господаря в епітеліальних клітинах носа після інфікування риновірусом може бути механізмом підвищеної схильності до ГБРС, пов'язаного із інфекціями верхніх респіраторних шляхів, (132) викликаними риновірусом (132) .
Інші дослідження підтвердили переважний зв'язок та взаємодію між вірусами та бактеріями, наприклад, вірусом грипу А та стрептококовою інфекцією, та риновірусом людини 14 та S. pneumoniae.(133) Механізм цієї суперінфекції може бути пов'язаним із вірусною репродукцією, що підвищує адгезію бактерій.
Потраплянню інфекційних агентів до носа та пазух запобігають різноманітні фізичні та біохімічні бар 'єри.
Наряду з особливостями господаря у бактеріальній суперінфекції також беруть участь і бактеріальні особливості. S. pneumoniae та H. influenza є патогенними через структуру своєї капсули, що дає їм інвазивну активність. Інші бактерії, наприклад стрептококи, стафілококи та грам-негативні бактерії, виробляють токсини, спрямовані проти імунної системи, лейкоцитів або епітеліальних клітин, що дозволяє їм легше проникати та розмножуватися.(119)
Якщо мікроорганізмам вдалось потрапити до організму, вступають в дію два головні захисні механізми проти інфекцій. Перший - неспецифічна фаза, при якій слиз та його складові (наприклад, лізоцим, лактоферин та дефензин) відіграють головну роль (природжений імунітет). До другої відноситься імунна реакція та запальна реакція (набутий імунітет).
Після проникнення вірусу до клітин господаря активуються імунні системи господаря. Клітини, що переносять вірусні патогени усередину, повинні бути видалені, щоб вивести вірус з організму. Вважається, що природжена імунна система є достатньою для очищення організму від вірусної інфекції.(118)
Також у випадку бактеріальної інфекції імунітет господаря повинен видалити бактерії з організму. Проте, вважається, що необхідна активація набутої імунної системи для виведення бактерій та очищення від пов'язаного із ними запалення.(134)
Для належної роботи імунна система повинна уміти розпізнавати мікробні зразки та відрізняти їх від молекулярних структур, присутніх на клітинах господаря. Специфічні класи патогенів виділяють клас-специфічні молекули, патоген-асоційовані молекулярні патерни (ПАМП). Активація рецепторів ПАМП, наприклад, толл-подібних рецепторів (ТПР), викликає багато сигнальних каскадів, що передбачають активацію комплементу, гемостаз, фагоцитоз, запалення та апоптоз у відповідь до патогенів. Наприклад, активація ТПР- залежних сигнальних шляхів сприяє активації набутої імунної реакції через експресію ефекторних молекул, таких як запальних цитокинів, хемокинів та інших ко-стимулюючих молекул. (135-137)
У людей було описано десять явних ТПР. Вони експресуються у різноманітних комбінаціях у клітинах імунної системи, а також інших типах клітин.(138) іРНК всіх десяти ТПР була описана для тканин дихальних шляхів носа людини. Проте, для більшості ТПР у носі не вистачає перевірки білків.(139) Відповідні білки було зафіксовано для ТПР-2, ТПР-3, ТПР-4 та ТПР-5.(140)
Kunzelmann та ін. заявили, що в інгібіруванні іонного транспорту у відповідь на вірусні респіраторні інфекції задіяний ТПР-4. Вони вивчали вплив РСВ на іонний транспорт в епітелії трахеї у мишей та доказали, що РСВ інгібірує транспорт Ка+ в епітелії за кілька хвилин після зв'язування із апікальною мембраною. Вони також підтвердили, що це інгібування зумовлюється протеїнкіназою С та толл-подібним рецептором 4 (ТПР-4) та є характерним для накопичення рідини, що спостерігається після інфекції РСВ.(141) Раніше інгібування транспорту Ка+ в епітелії також спостерігали після інфікування вірусом грипу - вірусом парагрипу(142 143)
Бактерії можуть розпізнаватись природженою імунною системою через експресію неметильованих CpG-ланок у своїй ДНК, викликаючи активацію ТПР-9.(144, 145) Шлях ТПР-9 відомий своєю здатністю викликати імунну реакцію ТИ1, таким чином придушуючи алергічні реакції, що задіюють ТЬ-2.(146, 147)
Mansson та ін. показали, що введення CpG до носа людини посилює опір дихальних шляхів носа, вироблення оксиду азоту у носі та секрецію ІЛ-1бета, ІЛ-6 та ІЛ-8. Останнє відображає здатність CpG викликати прозапальну Th1-подібну імунну реакцію.(148)
Іншим відомим ПАМП у бактерій є ліпополісахарид, який є частиною зовнішньої мембрани грам-негативних бактерій. Ліпополісахарид викликав активацію шляхів ТПР-4, призводячи до посиленої транскрипції ядерного фактору - КБ-КБ-генів, що регулює такі гени, як ті, що кодують цитокіни та хемокіни.(149-151) Це збільшує бактерицидну активність фагоцитарних клітин та стимулює визрівання та міграцію дендритних клітин. Ці зрілі дендритні клітини проявляють збільшену антиген-представляючу здатність та беруть участь в активації набутої імунної реакції, стимулюючи Т-лімфоцити. Таким чином, сигнальний шлях ТПР-4 формує критичний зв'язок між природною та набутою імунними реакціями(152, 153)
Було доведено, що при інфікуванні S. pneumoniae запальні реакції також викликають ліпотеіхоєва кислота та пневмолізин. Це відбувається за допомогою активації шляху ТПР-2. Було підтверджено, що шлях ТПР-2 сприяє набутій, а не природженій, імунній реакції за допомогою експресії ко-стимулюючих молекул та таких молекул, як ГКГС-ІІ, що є необхідними для введення бактеріального антигену до клітини Th. Цитокіни, що походять від шляху ТПР-2, стимулюють реакцію Th1, яка є дуже важливою для знищення колонізації пневмококів.(154-157) Було запропоновано, що пневмолізин також може взаємодіяти із ТПР-4, викликаючи природні імунні реакції на пневмококів. Проте, Van Rossum та ін. не знайшли підтвердження ролі ТПР-4 у знищенні колонізації пневмококів у своїх модельних мишах. (156, 158)
Як було зазначено вище, перша захисна стратегія господаря проти інфекції складається з неспецифічної фази, при якій слиз та його складові (наприклад дефензин та лізоцим) грають головну роль. Іншими значущими розчинними хімічними факторами є такі білки гострої фази, як С-реактивний білок, інтерферон, лактоферрин, sIgA та система комплементу.(159)
Дефензин відіграє важливу роль у захисті проти оболонкових та необолонкових вірусів. Цей білок присутній в імунних клітинах та допомагає вбивати фагоцитовані патогени. Дефензини можуть зв'язуватися із мембраною клітини мікроба, формуючи дефекти у мембрані, що нагадують пори, це дозволяє основним іонам та поживним речовинам витікати.(159)
Igarashi та ін. проаналізували рідини назального лаважу на білки та медіатори мастоцитів після посіву риновирусу. Вони спостерігали підвищену секрецію загального білка, білків плазми (альбумін та IgG) та секретів (лактоферин, лізоцим, та секреторний IgA). Вони також довели, що носові секрети під час первинної реакції на інфекцію риновірусу були переважно результатом підвищеної проникності судин.(160)
При бактеріальній інфекції важливу роль відіграє як лізоцим, так і дефензин. Лізоцим присутній у ряді секретів (слина, сльози та слиз) та виконує свою захисну функцію, розщеплюючи протеоглікан стінки клітини бактерії. С-реактивний білок (СРБ), найбільш відомий білок гострої фази, здатен реагувати конкретно проти частини капсули пневмококу. Проте, він також діє проти багатьох інших бактерій. Також у захисті господаря від бактерій бере участь і система комплементу, яка задіює природжену та набуту імунну систему.(118)
Брадикінін та лізілбрадикінін у назальному лаважі інфікованих та симптоматичних добровольців, яким вводили риновірус, були достовірно підвищені.(161, 162) Проте, вироблення кінінів також підтверджується і при інших вірусних інфекціях. Продукція кініну пов'язана із підвищеною інфільтрацією нейтрофілів та із виробленням прозапального цитокіну ІЛ-1.(161- 163) Вони можуть стимулювати виділення залозами слизу, підвищувати частоту рухів війок, стимулювати закінчення чутливих нервів та збільшувати прохідність судин.(164, 165) Проте, як було заявлено, прохідність судин, викликана брадикініном, зумовлюється, принаймні, частково, оксидом азоту.(166)
Також у відповідь на бактеріальну інфекцію спостерігали вивільнення брадикініну. Бактеріальні протеази можуть активувати каскад «фактор Хагемана - калікреін - кінін», призводячи до продукції брадикініну. Як було зазначено вище, брадикінін є важливим фактором для збільшення прохідності судин та може стимулювати чутливі нерви. Цим пояснюється більшість запальних реакцій, у тому числі набряки та біль.(167) Також було доведено, що вироблення брадикініну призводить до активації NOS, підтверджуючи потенційну роль NO у цьому патофізіологічному процесі.(167)
NO є молекулою, що синтезується NO-синтетазою (NOS) - ферментом, що каталізує оксидацію L-агрініну до NO та L-цитруліну. Щонайменше, можна назвати два типи NOS, конститутивна NOS (cNOS) та індуцибельна NOS (iNOS).(168) cNOS виробляється багатьма клітинами у верхній та нижній респіраторній системі та війковими клітинами слизової оболонки.(169) iNOS описана в епітеліоцитах, макрофагах, фібробластах, нейтрофілах, ендотеліоцитах та гладких м'язах; активується прозапальними цитокінами та ендотоксинами(168, 170, 171) NO бере участь у багатьох фізіологічних та патологічних процесах людини, виконуючи роль сигнальної молекули клітини. В організмі бере участь в: судиній регуляції, гемостазі, передачі нервового імпульсу, імунному захисті та диханні(168) У дихальних шляхах NO розслаблює гладкі м'язи, впливає на частоту рухів війок, секрецію слизу та виділення плазми; бере участь у передачі нервового імпульсу, запаленні та клітинному імунітеті (172)
При астмі, АР та вірусних респіраторних інфекціях спостерігається збільшення концентрації NO.(168) Під час інфекцій NO виробляється у великих кількостях через його противірусну та протимікробну дію та за допомогою збільшення рухливості війок.(173-175)
У пацієнтів із риносинуситом, навпаки, рівень назального NO (nNO) значно знижений. Цей знижений рівень nNO, вірогідно, є результатом послабленого притоку NO до носової порожнини через набряк слизової оболонки та дренаж обструкції порожнини та виведення NO реактивними видами кисню.(168, 176, 177) Вважається, що нестача NO може сприяти патогенезу синуситу.
Під час пневмококової інфекції, iNOS виробляє NO у макрофагах людини та гризунів. Це може сприяти знищенню пневмококів всередині клітини після їх фагоцитозу.(178)
Стимуляція симпатичних нервів викликає вазоконстрикцію та, відповідно, знижує опір дихальних шляхів носа. Стимуляція парасимпатичних нервів, з іншого боку, сприяє секреції залозами носа, що спричиняю обструкцію носа. Слизова оболонка носа також містить нерви неадренергічної, нехолінергічної (NANC) системи. Є припущення, що нейропептиди з останніх нервів (речовина Р, нейролікін А та К та пептид, генетично споріднений з кальцитоніном) відіграють роль у розширенні судин, секреції слизу, виділенні плазми, нейрогенному запаленні та взаємодії між мастоцитами та нервами. Проте, ступінь їх участі є неясним.(179) Знадобляться подальші дослідження стосовно ролі нервової системи у патогенезі ГРС.
Додатково до неспецифічного захисту, що складається з бар'єрів та хімічних факторів, активується клітинна імунна реакція.
Природжена імунна система діє через фагоцити мікроорганізмів. Клітинами із фагоцитними властивостями є нейтрофіли, моноцити та макрофаги.
Через свою внутрішньоклітинну природу, клітинні імунні реакції є важливими для знищення вірусної інфекції. Ця реакція клітин запалення складається, головним чином, з нейтрофілів, моноцитів та макрофагів. Через 24 години після посіву спостерігають збільшену кількість нейтрофілів у слизовій оболонці носа, секрецій з носа та у периферичній крові. Через кілька днів відбувається поповнення моноцитів. Ці моноцити стають макрофагами тканини після того, як вони перетинають ендотелій.(180)
Макрофаги та нейтрофіли також стимулюються бактеріальною інфекцією. Gabr та ін. досліджували імунну реакцію на гостру інфекцію, викликану S. pneumoniae. Наївний господар реагував активацією природженої імунної системи. Поліморфноядерні клітини та макрофаги були залучені в місцях інфекції.(181) Залучення нейтрофілів стається через вивільнення хемотаксичних факторів. Пневмолізин, полісахаридна капсула та ліпотейхоєва кислота можуть виступати у якості активуючих факторів, що активують нейтрофілів під час гострої інфекції. Окрім того, також фактор компліменту С5а, хемотаксичний фактор нейтрофілу із високою молекулярною масою, фактор активації тромбоцитів, ІЛ-1 та ІЛ-8 та лейкотрієни, такі як лейкотрієн В4, можуть виступати у якості хемоатрактантів до нейтрофілів, незалежно від Т-хелперів.(181)
Набута імунна система активується специфічним подразником. Специфічні антигени презентуються Т-лімфоцитам (цитотоксичні Т-клітини, а також Т-хелпери), антигенпредставляючими клітинами такими як моноцити, макрофаги, В-лімфоцити та дендритні клітини.
У периферичній крові визначено два головних підтипи дендритних клітин: мієлоїдні дендритні клітини (МДК) та плазмацитоїдні дендритні клітини (ПДК).(182) Hartmann та ін. підтвердили наявність ПДК та МДК у здоровому епітелії носа та в епітелії носа пацієнтів із різноманітними патологічними станами.(183)
Антигенпредставляючі клітини повинні обробити комплексні білкові антигени до «мінімальних антигенних пептидів», що презентуються Т-клітинам на відповідних молекулах ГКГС. Зв'язування цього комплексу (антигенний пептид та молекула ГКГС) із антиген-специфічним рецептором Т-клітини активує набутий імунітет.(184)
ПДК грають ключову роль у виявленні вірусів в епітелії носа та у захисті від них. Після розпізнавання вірусів вони починають продукувати велику кількість альфа- інтерферону. Hartmann та ін. показали, що у здоровому епітелії носа міститься відносно велика кількість ПДК та МДК. При цьому рівень ПДК занижений в асимптоматичних пацієнтів із хронічним алергічним ринітом та підвищений під час інфекційного запалення. Ці результати вказують на важливість ПДК у боротьбі із вірусами через наявність великої кількості ПДК у здоровій слизовій оболонці носа. Це також пояснює, чому пацієнти із алергією більш схильні до більш тяжкого перебігу вірусної інфекції.(183)
ПДК також можуть розпізнавати мотиви CpG у межах ДНК мікробів, що призводить до активації ТПР-9 та вироблення великої кількості альфа- та гамма-інтерферону. Таким чином стимулюючи реакцію Th1 та протидіючи реакції Th2.(183) Gabr та ін. підтвердили роль макрофагів у презентації антигенів та в процесінгу, розпізнаванні та презентації чужорідних антигенів іншим імунним клітинам, зокрема І-хелперам. (181)
Набута імунна система створює відповідну імунну реакцію на специфічний подразник (антигенпредставляючі клітини, Т-лімфоцити, В-лімфоцити та клітини плазми).
3.2.3.2.5.3. Специфічний імунітет - Т-лімфоцити та В-лімфоцити
Набутий імунітет реагує на презентацію антигену через формування імунних продуктів (ефекторні Т-лімфоцити та антитіла), що можуть створювати специфічну взаємодію із подразником.
Інтерферон є білком, який продукується та вивільняється інфікованими клітинами. В носовому секреті та лаважних рідинах при гострих вірусних захворювань верхніх дихальних шляхів міститься як альфа-інтерферон, так і гама-інтерферон.(185"188) Інтерферону І типу, альфа-інтерферон, викликає антивірусний стан в оточуючих клітинах та модулює активність інших імунних клітин, таких як Т-клітини, КК-клітини та мієлоїдні дендритні клітини.(183)
У той самий час гамма-інтерферон, пов'язаний із ТИ1 (інтерферон ІІ типу), стимулює накопичення та активацію макрофагів, продукцію цитокінів, КК-клітини та проліферацію антиген-специфічних В-клітин (189). Негайна антивірусна реакція епітеліальних клітини господаря викликає залучення цитотоксичних Т-лімфоцитів, який вважається переважно реакцією, зумовленою ТИ1 (190). Ці ЦТЛ лімфоцити можуть розпізнавати та вбивати інфіковані клітини за допомогою експресії білків на поверхню їх клітин. Далі, смерть клітини також може бути викликана природними клітинами-кілерами (КК) - іншим типом цитотоксичних лімфоцитів.(118)
У процесах захисту від бактеріальної інфекції головну роль відіграють також Т- лімфоцити (особливо ТИ 1-клітини) та антитіла. Т-лімфоцити, що розпізнають бактерії, можуть вивільняти цитокіни, що збільшують вбивчі властивості фагоцитів. Вони також здатні активувати специфічний імунітет, таким чином стимулюючи В-лімфоцити для продукції специфічних антитіл.
Вважається, що епітеліальні клітини взаємодіють безпосередньо із Т-клітинами та регулюють їх функцію. Окрім прямого фізичного контакту між Т-клітинами та епітеліальними клітинами, на епітеліальних клітинах дихальних шляхів експресується кілька молекул лігандів/рецепторів, що можуть з'єднуватись із відповідними комплементами рецепторів/лігандів на Т-клітинах.(190) Механізми, що лежать в основі здатності епітеліальних клітини презентувати антигени Т-клітинам та стимулювати їх, є неясними. Епітеліальні клітини дихальних шляхів експресують гомологи ко-стимулюючих лігандів В7.(191, 192)
Неіпеске та ін. продемонстрували, що прозапальні цитокіни ТОТ-альфа та гамма-інтерферон або лише гамма-інтерферон селективно збільшували В7-Н1 та В7-БС, але не В7- Н2 та В7-Н3. Інгібірування В7-Н1 та В7-ВС призвело до підвищення експресії гамма-інтерферону з Т-клітин. Таким чином, функцією В7-Н1 та В7-ОС на епітеліальних клітинах на дихальних шляхах було регулювання активації Т-клітин інгібіруванням продукції гамма-інтерферону з Т-клітин.(190)
VanRossum та ін. довели, що у мишей з дефіцитом ТИ-клітин не знищується колонізація пневмококів впродовж тривалого періоду спостереження(156) Можливо, через відсутність індукції реакції ТИ1, яка, як було доведено раніше, відіграє захисну роль у реакції господаря на пневмококову хворобу.(193) Також було доведено, що набута імунна реакція, зумовлена ТИ-клітинами, є незалежною від присутності антитіл. Це вказує на те, що роль антитіл є обмеженою у знищенні колонізації пневмококів.(194, 195)
Антитіла виробляються у відповідь на білки та полісахариди клітинної мембрани та її можливих подовжень, таких як фімбрії та джутики. Разом із фактором комплементу С3 антитіла сприяють опсонізації та викликають внутрішньоклітинне руйнування бактерій. Господар також може виробляти антитіла до білків стінки клітин або білків, що інгібують фагоцитоз бактерій. Нарешті, також можуть формуватися антитіла проти токсинів, що виробляються бактеріями.(119)
Багато медіаторів та цитокінів координують міграцію та активацію імунних ефекторних клітин у відповідь на інфекцію. Ці білки регулюють хемотаксис, клітинну диференціацію та активацію, викликаючи експресію молекул адгезії та вивільняючи цитокіни (180)
Наряду із альфа-інтерфероном та гамма-інтерфероном у носовому секреті та носових лаважних рідинах під час гострих респіраторних захворювань верхніх дихальних шляхів, викликаних РСВ, вірусом парагрипу, риновірусом, вірусом грипу та інфекціями невизначеної етіології, спостерігають високі рівні прозапальних та протизапальних цитокінів, у тому числі ІЛ-1бета, ІЛ-6, ІЛ-8, ІЛ-10 та TNF-альфа(185-188, 198-199)
ІЛ-1бета має подвійний ефект. Він збільшує поширення риновірусу через підвищення кількості ICAM-1 та активує реакцію господаря на інфекцію, посилюючи залучення імунних ефекторних клітин до ділянки запалення. Він також викликає вивільнення прозапальних цитокінів, таких як фактор активацій тромбоцитів та ІЛ-8.(179, 200-202)
ІЛ-6 є прозапальним цитокіном, що має активуючий та проліферуючий вплив на лімфоцити. ІЛ-8, з іншого боку, є сильним хемоатрактантом для нейтрофілів.(124, 180)
ІЛ-10 є регулятивним цитокіном із протизапальними та Th2-стимулюючими властивостями. Він може регулювати імунні реакції перешкоджаючи запальній реакції, або обмежуючи надмірну запальну реакцію через інгібірування вироблення широкого діапазону інших цитокінів. Наприклад, TM-пов'язаних цитокінів (TNF-альфа, гамма-інтерферон, ІЛ-2 та ІЛ-12), прозапального цитокіну ІЛ-18 та Th2-повязаного цитокіну ІЛ-5.(203)
TNF-альфа є також Th1-пов'язаними цитокінами. Він викликає активацію антивірусної імунної реакції господаря через стимулювання функціональних властивостей цитотоксичних Т-лімфоцитів, NK та макрофагів та через залучення запальних клітин до ділянки інфекції. Окрім того, разом із ІЛ-12 він може сприяти розвитку Th1-лімфоцитів (203).
В осіб, схильних до алергії, експериментальна інфекція риновірусу також викликає збільшення фактору, що стимулює колонії гранулоцитів (G-CSF) у назальних секреціях та сироватці. G-CSF та ІЛ-8 швидко індукуються у носі після посіву вірусу та, вірогідно, були більш пов'язані із перенесенням нейтрофілів у дихальних шляхах. Стосовно G-CSF було запропоновано, що або G-CSF сприяє залученню нейтрофілів до дихальних шляхів, або що нейтрофіли дихальних шляхів є джерелом G-CSF під час вірусної інфекції. Збільшення рівня G-CSF у носі також пов'язане із збільшенням рівня нейтрофілів у крові, це вказує на те, що G-CSF, який виробляється у носі, потрапляє до великого кола кровообігу та впливає на кістковий мозок, який збільшує нейтрофілію.(204, 205) Проте, Linden та ін. підтвердили, що G- CSF підвищується лише у інфікованих вірусом пацієнтів із супутнім алергічним ринітом, але не у осіб, які не мають алергії.(206)
Riechelmann та ін. оцінили профіль назальних біомаркерів при гострому та хронічному риносинуситі. Вони визначили продукти секреції клітин (білки, що походять від гранул клітин запалення), IgE та цитокіни у секреції носа. Вони знайшли високі концентрації ІЛ-2, ІЛ-4, ІЛ-10, ІЛ-12, ІЛ-13, TNFa та TNFy у пацієнтів із ГРС порівняно із суб'єктами із ХРСзНП та ХРСбезНП.(207)
VanRossum та ін. вивчили роль цитокінів у кліренсі назальної пневмококової колонізації. Перш за все, вони вивчили роль ІЛ-12 - індуктор білку реакції типу Th1. Проте, у цьому дослідженні не було визначено, що ІЛ-12 сприяє кліренсу пневмококової колонізації. Також не було виявлено, що ІЛ-4, цитокін, важливий у стимулюванні реакції типу Th2, відіграє роль у кліренсі колонізації. Проте, ці результати не виключають, що кліренс колонізації залежить від Th1, оскільки ІЛ-12 є не єдиним індуктором реакції Th1 (156, 208, 209)
Гамма-інтерферон також здатен направляти Th-клітини до реакції Th та раніше довів, що він відіграє важливу роль у захисті господаря від легеневої інфекції, викликаної S. pneumoniae (156, 208, 209).
Разом із гамма-інтерфероном, у кліренсі колонізації бере участь також й ІЛ-17А. ІЛ- 17А вивільнюється Th17-клітинами та викликає мобілізацію нейтрофілів через індукцію гранулопоезу та хемокінів. У цьому шляху також бере участь ІЛ-23, що виробляється дендритними клітинами (194, 210)
Як вже зазначалось вище, між АР та риносинсутом існує патофізіологічний зв'язок.(130)
Avila та ін. вивчили вплив алергічного запалення слизової оболонки носа на ступінь тяжкості застуд, викликаних риновірусом. Вони винайшли, що тяжкість симптомів застуди була у значному ступені аналогічною. Проте, поява симптомів застуди була суттєво відстроченою, а тривалість симптомів застуди була значно коротшою у групі із алергенами. Між двома групами не було суттєвої різниці стосовно збільшення загальної кількості та відсоткової долі нейтрофілів у лаважній рідині носа. Проте, ці зміни паралельно призводили до змін симптомів, тобто, вони були відстроченими у групі з алергенами, але мали аналогічний ступінь в обох групах. Також відсоткова доля еозинофілів не підвищувалась ні в одній з груп під час застуди. Показники цитокінів у рідині назального лаважу вказували на підвищення концентрацій ІЛ-8 та ІЛ-6 під час звичайної застуди в обох групах. І знову ж, ці зміни були відстроченими у групі із алергенами, але мали аналогічний ступінь порівняно до групи, що приймала плацебо.(211)
Skoner та ін. порівняли систематичні клітинні імунні реакції до провокації експериментальним риновірусом у суб'єктів із та без АР.(212) Вони виявили, що інфекція риновірусу викликала значні гострі збільшення сироваткового IgE, вивільнення гістаміну лейкоцитами та агрегацію тромбоцитів, але не призводили до змін у сироватковому IgE, сироватковому IgА, сироватковому IgM та гістаміну плазми. Цю зміну виявили лише у суб'єктів із АР, але доказів, що гостре підвищення сироваткового IgE було результатом збільшення рівня пред-існуючих антитіл сироваткового IgE до пилку, не було.(213)
Alho та ін. вивчали клітинні та структурні зміни у слизовій оболонці носа під час природних застуд у суб'єктів із АР та схильністю до РГРС, порівняно із здоровою контрольною групою. Вони продемонстрували, що суб'єкти із алергіями мали підвищені рівні еозинофілів під час гострої фази у порівнянні до контрольної групи. У суб'єктів із алергіями та схильністю до синуситу також був підвищений рівень епітеліальних Т-клітин та низький рівень мастоцитів під час одужання порівняно до контрольної групи. У період одужання у суб'єктів із алергіями також були найвищі показники інтраепітеліальних цитотоксичних лімфоцитів, у той самий час у суб'єктів, схильних до синуситу, такі клітини були відсутніми. Відстрочене накопичення інтраепітеліальних Т-клітин могло вказувати на тривалу запальну реакцію у суб'єктів із алергією та схильністю до синуситу, порівняно із контрольною групою. Вони припустили, що ця пізня реакція Т-клітин складається з вірус- специфічних Т-клітин. Підвищений рівень цитотоксичних лімфоцитів у суб'єктів із алергією під час одужання може бути пов'язаний із більш серйозними змінами у слизовій оболонці навколоносових пазух, що до того спостерігали у суб'єктів із АР під час застуди.(214)
Alho та ін. довели, що пацієнти із АР, зумовленим IgE, мали більш серйозні зміни у навколоносових пазухах на КТ під час застуд, ніж суб'єкти без алергії.(215) Ці ж дослідники також виявили більший ступінь порушення носового дихання та вищі показники мукоциліарного кліренсу в алергіків під час вірусних застуд, порівняно контрольною групою.(216) Останнє явище, що веде до порушення функцій пазух, може пояснювати, як алергія підвищує ризик ГБРС.
|
Автор, рік, посилання |
Тканина/пацієнти |
Клітини |
Медіатори |
Методика |
Висновок |
|
Melvin 2010 (67) |
Назальний епітелій у пацієнтів з алергією та ГРС |
Епітеліальні |
TLR-9 |
Проточна цитометрія |
Рівень TLR-9 був підвищений у пацієнтів з алергією та ГРС порівняно з пацієнтами з алергією без ГРС |
|
Wang |
Назальний епітелій, |
Епітеліальні |
Молекули адгезії |
qPCR, конфокальна мікроскопія |
Адгезивність молекул була підвищена після риновірусної інфекції, що полегшує розвиток бактеріальної інфекції |
|
Heinecke 2008(190) |
Назальний епітелій, риновірусна інфекція |
Епітеліальні |
B7-H1 та B7-DC |
qPCR, проточна цитометрія |
Індукування В7-Н1 та експресія В7- БС в епітелії після риновірусної інфекції |
|
Carraro 2007 (176) |
Діти з ГРС та ХРС |
NO |
Видихнутий та ендоназальни й NO |
Рівень N0 однаковий при ГРС та ХРС та підвищується після антибіотикотерапії |
|
|
Klemens 2007 (217) |
Назальний секрет при алергічному та вірусному ринітах |
ІЛ-1 ß, ІЛ- 4, ІЛ-5, ІЛ-6, |
ELISA |
Підвищення ІЛ- 1Р, ІЛ-6, ІЛ-7, ІЛ- |
|
|
Khoury 2006 (218) |
Слизова оболонка носа та пазух, S. pneumoniae |
Т-клітини, еозинофіли |
Підрахунок бактеріальних клітин при промиванні носової порожнини |
Кількість бактеріальних клітин підвищена при супутній сенсибілізації |
|
|
Hartmann 2006 (183) |
Слизова оболонка носової |
mDC та pDC |
CD1a, |
qPCR,проточна цитометрія |
Рівень рБС вищий при інфекціях верхніх дихальних шляхів і майже відсутній після лікування ГКС |
|
Passariello 2006 (133) |
Культура епітеліальних клітин |
ІЛ-6, ІЛ-8, ICAM-1 |
ELISA |
HRV сприяє розвитку S. aureus через дію цитокінів і ICAM-1 |
|
|
Riechelman 2005 (207) |
Назальний секрет/ люди з ГРС |
ІЛ-12, ІЛ- 4, ІЛ-10, ІЛ-13 |
ІГХ |
Різниця при ГРС та ХРС |
|
|
Perloff 2005 (219) |
Слизова оболонка щелепної пазухи кролів |
Збудник |
Немає |
Електронна мікроскопія |
Присутність біоплівки на слизовій оболонці щелепної пазухи |
|
Van Benten 2005 (203) |
Респіраторний синцитіальний вірус у дітей з атопією порівняно з дітьми без атопії |
ІЛ-2, ІЛ-4, ІЛ-5, ІЛ-8, ІЛ-10, ІЛ- 12, ІЛ-18, IFN-y TNF-a |
СВА-аналіз |
Зниження рівня носового ІЛ-10 та підвищення TNF-a після перенесеної риновірусної та респіраторно синцитіальної інфекції |
|
|
Yu 2004 (220) |
У мишей S. pneumonia, асоційована з ГРС та алергічною сенсибілізацією |
Еозинофіли, поліморфно-ядерні клітини |
Гістологічне дослідження |
Наявність TH2-клітин з імунною відповіддю в експериментальному ГРС |
|
|
Ramadan 2002 (221) |
Вірус-індукований ГРС (реовірус) |
Т-клітини, В-клітини |
Немає |
Гістологічне дослідження |
Взаємодія між Т- та В- клітинами, що зберігається після 14-го та 21-го дня, підтверджує відкладену імунну відповідь |
|
Rudack 1998 (222) |
Слизова оболонка пазух у випадках лікування ГРС хірургічним шляхом |
Немає |
ІЛ-8, ІЛ-1Р, ІЛ-6, |
ELISA |
Зростання рівнів ІЛ-8, ІЛ- 1 в, ІЛ-6 при ГРС |
ГРС є поширеним станом, який пацієнти часто контролюють самостійно, не звертаючись до медичної допомоги, та зазвичай видужують самостійно або за допомогою лікування. Якщо пацієнти все ж звертаються до лікаря, зазвичай таким лікарем є спеціаліст первинної медичної допомоги широкого профілю. Діагноз є клінічним та спирається на наявність та тривалість типових симптомів, зокрема закупорення носа, виділення з носа, біль або тиск в ділянці лиця та погіршення нюху. ГРС зазвичай виникає як ускладнення гострої респіраторної вірусної інфекції, при якому симптоми тривають понад 10 днів або погіршуються через 5 днів. Стійкість симптомів більше ніж через 12 тижнів вказує на хронічний, а не гострий риносинусит. На підставі клінічного обґрунтування у більшості випадків його можливо відрізнити від таких інших станів як вірусна респіраторна інфекція верхніх дихальних шляхів, алергічний риніт, ородонтальні хвороби та синдроми болю в ділянці обличчя, хоча при наявності сумнівів стосовно діагнозу можуть знадобитись обстеження. Септичні ускладнення рідкі, але серйозні, тому всі спеціалісти, які надають первинну медичну допомогу, повинні знати тривожні симптоми, такі як періорбітальний набряк та візуальні симптоми, що вимагають негайної експертної оцінки. Хоча у загальноприйнятій практиці часто призначають антибіотик, симптоми ГРС часто більш стосуються запалення та порушення механізмів відтоку з пазух, тому у багатьох випадках в призначенні антибіотика немає потреби. Для діагностування ГРС зазвичай не потребується візуалізація, гематологічні та мікробіологічні аналізи, але вони можуть знадобитись у конкретних обставинах, як, наприклад, наукових дослідженнях або у пацієнтів з групою високого ризику.
Поствірусний ГРС є поширеним у суспільстві, зазвичай після вірусної респіраторної інфекції верхніх дихальних шляхів.
ГРС є поширеною хворобою та зазвичай носить самообмежуючий характер. Багато пацієнтів самостійно лікуються або використовують ліки, що продаються без рецепту, тому не звертаються за медичною допомогою або за офіційним діагнозом. Якщо пацієнт все ж звертається до лікаря, то більшість з них звертаються до терапевта загальної практики, хоча у деяких системах охорони здоров'я вони можуть звертатися відразу до спеціалізованих відділень. Хоча приймались заходи для навчання лікарів загальної практики (ЛЗП) концепції риносинуситу та критеріям діагностування ГРС,(223) у якості діагностичного позначення зазвичай використовують «синусит», а ЛЗП часто вважають його гострим бактеріальним, а не запальним станом,(224) широко призначаються антибіотики.(225, 226) Розповсюдження БР308 (8) та інших нових рекомендацій, (2, 227) які підкреслюють запальний характер ГРС та пропонують стандартизацію діагностичних критеріїв, а також застосування досліджень призвели до більш раціональної діагностики та лікування у деяких,(226, 228) але не у всіх(229, 230) оточеннях. Фактором сучасного широкого використання антибіотиків при ГРС може бути не тільки нерозуміння запального характеру ГРС, (229) але й занепокоєність стосовно ризику ускладнень у вигляді інфікування через бактеріальну хворобу, що не лікувалась. Проте, дані спостережень вказують на те, що ускладнення є рідкісними, (231, 232) зазвичай проявляються рано під час перебігу хвороби у вигляді тяжких симптомів, (233, 234) але лікування ГРС антибіотиками у загальній практиці не запобігає виникненню ускладнень(53, 232) Медичні протоколи погоджуються, що при випадках без ускладнень ГРС діагностують за клінічними критеріями, та в додаткових дослідженнях немає потреби.(2) У конкретних групах пацієнтів та у пацієнтів із тяжкими або нетиповими симптомами можуть знадобитись додаткові діагностичні процедури, як описано нижче. ГРС часто є ізольованим клінічним явищем та станом, що купірується самостійно, хоча у деяких випадках може бути рецидивуючим. У деяких випадках це може бути пов'язано із хворобами зубів.(61)
ГРС діагностують за гострим проявом типових симптомів, до яких входять закладеність носа, виділення з носа, біль або тиск в ділянці обличчя та послаблення нюху.
В умовах загальної практики (та в цілях епідеміологічного дослідження) ГРС визначається на підставі симптомів без детального обстеження вуха, горла та носа або візуалізації. ГРС визначається у розділі 2 цієї роботи за наявністю великих та малих симптомів впродовж 12 тижнів. ГРС додатково поділяють на «гострий вірусний риносиносит» (синонім «звичайної застуди»), при якому симптоми тривають менш 10 днів, зазвичай є станом, що завершується самостійно, з яким часто не звертаються до лікарів, та «гострий поствірусний риносинусит», що визначається погіршенням симптомів через 5 днів або їх тривалістю понад 10 днів.(8)
Більшість гострих вірусних респіраторних інфекцій верхніх дихальних шляхів виліковується самостійно, а поствірусний ГРС не слід діагностувати, доки тривалість симптомів не буде складати більше 10 днів, якщо через 5 днів симптоми не погіршуються.
Суб'єктивна оцінка ГРС базується на наявності та ступені тяжкості симптомів.
Окрім цих локальних симптомів можуть виникати віддалені та загальні симптоми.
До віддалених симптомів відноситься подразнення глотки, гортані та трахеї, що призводить до болю у горлі, дисфонії та кашлю, до загальних симптомів відносяться сонливість, недуг та гарячка. У загальній практиці представлено небагато надійних доказів відносної частоти різноманітних симптомів ГРС. Існує багато окремих варіантів цих загальних симптомів.(235-239) Лише невелика частина пацієнтів із гнійним риносинуситом без супутньої легеневої хвороби скаржаться на кашель.(236) У пацієнтів із підозрою на інфекцію, біль в ділянці обличчя або зубний біль (особливо якщо односторонній) вважається передвісником гострого гаймориту при оцінці за аспірацією з гайморових пазух (236) або за рентгенограмою навколоносових пазух.(237) Симптоми ГРС виникають несподівано без попередніх нещодавніх симптомів у носі та пазухах. Історія різкого погіршення існуючих симптомів вказує на гострий прояв хронічного риносинуситу, що потрібно діагностувати за тими ж самими критеріями та лікувати таким саме чином, що і ГРС.
При суб'єктивній оцінці слід звертати увагу на ступінь тяжкості та тривалість симптомів. Рекомендований метод оцінки тяжкості симптомів - використання візуальної аналогової шкали (ВАШ); пацієнт вказує ступінь тяжкості на 10см лінії, на цьому вимірюваному відрізку визначають бал від 1 до 10 (див. главу 2.2.3.). Існують анкети оцінки хвороби, за якими оцінюється погіршення якості життя/240, 241) але не часто застосовуються у клінічній практиці; проте, професійний лікар неформально повинен оцінити вплив ГРС на свого пацієнта у межах повної клінічної оцінки. Для визначення тяжкості загальних симптомів та тяжкості окремих симптомів (див. нижче), можна використовувати ВАШ. Оцінити тяжкість симптомів також можна, якщо попросити пацієнтів оцінити свої симптоми як відсутні, легкі, помірні або тяжкі.
Різка поява симптомів закупорки, обструкції, набряку носа та виділення з нього зазвичай є результатом вірусної інфекції, що виліковується самостійно (без медичного втручання), та не слід розглядати ГРС у пацієнтів, якщо їх симптоми тривають менш ніж 5 днів, якщо вони не є надзвичайно тяжкими. Поствірусний ГРС не слід діагностувати у пацієнтів із симптомами, які тривають менше 10 днів, або якщо через 5 днів не трапляється помітне їх погіршення або при наявності сильного болю та гарячки >38°С. Симптоми, що тривають більше 12 тижнів, вказують на наявність хронічного риносинуситу.
Назальна обструкція. Хоча назальну обструкцію можна оцінювати об'єктивно за допомогою таких технологій, як риноманометрія, максимальна швидкість вдиху носом та акустична ринометрія, вони рідко застосовуються при діагностиці та оцінці ГРС, що базується на скаргах пацієнта на обструкцію та суб'єктивній оцінці тяжкості: або за допомогою ВАШ, або за допомогою оцінки обструкції як відсутньої, легкої, помірної або тяжкої.
Наявність та ступінь виділень з носа (переднє та заднє назальне затікання) оцінюють за суб'єктивними скаргами та за допомогою ВАШ або суб'єктивної оцінки пацієнта за критеріями «відсутній», «легкий», «помірний» або «тяжкий». У якості діагностичного критерію ГБРС (227) рекомендовано спиратися на скарги пацієнта щодо гнійних виділень із носа, що ЛЗП вважають ознакою, яка вказує на необхідність антибіотикотерапії;(226) обґрунтувань у підтримку цього твердження існує небагато. Було зазначено, що гнійні виділення з носа підвищують коефіцієнт вірогідності затемнення пазухи на рентгенограмі (237) та отримання позитивних результатів на бактеріальну культуру,(242) хоча одностороння гнійна ринорея має прогностичність позитивного результату (ППР) лише 50%, а гній у носовій порожнині - ППР лише 17%, що прогнозує позитивний результат на бактеріальну культуру в аспіраті гайморової пазухи,(236) таким чином, не можна на це спиратись при точному виявленні бактеріальної інфекції.
Послаблення нюху можна оцінювати за суб'єктивною інформацією пацієнта за допомогою ВАШ або за критеріями «відсутній», «легкий», «помірний» або «тяжкий». Суб'єктивні дані про нюх відповідають об'єктивним аналізам,(243-245) а втрата нюху зазвичай пов'язана із ГРС.
Біль та тиск в ділянці обличчя зазвичай виникають при ГРС, хоча також виникають тимчасово при вірусній інфекції верхніх дихальних шляхів (ТВДТТТ), що виліковується самостійно. Було виявлено, що біль в ділянці обличчя або зубний біль, особливо односторонній, є передвісниками гострого гаймориту із затриманням рідини у пацієнтів із підозрою на бактеріальну інфекцію, що підтверджується аспірацією з гайморових пазух (236) або рентгенограмою навколоносових пазух.(237) Біль при нахилі уперед та біль у верхніх зубах, особливо якщо односторонній, часто тлумачаться ЛЗП як ознака більш серйозних хвороб, що потребують призначення антибіотиків,(226) проте, у підтримку цього існує мало доказів. Стверджується, що біль верхніх зубів збільшує коефіцієнт вірогідності затемнення пазухи на рентгенограмі до 2.5,(237) хоча ППР локального одностороннього болю при бактеріальній інфекції складав лише 41% в іншому дослідженні.(236-* Подальші вивчення показали, що біль верхніх зубів достовірно був пов'язаний із наявністю позитивного результату бактеріологічного посіву, переважно S. pneumoniae або H. influenzae, що підтверджувалось за допомогою аспірації з пазух або лаважу.(246) Ступінь тяжкості болю може визначатись пацієнтами (суб'єктивно) за допомогою ВАШ або за критеріями: «відсутній», «легкий», «помірний» або «тяжкий».
Бактеріальна інфекція може виникати при ГРС, але у більшості випадків антибіотики мали невеликий вплив на перебіг хвороби.
Ряд досліджень намагались скласти для лікарів комбінацію симптомів та ознак, що прогнозують більш серйозні хвороби, зокрема, прогнозування бактеріальної інфекції та вірогідності реакції на антибіотики. У дослідженнях за участю пацієнтів лікарів загальної практики віком 15 років або старше із клінічним діагнозом ГРС, в яких визначалась вірогідність специфічних симптомів та аналізи, що прогнозують рівень рідини або загального затемнення будь-якої пазухи на КТ (як золотий стандарт синуситу), Lindbaek (247) визначив чотири фактори, що мають високий коефіцієнт вірогідності та незалежно пов'язані із ГРС. До них відносяться гнійна ринорея, гнійні виділення у носовій порожнині, підвищена ШОЕ (>10) та «друга хвиля» (тобто погіршення після первинної більш легкої фази захворювання). Комбінація принаймні трьох з цих чотирьох симптомів та ознак давала специфічність 0.81 та чутливість 0.66 для ГРС.
Berg(236) заявив, що 2 з трьох позитивних результатів (з гнійної ринореї із одностороннім поширенням, локальний біль із одностороннім поширенням, гній у носовій порожнині та двостороння гнійна ринорея) дають 95% чутливості та 77% специфічності щодо ГБРС. Williams(237) заявив, що наявність менше 2-х симптомів (з болю верхніх зубів, поганої реакції на антигістаміни або декогестанти, гнійних назальних секрецій, відхилень при трансілюмінації та забарвлених виділень з носа) виключають ГБРС із прогностичністю позитивного результату (ППР) менше 40%, а 4 або більше симптомів включають ГБРС (ППР, 81%).
Хоча лише сама передня риноскопія є дуже обмеженим обстеженням, вона повинна виконуватись у закладах загального профілю у межах клінічної оцінки підозри на ГРС. Вона може дати підтверджуючі результати, такі як запалення носа, набряк слизової оболонки та гнійні виділення з носа, а іноді дати раніше невиявлені результати, такі як НП або анатомічні аномалії.
Гарячка >38°С вказує на більш тяжку хвороби та можливу необхідність у більш активному лікуванні, особливо при поєднанні із більш тяжкими симптомами. Гарячку >38°С достовірно пов'язують із наявністю грампозитивної бактеріологічної культури (переважно S. pneumoniae) та H. influenzae, яку підтверджують за допомогою аспірації з пазухи або лаважу(246)
Обстеження та пальпація щелепно-лицьової зони може виявити набряк та чутливість, що зазвичай тлумачаться як ознаки більш тяжкої хвороби (226) та необхідність призначення антибіотиків, хоча чутливість та специфічність цих симптомів при визначенні ГБРС не встановлено.
Ендоскопія носа нечасто є доступною у звичайних закладах загального профілю та не є необхідною при встановленні клінічного діагнозу ГРС, хоча може знадобитись в умовах досліджень та описана нижче.
Мікробіологічні дослідження не потрібно використовувати для діагностики ГРС у звичайній практиці, хоча вони можуть знадобитись в умовах досліджень або при нетипових або рецидивуючих хворобах. Існує обґрунтований зв'язок між зразками, взятими з середнього ходу при ендоскопічному контролі та пункцій з пазух,(248) мікробіологічні проби можуть бути призначені при більш серйозних, рецидивуючих або ускладнених проявах.
Дослідження з візуалізацією не є необхідними для діагностування ГРС у звичайній практиці, хоча можуть знадобитися для підтвердження діагнозу в умовах дослідження, та описані нижче.
СРБ є гематологічним біомаркером (доступний у вигляді наборів для експрес-аналізів за місцем лікування) що підвищується при бактеріальній інфекції. Його вимірювання рекомендують при інфекції респіраторного тракту (247) у якості засобу виявлення бактеріальної інфекції та, таким чином, для обмеження необов'язкового використання антибіотиків. Нещодавні дослідження (249, 250) пропонують, що при ГРС низький або нормальний СРБ може вказувати на те, що у пацієнта низька вірогідність грампозитивної бактеріальної інфекції, що він навряд чи потребує антибіотиків, або що антибіотики скоріше за все не будуть мати для нього позитивного ефекту, а лікування на підставі показників СРБ було пов'язане із зменшенням вживання антибіотиків без погіршення результатів. Це можна вважати цікавим, але попереднім спостереженням. До того, як цей аналіз можна буде рекомендувати у якості стандарту для діагностики ГРС та вибору терапії, потрібно провести додаткові дослідження. Проте, рівень СРБ достовірно пов'язаний із змінами на КТ- знімках,(251) а підвищений рівень СРБ вказує на грампозитивну бактеріальну культуру при пункції з пазух або лаважі.(246, 252)
Прокальцитонін також рекомендують у якості потенційного гематологічного біомаркера, що вказує на більш серйозну бактеріальну інфекцію, та досліджується як засіб для призначення антибіотика, що призначається при інфекціях респіраторних шляхів у суспільстві.(253) Він доступний у вигляді ручного аналізу за місцем лікування, що може дати результати за 30 хвилин, але дає обмежені робочі результати,(254) або у якості лабораторного аналізу. Однак в даний час, доказів його ефективності як біомаркеру при ГРС немає.
Маркери запалення, такі як ШОЕ та в'язкість плазми, підвищуються при ГРС; можуть вказувати на ступінь тяжкості хвороби та на потребу у більш агресивному лікуванні, за аналогією до СРБ. Рівень ШОЕ пов'язаний із змінами на КТ при ГРС,(251) ШОЕ >10 є передвісником виявлення рівня рідини або затемнення пазух на КТ-знімках.(252) Підвищена ШОЕ прогнозує позитивну бактеріальну культуру при пункції з пазух або лаважу.(246, 252)
Цей метаболіт присутній у верхніх та нижніх дихальних шляхах та є чутливим індикатором запалення та циліарної дисфункції. Вимірювання N0 у носі відносно легке, потребує простого контакту із хворим (видихання до аналізатора), виконується швидко та легко за допомогою обладнання для хемілюмінесцентного аналізу. Цей аналіз є доцільним у звичайних клінічних умовах; із розвитком технологій та зниженням витрат на вимірювальне обладнання може бути практичним у якості клінічного засобу. Існують попередні докази доцільності використання вимірювання N0 у видихуваному повітрі у загальній практиці при діагностиці та моніторингу астми,(225) але доцільність використання N0 з носа при регулярному догляді не проходила оцінки. Дуже низький рівень N0 з носа може вказувати на первинну циліарну дискінезію, але також може бути при незначних обструкціях пазух.(256) Підвищений рівень може вказувати на наявність запалення за умови збереження остіомеатальної прохідності. Нещодавнє пілотне дослідження (257) показало, що моніторинг рівня N0 з носа може бути корисним для діагностики та лікування ГРС, але потрібно проводити додаткові дослідження.
При діагностуванні ГРС рідко виконуються такі детальні аналізи функції дихальних шляхів носа як, наприклад, аналізи мукоциліарної функції, прохідності носа та нюху, за виключенням специфічних досліджень.
Симптоми ГРС є неспецифічними та можуть перемежовуватись із рядом інших станів, що потрібно диференціювати.
Симптоми звичайної застуди та вірусних ІВДШ, що купіруються самостійно, співпадають із симптомами поствірусного ГРС. Насправді, більшість епізодів ГРС починається як вірусна ІВДШ, але захворювання триває понад 10 днів, або симптоми погіршуються через 5 днів. Більшість звичайних застуд пов'язано із інфекцією риновіруса, при якій симптоми досягають свого піку до 3 дня,(258) та більшість пацієнтів не звертаються за медичною допомогою. Діагноз є клінічним, а єдиними втручаннями є консультація, симптоматичне лікування та заспокоєння пацієнта.
Алергічний риніт (АР) є поширеною хворобою; в світі від нього страждає 10-20% дорослого населення.(259) Алергічний риніт - найбільш поширена форма неінфекційного риніту, пов'язаний із імунною реакцією, зумовленою IgE, проти алергенів та часто пов'язаний із очними симптомами. Оскільки слизова оболонка продовжується у навколоносових пазухах, застій в отворах може призвести до синуситу, який не існує без риніту. Тобто АР може бути частиною алергічного риносинуситу із симптомами, аналогічними до симптомів ГРС (та ХРС). До симптомів АР входять: ринорея (негнійна), назальна обструкція, свербіж у носі та чихання, що регресують спонтанно або із лікуванням. АР додатково поділяється на «інтерметуючий» або «персистуючий». Інтерметуючий риніт може виникати несподівано як реакція на дію конкретного алергену і, таким чином, викликає діагностичну плутанину між АР та ГРС. Сезонний АР пов'язаний із широким різноманіттям зовнішніх алергенів, таких як пилок або пліснява, несподіваний контакт із такими аероалергенами або іншими (наприклад, із подразниками у вигляді лупи кішок та собак у чутливих індивідуумів) може викликати гострий прояв симптомів. При АР, зазвичай, проявляються аналогічні симптоми у відповідь на аналогічні контакти, часто із сезонним характером. Неспецифічні подразники, такі як забруднення повітря та вірусна інфекція, можуть погіршувати симптоми в симптоматичних пацієнтів із АР та викликати симптоми в асимптоматичних пацієнтів із субклінічним запаленням носа.
Діагностика АР та диференціація із ГРС здійснюються головним чином на підставі попереднього анамнезу алергії та атопії та впливу алергену (зазвичай аероалергену), до якого пацієнт має чутливість. У конкретних пацієнтів, чутливих до зовнішніх алергенів, очні симптоми часто виникають при АР, але не при ГРС. Слизисто-гнійна ринорея, біль, назальна обструкція без інших симптомів та втрата нюху рідко виникають при АР. Діагностичні аналізи на АР базуються на появі алерген-специфічного IgE у шкірі (шкірних пробах) або крові (специфічний І^Е) та можуть братися до уваги для прояснення діагнозу, зокрема у пацієнтів із тяжкими або стійкими симптомами.
Пацієнти із ородонтальними хворобами можуть звернутися до лікарів загальної практики стосовно слабковираженого болю в ділянці обличчя із гарячкою (або без неї) та зубним болем. Відсутність інших симптомів, пов'язаних із ГРС, таких як ринорея, виділення з носа та порушення нюху, імовірніше виключать діагноз ГРС, хоча у деяких випадках можуть залишатися сумніви. Оцінка стану зубів та рентгенограма зубів можуть знадобитись для уточнення діагнозу. ГРС може зустрічатися частіше та мати паралельні симптоми у пацієнтів із ородентальною хворобою.(61)
Існує ряд не дуже поширених станів, що можуть іноді проявлятися симптомами, аналогічними ГРС, у гострій фазі.
Внутрішньочерепний сепсис зустрічається рідко, але дуже важливо, щоб лікарі загальної практики знали тривожні ознаки цієї складної та тяжкої хвороби та негайно направляли пацієнтів до вузьких спеціалістів, якщо такий діагноз можливий. Такі симптоми, як периорбітальний набряк, зміщення очного яблука, двоїння в очах, офтальмоплегія, зниження гостроти зору, сильний односторонній або двосторонній фронтальний головний біль, осередкові офтальмологічні ознаки або менінгізм вказують на такі ускладнення як внутрішньочерепний сепсис або інший діагноз та потребують негайної діагностики та належного лікування (Див. Таблицю 3.1.1).
Кілька станів у гострій фазі проявляються болем в ділянці обличчя та назальними симптоми, у тому числі мігрень та кластерні головні болі. Диференційний діагноз болю в ділянці обличчя описано у розділі 4. Двостороннє почуття тиску без інших назальних симптомів може бути викликано тензіонним головним болем та болем у середньому сегменті обличчя.
Аутоімунний васкуліт, такий як синдром Вегенера та синдром Черджа-Стросс, або саркоідоз можуть вражати ніс та пазухи; у рідкісних випадках можуть проявлятися гостро. Наявність інших відповідних симптомів та нетипового клінічного перебігу хвороби можуть вказати лікарю на інші діагнози.
У пацієнтів з імуносупресією та у (неконтрольованих) діабетиків гострий інвазивний грибковий риносинусит може проявлятися аналогічно до ГРС, але із тяжкими та швидко прогресуючими симптомами(260, 261) У разі підозри цього діагнозу потрібен більш агресивний діагностичний підхід, оскільки затримка у діагностуванні погіршує прогноз.
Одностороння водяниста ринорея трапляється рідко та повинна викликати підозру щодо протікання спинномозкової рідини.(262)
Септичні ускладнення при ГРС є невідкладним медичним станом та потребують швидкого виявлення лікарями загальної практики та негайного переведення до спеціалізованого відділення для оцінки стану хворого (Табл. 3.3.1).
Обсерваційні дослідження припускають, що ці ускладнення виникають рідко, але на ранніх етапах хвороби; на результати не впливає використання або невикористання антибіотиків під час первинного лікування.(232, 234)
| Периорбітальний набряк/еритема |
| Зміщення очного яблука |
| Двоїння в очах |
| Офтальмоплегія |
| Зниження гостроти зору |
| Виражений одно- або двобічний головний біль |
| Фронтальний набряк |
| Менінгіальні ознаки |
| Неврологічні симптоми |
| Втрата свідомості |
Ускладнення при ГРС у вигляді сепсису рідкісні, але їх рання діагностика є життєво важливою. Вони виникають на ранніх етапах хвороби, лікарі загальної практики повинні бути пильними стосовно тривожних ознак та симптомів, таких як висока температура, системні захворювання, периорбітальний набряк та погіршення зору
Хоча із ГРС без ускладнень частіше звертаються до лікарів загального профілю, проте у деяких системах охорони здоров'я пацієнти із гострими симптомами можуть звертатися до вузьких спеціалістів або можуть бути у короткий термін направлені до спеціаліста на обстеження, зазвичай до ринолога або ЛОРа. Звичайно, діагноз може бути поставлено клінічно за допомогою тих самих клінічних критеріїв, що описані вище, але іноді можуть застосовуватись більш детальні діагностичні дослідження. Негайне направлення пацієнта та/або госпіталізація призначаються при будь-якому із симптомів, перерахованих у Табл. 3.1.1.
Ендоскопія носа може застосовуватись для візуалізації анатомії носа та пазух та для виконання біопсії та взяття мікробіологічних проб. Кілька мікробіологічних досліджень (263-267) (Рівень доказовості ІІb) показали суттєвий зв'язок між пробами, взятими з середнього ходу під ендоскопічним контролем, та доказовими пункціями, що веде до можливості мікробіологічного підтвердження як патогену, так і його реакції на терапію (Таблиця 3.3.2). Мета-аналіз виявив точність 87%, при чому рівень достовірності нижньої межі складав 81.3% для посіву з середнього ходу під ендоскопічним контролем порівняно із пункціями з гайморових пазух при гострій інфекції гайморових пазух.(248) Деякі відомства рекомендують завжди підтверджувати клінічний діагноз гострого бактеріального риносинуситу ендоскопією та посівом,(268) оскільки у багатьох пацієнтів із клінічними та рентгенологічними доказами ГРС немає позитивних результатів бактеріологічного та мікробіологічного аналізу; оскільки у цій роботі ми схиляємось до терміну «гострий поствірусний риносинусит» та до протизапальної, а не протиінфекційної терапії у якості лікування першої черги, цінність цієї поради є спільною, зокрема, в середовищі, в якому доступ до ендоскопії обмежено. Ендоскопія носа можлива у пацієнтів будь-якого віку, у тому числі дітей, хоча у більшості випадків вона не надає додаткової інформації(269, 270)
|
Автор, рік, посилання |
Кількість випадків |
Тип риносинуситу |
Методика |
Відповідність |
|---|---|---|---|---|
|
Joniau 2005 (267) |
26 |
ГРС |
Ендоскопічний мазок (СНХ) порівняно з верхньощелепною пазухою |
88.5% |
|
Casiano 2001 |
29 |
ГРС (виражена клініка) |
Культура тканини (СНХ) порівняно з верхньощелепною пазухою |
60.0% |
|
Talbot 2001 (271) |
46 |
ГРС |
Ендоскопічний мазок (СНХ) порівняно з верхньощелепною пазухою |
90.6% |
|
Vogan 2000 (265) |
16 |
ГРС |
Ендоскопічний мазок (СНХ) порівняно з верхньощелепною пазухою |
93.0% |
|
Gold & Tami 1997 (264) |
21 |
ХРС |
Ендоскопічна аспірація (СНХ) порівняно з аспіратом верхньощелепної пазухи, отриманим під час ЕХП |
85.7% |
|
Klossek 1996 (263) |
65 |
ХРС |
Ендоскопічний мазок (СНХ) порівняно з аспіратом верхньощелепної пазухи, отриманим під час ЕХП |
73.8% |
ГРС: гострий риносинусит; ХРС: хронічний риносинусит; СНХ: середній носовий хід; ЕХП: ендоскопічна хірургія пазух
Для діагностування ГРС можливий ряд різноманітних методів візуалізації.
КТ-сканування є методом візуалізації, який обирається для підтвердження розміру патології та анатомії. Проте, його не слід вважати першочерговим етапом діагностики, за винятком, коли існують односторонні ознаки та симптоми або інші тривожні ознаки, але скоріше воно підтверджує анамнез та ендоскопічне обстеження після невдалої медичної терапії. КТ можна розглядати при тяжкій хворобі, у пацієнтів з порушеним імунітетом, при підозрах на ускладнення. Нещодавнє дослідження припускає, що КТ-сканування при ГРС дає небагато додаткової корисної інформації.(251) Однак, виявлення складної синусо-назальної анатомії вважається так само важливим, як і пітвердження запальних змін.(272-274) Можна виявити значні етнічні та індивідуальні відмінності.(275) Описано багато протоколів. Нещодавно центром уваги стало покращення різкості з одночасним зменшенням дози опромінення.(276) На скануванні було виявлено несуттєві відхилення у п'ятої долі «нормального» населення,(277) хоча більш сучасні дані пропонують, що здорові нормальні люди не повинні мати неочікувані порушення на знімках пазух.(278) У дітей, для яких проведення простої рентгенографії технічно важко, сканування пазух є технічно можливим та обирається у якості обстеження з візуалізацією, але у той самий час призначається лише при підозрі на ускладнення, якщо відсутня реакція на лікування(279)
Прості рентгенограми пазух є нечутливими та мають обмежену користь для діагностування риносинуситу через кількість хибнопозитивних та хибнонегативних результатів.(280-282) Однак, вона може бути корисною для доказу ГРС під час наукових досліджень. Трансілюмінацію рекомендували у 70-х рр. як недорогий та ефективний метод обстеження патології пазух.(283) Нечутливість та неспецифічність робить її ненадійною для діагностування риносинусит(284)
Ультразвукове обстеження пазух є нечутливим та має обмежену користь для діагностування ГРС через кількість неправдивих позитивних та негативних результатів. Проте, результати в руках досвідченого спеціаліста можна порівняти із рентгенограмою при діагностуванні ГРС, тому за деяких обставин це може бути корисним методом обстеження.(285-287)
У контексті наукових досліджень може знадобитися більш офіційний діагноз. У таких умовах перемінна комбінація симптомів, результатів медичної візуалізації, результатів обстеження та бактеріологічних зразків (отриманих з середнього ходу або з пункції з пазух) може потребуватись для підтвердження діагнозу, відповідно до протоколу дослідження. Діагностичні критерії, що використовуються, повинні бути зазначені у наукових дослідженнях, щоб можна було провести порівняння результатів досліджень.
ГРС є поширеним у ВРІТ (фактори ризику включають назогастральні зонди, механічну вентиляцію, пошкодження імунних механізмів та лежача позиція) та пов'язаний із поганими результатами. Інфекція може вражати декілька пазух.(288) В результаті, можуть знадобитись більш агресивні діагностичні процедури для підтвердження діагнозу та для визначення лікування. КТ-сканування може підтвердити діагноз,(289) а пункція з пазухи може бути безпечною у досвідчених руках та може надати важливу мікробіологічну інформацію для підтвердження діагнозу та визначення лікування.(288)
Пацієнти зі зниженим імунітетом набагато більше схильні до ускладнень ГРС, та потребують більш агресивний діагностичний підхід. Гострий інвазивний грибковий риносинусит (290) є серйозною хворобою із високими показниками летальності та ускладнень, що потребує швидкого діагнозу та лікування із відкритою або ендоскопічною хірургією пазух.
Діагноз є гістопатологічним, тому рекомендуються ранні ендоскопічні дослідження із відкритою біопсією, якщо залишаються якісь сумніви.(260, 261)
Відрізнити ХРС від РГРС може бути важко. В основі РГРС лежить повна регресія симптомів та ознак між епізодами. Деякі пацієнти мають РГРС та можуть представляти собою чіткий фенотип.(291) Такі пацієнти повинні проходити оцінку на фактор ризику, що лежить в основі, як, наприклад, алергія та анатомічні аномалії(60) У таких пацієнтів зрідка може виникати клінічно неіндентифікований імунодефіцит, але звичайні обстеження дають мало результатів.(292)
Введення у науково-доказове лікування ГРС має великий вплив на лікування терапевтами пацієнтів з ГРС. Багато клінічних досліджень чітко довели, що у більшості випадків ГРС виліковується без антибіотикотерапії. Симптоматичне лікування та підтвердження результатів представляють переважну первинну стратегію лікування для пацієнтів із легкими симптомами. Свою ефективність довели інтраназальні ГКС при монотерапії або у якості допоміжної терапії додатково до антибіотиків; проте, у пацієнтів із тяжким ГРС можна використовувати ГКС перорально для тимчасового полегшення головного болю та болю в ділянці обличчя та інших гострих симптомів. Антибіотикотерапію потрібно розглядати для пацієнтів із високою температурою або сильним болем (одностороннім) в ділянці обличчя. Для первинного лікування потрібно застосувати препарат найвужчого спектру, активний проти можливих патогенів. При лікування ГРС часто використовують рослинні суміші, але лише кілька рандомізованих подвійних, сліпих, плацебо контрольованих досліджень довели їх ефективність. Звідси, потребується підтвердження ефективності рослинних сумішей для лікування ГРС у додаткових добре розроблених та рандомізованих клінічних дослідженнях у майбутньому.
|
Автор, рік, посилання |
Критерії включення |
Чисельність |
Висновок |
|
|---|---|---|---|---|
|
Досліджень |
Пацієнтів/плацебо |
|||
|
Falagas та ін. 2009 (298) |
Рандомізоване контрольоване дослідження |
12 |
4 430 |
Лікування антибактеріальними препаратами коротким курсом мало порівнянну ефективність до довшого курсу терапії |
|
Falagas та ін. 2008 (345) |
Рандомізоване контрольоване дослідження |
17 |
2 648 |
Антибактеріальні препарати треба застосовувати тільки у пацієнтів з високою вірогідністю бактеріальної природи хвороби |
|
Burton та ін. 2008 (346) |
Огляд з бібліотеки Cochrane |
Немає |
Немає |
Низька ефективність лікування у пацієнтів з неускладненим ГРС |
|
Ahovuo-Saloranta та ін. 2008 (297) |
Рандомізоване контрольоване дослідження |
5 |
631 |
Антибіотики мають низьку ефективність застосування у пацієнтів з неускладненим ГРС. У 80% пацієнтів покращення стану відбувається без антибіотиків впродовж 2-х тижнів |
|
Young та ін. 2008 (295) |
Рандомізоване контрольоване дослідження |
9 |
2 547 |
Призначення антибіотиків невиправдано навіть у випадках, коли пацієнт має симптоми довше 7-10 днів |
|
Williams JW Jr та ін. 2008 |
Рандомізоване |
49 |
13 660 |
Для ГРС, підтвердженого рентгенологічно або за допомогою пункції, застосування антибіотиків пеніцилінового ряду виправдано впродовж 7-14 днів |
|
Rosenfeld та ін.2007 (347) |
Подвійне сліпе плацебоконтрольоване рандомізоване дослідження |
13 |
Немає |
Понад 70% пацієнтів з ГРС через 7 днів мають покращення стану з/без антибіотикотерапії |
|
Arroll B. 2005 (348) |
Огляд Кохранівчьких |
4 |
Немає |
Застосування антибіотиків при гострому гнійному риніті та гаймориті, окрім ускладнених випадків, повинно бути індивідуальним |
|
Stalman та ін. 1997 (349) |
Подвійне сліпе плацебоконтрольоване рандомізоване дослідження |
3 |
Немає |
Ефективність антибактеріальної терапії при гострому гаймориті у масовому застосуванні не підтверджується доказами |
ГРС є поширеною хворобою, що лікується як клініками загальної, так і вузькоспеціалізованої практики, лікарями загальної практики (ЛЗП), отоларингологами та педіатрами. Тому дуже важлива узгодженість у лікуванні ГРС серед ЛЗП та різноманітних спеціалістів, які зазвичай лікують ГРС. Проте, слід відмітити, що при аналізі досліджень на наявність наукового обґрунтування при лікування ГРС (незалежно від лікарського препарату, що досліджується) кілька з них повинні включати комбінацію пацієнтів із звичайною застудою та/або поствірусним, або бактеріальним ГРС (тобто ГКС та антибіотики при ГРС, Williamson IG 2007 (312)).
ГРС регресує без лікування антибіотиками у більшості випадків. Для пацієнтів із легкими симптомами переважною стратегією терапії є симптоматичне лікування та підтримка.
У докладах та різноманітних мета-аналізах чітко зазначено, що ГРС регресує без лікування антибіотиками у більшості випадків(8, 293-295) Для пацієнтів із легкими симптомами переважною стратегією терапії є симптоматичне лікування та підтримка. Антибіотикотерапія повинна розглядатися для пацієнтів із гарячкою або сильним (одностороннім) болем в ділянці обличчя. При початковому лікуванні потрібно використовувати препарат найвужчого спектру, активний проти імовірних патогенів (Streptococcus pneumoniae та Haemophilus influenzae), а не засіб широкого спектру дії.(293)
Згідно із даними NAMCS (англ.- National Ambulatory Medical Care Survey) у США риносинусит є п'ятим за поширеністю діагнозом, при якому призначають антибіотик. У 2002 р. риносинусит складав 9% та 21% всіх призначень антибіотиків для дітей та дорослих відповідно,(296) хоча використання антибіотиків при лікуванні легкого, помірного або неускладненого ГРС у більшості рандомізованих контрольованих дослідженнях не виявилось корисним (Таблиця 3.4.1) та не рекомендується майже всіма клінічними рекомендаціями(8, 293-296) Нещодавнє багатонаціональне дослідження в Азії довело, що надмірне вживання антибіотиків все ще представляє тривожну проблему серед ЛЗП, отоларингологів та педіатрів(9)
Для порівняння антибіотиків та плацебо або антибіотиків різних класів при лікуванні гострого гаймориту у дорослих нещодавно було проведено Кокранівське дослідження.(297) У цей огляд було включено всього 59 досліджень; шість плацебо-контрольованих досліджень та 53 дослідження з порівняння антибіотиків різних класів або з порівняння різних режимів дозувань одного й того ж антибіотика. З них 5 досліджень, у яких взяв участь 631 пацієнт, надали дані стосовно порівняння антибіотиків із плацебо, де клінічна невдача враховувалась як відсутність одужання або покращення через 7-15 днів спостереження. У цих дослідженнях було виявлено невелику статистичну різницю на користь антибіотиків порівняно з плацебо із загальним фактором ризику (відносний ризик - ВР) 0.66 (довірчий інтервал (ДІ) 95% 0.44-0.98). Проте, клінічна достовірність результатів є сумнівною, також враховуючи, що показник одужання або покращення був високим як у групі плацебо (80%), так і в групі, що отримувала антибіотики (90%).
На підставі шести досліджень, де клінічна невдача вважалась відсутністю повного одужання, спостерігалась достовірна різниця на користь антибіотиків, порівняно з плацебо, із загальним ВР 0.74 (95% ДІ 0.65-0.84) через 7-15 днів спостереження. Ні один з препаратів антибіотиків не був кращим за інший. У цьому дослідженні дійшли висновку, що антибіотики мали невеликий терапевтичний ефект у пацієнтів із неускладненим ГРС в умовах загальної терапії із симптомами, що тривали більше семи днів. Вісімдесят відсотків пацієнтів, які приймали антибіотики, відчули покращення через два тижні. Спеціалістам потрібно зважувати невелику користь від лікування антибіотиками відносно потенційних небажаних ефектів як для кожного пацієнта окремо, так і у масштабах популяції.(297)
Хоча антибіотики при ГРС слід використовувати для деяких пацієнтів із суттєвою вірогідністю бактеріальної хвороби, іноді важко встановити точний клінічний діагноз. Короткостроковий курс терапії із використанням антибіотиків мав порівняльну ефективність відносно більш тривалого курсу терапії при ГРС. Скорочене лікування, зокрема, для пацієнтів без тяжкої хвороби та ускладнюючих факторів може призвести до меншої кількості небажаних ефектів, кращого дотримання пацієнтом режиму лікування, більш низьким показникам розвитку резистентності та до зменшення витрат. (298)
У Кокранівському дослідженні, проведеному раніше,(299) метою авторів було вивчити, чи призначаються антибіотики при ГРС, і якщо так, то які класи антибіотики є найбільш ефективними. Первинні результати: а) клінічне одужання та Ь) клінічне одужання або покращення стану. Вторинні результати включали покращення рентгенограми, частота рецидивів та припинення лікування через небажані ефекти.
Стосовно лікування антибіотиками гострого гаймориту всього було розглянуто 49 досліджень із 13 660 учасниками. Порівняно із контрольною групою (5 досліджень) пеніцилін покращував клінічне одужання (відносний ризик (ВР) 1.72; 95% ДІ 1.00-2.96). Лікування амоксициліном не дало достовірного покращення показників одужання (ВР 2.06; 95% ДІ 0.65-6.53), але між дослідженнями існує значна варіативність. При лікуванні антибіотиками показники на рентгенограмі покращились. Порівняння класів антибіотиків (10 досліджень) не показало достовірної різниці між новішими препаратами, що не містять пеніциліну (цефалоспорини, макроліди, міноциклін), та пеніцилінами (амоксицилін, пеніцилін V) із ВР стосовно одужання 1.07 (95% ДІ 0.99-1.17); та новішими препаратами, що не містять пеніциліну порівняно із амоксициліном-клавуланатом (ВР стосовно одужання 1.03; 95% ДІ 0.96-1.11). Порівняно із амоксициліном-клавуланатом (17 досліджень) показники припинення лікування через небажані ефекти були достовірно нижчі для цефалоспоринів (ВР 0.47; 95% ДІ 0.30-0.73). Частота рецидивів впродовж одного місяцю після успішної терапії складала 7.7%. Автори дійшли висновку, що при гострому гаймориті, підтвердженому на рентгенограмі або за допомогою аспірації, у дійсний час існує обмежена кількість обґрунтувань, але вони підтверджують користь застосування пеніциліну або амоксициліну впродовж 7-14 днів. Спеціалістам потрібно зважувати помірну користь від лікування антибіотиками стосовно потенційних небажаних ефектів.(299)
Коментар робочої групи: станом на 26 березня 2015 року міноциклін (АТС-код І01АА08) в Україні не зареєстрований.
Лікування антибіотиками необхідно застосовувати до пацієнтів із тяжким ГРС, особливо при наявності високої температури або сильного (одностороннього) болю в ділянці обличчя. Спеціалістам потрібно зважувати помірну користь від лікування антибіотиками стосовно потенційних небажаних ефектів.
Порівняння різноманітних антибіотиків щодо їх дозування та тривалості, ефективності та побічних ефектів при лікування представлене у трьох таблицях, де перераховано загалом 42 перспективних рандомізованих подвійних сліпих плацебо- контрольованих досліджень (n=9, Таблиця 3.4.2.), порівняння антибіотиків (n=25, Таблиця 3.4.3.) або порівняння різних дозувань (n=5) або тривалості (n=3) лікування (Таблиця 3.4.4). Загалом, короткострокове лікування, особливо у пацієнтів без тяжкої хвороби та ускладнюючих факторів, може дати менше небажаних явищ, краще дотримання пацієнтом режиму лікування, більш низькі показники розвитку резистентності та зменшення витрат.(298)
Надмірне застосування антибіотиків було зафіксовано і в деяких країнах Європи,(300, 301) що безпосередньо призвело до підвищення частоти випадків протимікробної резистентності у Європі.(302, 303)
Хоча таких даних щодо Азії ще немає, нещодавнє оглядове дослідження показало, що навіть при легкому ГРС (звичайна застуда) 87% ЛЗП, 83.9% отоларингологів та 70% педіатрів все ж рекомендують медичне лікування.(9) До найбільш поширених терапій першої черги, що призначаються, входять антигістаміни (39.2%), назальний деконгестант (33.6%) та антибіотики (29.5%). Антибіотики набагато частіше застосували у якості терапії першої черги при помірному (45.9%) та тяжкому (60.3%) ГРС. Більше викликає тривогу те, що 13.6% учасників використовували більше двох класів антибіотиків для лікування навіть легкого ГРС.
Глобальна загроза, встановлена резистентними мікроорганізмами, стала міжнародної проблемою у сфері охорони здоров'я, результатом недбалого зловживання антибіотиками. Тому для початкової терапії необхідно використовувати засіб найвужчого спектру проти імовірних патогенів (Streptococcus pneumoniae та Haemophilus influenzae).(293)
Коментар робочої групи: в світі існує практика проведення багатоцентрових досліджень, які виконуються за єдиним протоколом із залученням великої кількості країн. В тому випадку, якщо дослідження присвячене вивченню антибіотикорезистентності, то дані, отримані в цьому дослідженні, лягають в основу створення регіональних рекомендацій щодо емпіричної антибіотикотерапії. Одним з наймасштабніших епідеміологічних досліджень антибіотикорезистентності є дослідження SOAR (Survey of Antibiotic Resistance). Дослідження сплановане і проводиться за фінансової підтримки компанії GlaxoSmithKline, Великобританія, з 2002 року. Це дослідження проводиться в декількох регіонах Землі. Кількість країн-учасників щороку збільшується. В 2010 році протокол дослідження антибіотикорезистентності S. pneumoniae та H. influenzae було схвалено Центральною комісією з питань етики МОЗ України. І восени 2010 року Україна приєдналась до цього дослідження. Дослідження проводиться з метою отримання даних щодо антибіотикорезистентності в досліджуваній місцевості (країні).
Результати дослідження свідчать про те, що існують відмінності у чутливості бактерій до антибіотиків, навіть між географічно близькорозташованими країнами. Це свідчить про необхідність проведення локальних досліджень, оскільки екстраполяція даних з інших країн може стати причиною помилки. В такому разі емпірична антибіотокотерапія виявиться недостатньо ефективною.
Основними збудниками ГБРС є S. pneumoniae та H. influenzae. За отриманими даними в Україні 87,3% штамів S. pneumoniae були чутливими до пеніциліну (критерії CLSI, 2012 р.). Слід зазначити, що в Україні 100% штамів S. pneumoniae виявилися чутливим до амоксициліну, захищеного клавулановою кислотою, левофлоксацину і цефтриаксону. Дещо нижчі показники були відмічені для цефуроксиму (95,5%), цефіксиму (88,8%) та ципрофлоксацину (89,6%). До кларитроміцину та еритроміцину 11,9% штамів S. pneumoniae виявилися нечутливими; 10,4% виявилися резистентними до азитроміцину.
Всі 100% штамів H. influenzae виявилися чутливими до амоксициліну, захищеного клавулановою кислотою, азитроміцину, цефіксиму, цефтриаксону, цефуроксиму, ципрофлоксацину та левофлоксацину. Дещо нижчі показники були відмічені для ампіциліну (94,0%), кларитроміцину (98,5%) та комбінації триметоприм + сульфаметоксазол (59,7%).
Хоча отримані дані не є клінічними результатами, проте вони підтверджують клінічну рекомендацію (за даними EP0S 2012) щодо ефективності застосування амоксициліну в комбінації з клавулановою кислотою для емпіричної терапії ГБРС. Дані щодо відповідної чутливості S. pneumoniae та H. influenzae (в Україні) до левофлоксацину і цефтриаксону дозволяють розглядати ці препарати в якості терапії другої лінії для лікування ГБРС, хоча ці дані ще мають бути підтверджені клінічними дослідженнями [Y. Feshchenko, A. Dzyublik, T. Pertseva et al. Antibacterial resistance among Streptococcus pneumoniae and Haemophilus influenzae from Ukraine. Results from the Survey of Antibiotic Resistance (SOAR) 2011-2013. 2014; 24th ECCMID, P-1589].
Враховуючи те, що діагноз ГБРС переважно буде виставлятися за клінічними критеріями і з огляду на отримані показники резистентності пневмококів, виділених від українських пацієнтів з респіраторними захворюваннями, до макролідів (азитроміцин - 10,4%, кларитроміцин - 11,9%), застосування даних препаратів для емпіричної терапії респіраторних інфекцій не може вважатися раціональним. Робоча група вважає, що призначення макролідів слід розглядати у випадках, коли є підтвердження етіологічної ролі атипової флори у виникненні ГБРС або є протипоказання для призначення захищених амінопеніцилінів.
Таблиця 3.4.2. Дослідження «короткострокових» антибіотиків порівняно з плацебо в лікуванні ГРС. Були включенні тільки проспективні рандомізовані подвійні сліпі плацебо контрольовані дослідження
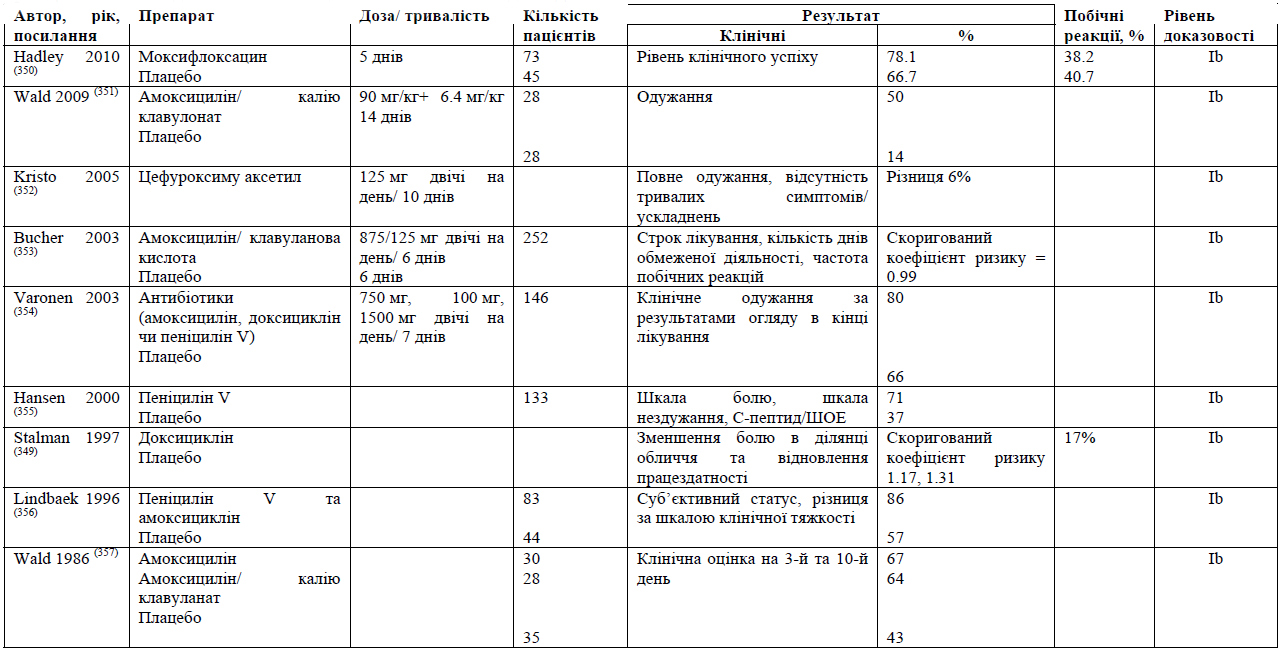
Таблиця 3.4.3. Дослідження коротких курсів антибіотикотерапії порівняно з іншими антибіотиками, що застосовуються для лікування ГРС. Були включені лише дослідження проспективні рандомізовані подвійно засліплені (Ib).
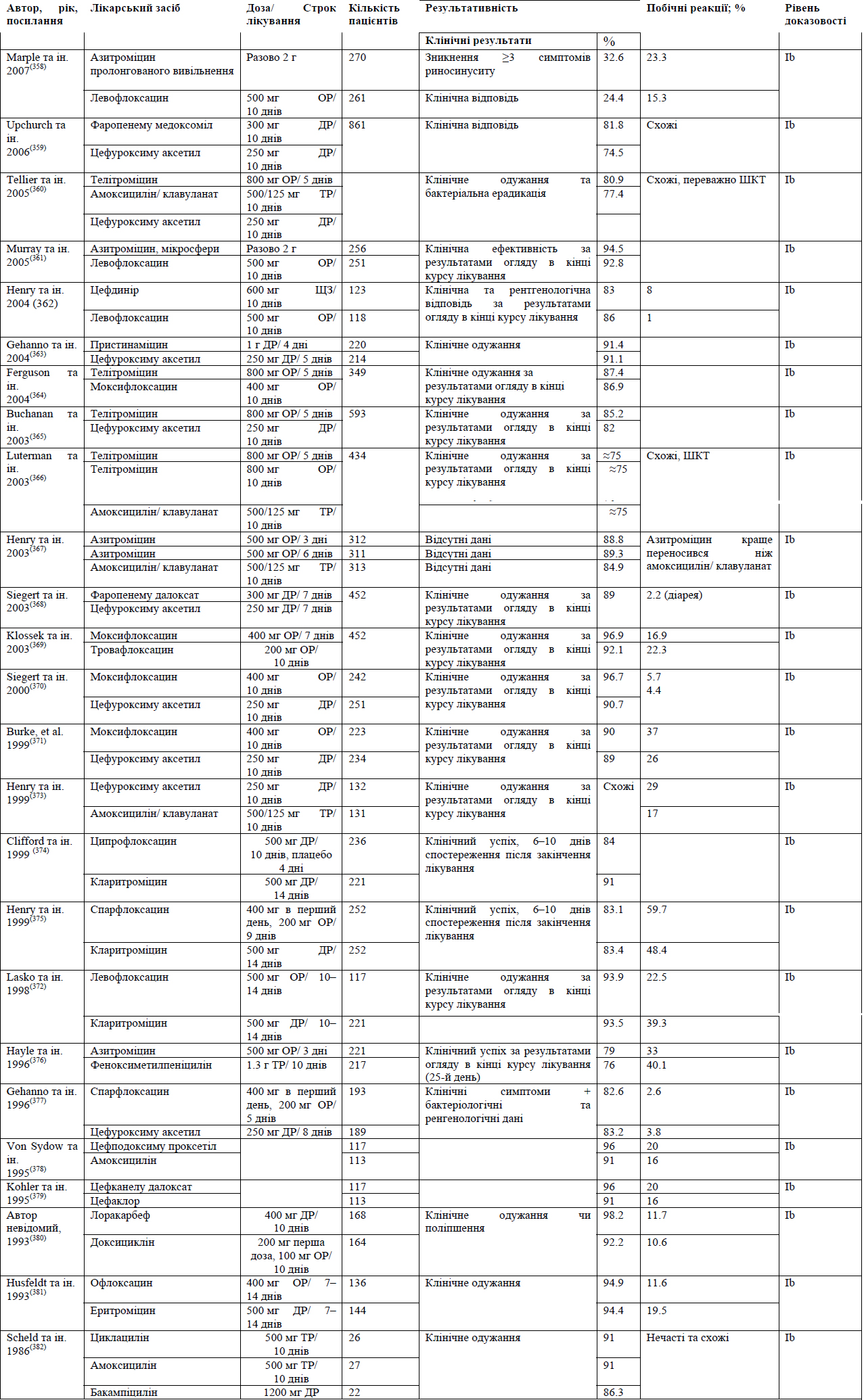
ОР – один раз на день; ДР – два рази на день; ТР – три рази на день
Таблиця 3.4.4. Дослідження «короткострокових» антибіотиків, порівняння різної тривалості та дозування, що використовувались в лікуванні гострого риносинуситу (ГРС). Були відібрані тільки дослідження з дизайном проспективного рандомізованого подвійного сліпого (Ib).
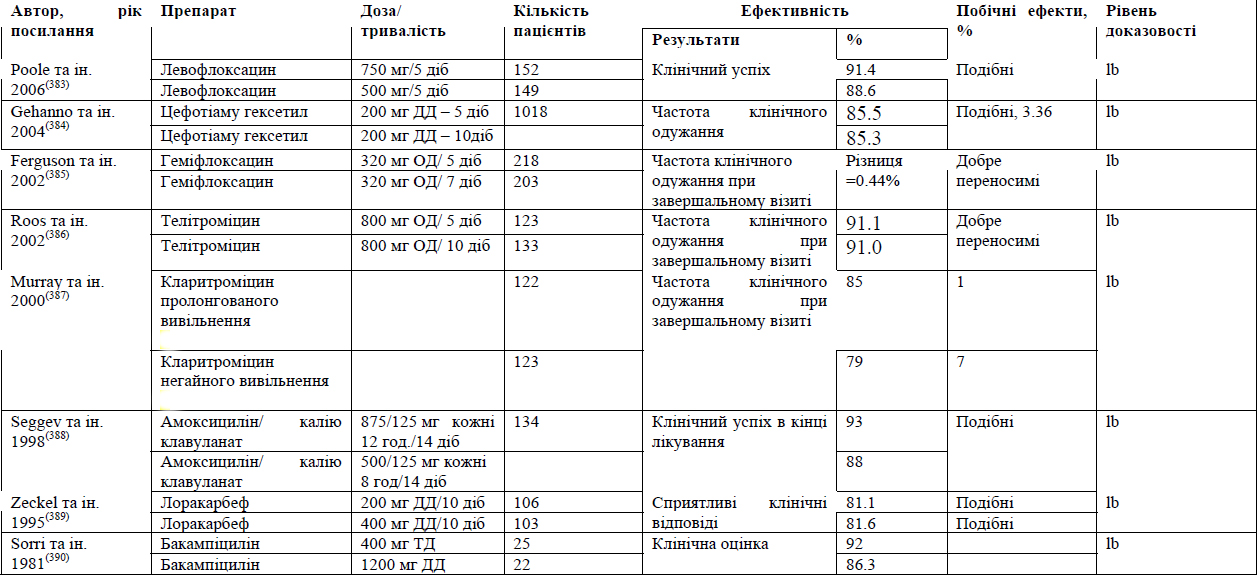
OД: один раз на день; ДД: два рази на день; TД; три рази на день.
Коментар робочої групи: фаропенему медоксоміл (АТС-код: J01DI03), телітроміцин (АТС-код: J01FA15), цефдинір (АТС-код: J01DD15), пристинаміцин (АТС-код: J01FG01), тровафлоксацин (АТС-код: J01MA13), феноксиметилпеніцилін (АТС-код: J01CE02), цефаклор (АТС-код: J01DC04), цефотіаму гексетил (АТС-код: J01DC07), лоракарбеф (АТС- код: J01DC0S), бакампіцилін(АТС-код: J01CA06) станом на 1S березня 2015року в Україні не зареєстровані; для цефканелу долоксату (англ. Cefcanel daloxate) та циклациліну (англ. Cyclacillin) не зареєстровані міжнародні непатентовані назви.
У документі EP3OS 2007 для лікування ГРС, як помірного (монотерапія), так і тяжкого (із пероральними антибіотиками), рекомендуються інтраназальні ГКС.
Інтраназальні ГКС рекомендовано для лікування ГРС, як при помірній (монотерапія), так і тяжкій (із пероральними антибіотиками) хворобі.
У більшості досліджень з ГКС при ГРС було встановлено ефект топічних ГКС при застосуванні у якості допоміжної терапії додатково до антибіотиків (Таблиця 3.4.5).(304-309) Нещодавно було опубліковано подвійне сліпе плацебо-контрольоване дослідження із двома імітаціями, в якому лікування топічними ГКС використовувалось у якості монотерапії та порівнювалось із антибіотиками.(310) У цьому дослідженні використовували моментазону фуроат (МФ) та порівнювали з амоксициліном та плацебо при ГРС. МФ 200 мг двічі на добу значно більше покращував показники оцінки симптомів, ніж плацебо та амоксицилін. При застосуванні один раз на добу МФ також давав кращі результати, ніж плацебо, але не амоксицилін. Це перше дослідження, в якому показано, що топічні ГКС при вживанні двічі на добу є ефективним для лікування ГРС у якості монотерапії та є більш ефективним, ніж амоксицилін, при застосуванні двічі на день. Дані цього дослідження також підкріплюються двома іншими дослідженнями із аналогічним дизайном (Таблиця 3.4.5).(311, 1367) Проте, в іншому досліджені ні антибіотики, ні топічні ГКС, самостійно або у поєднанні, не мали ефекту стосовно зміни ступеню тяжкості симптомів або тривалості бактеріального ГРС.(312) Проте, до цього дослідження входили пацієнти із симптомами, що тривали 4 дні, що відповідає критеріям включення щодо звичайної застуди, але не ГРС.
Таблиця 3.4.5. Лікування гострого риносинуситу (ГРС) назальними ГКС в якості монотерапії або в якості додаткової терапії до пероральних антибіотиків
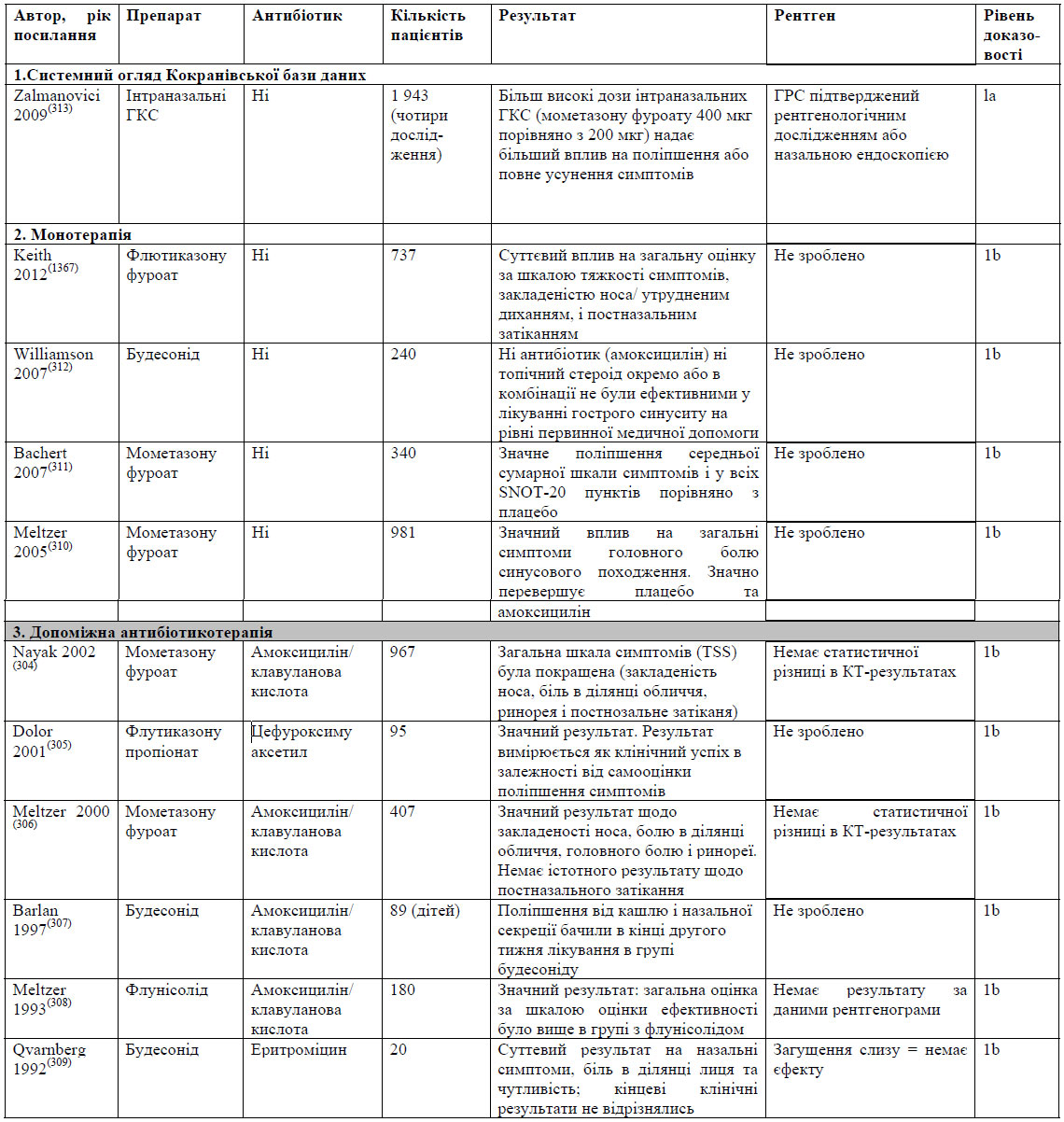
КТ: комп'ютерна томографія
Коментар робочої групи: станом на 12.06.2015 року флунісолід (АТС-код: R01AD04) не зареєстрований в Україні.
У недавньому Кокранівському аналізі результати чотирьох подвійних сліпих плацебо- контрольованих досліджень із залученням всього 1 945 пацієнтів підтримували застосування ГКС інтраназально у якості монотерапії або у якості допоміжної терапії додатково до антибіотиків (рівень доказовості Іа).(313) Більш високі дози інтраназальних ГКС сильніше впливали на покращення або повне зняття симптомів; для мометазону фуроату 400 мг порівняно із 200 мг, (ВР 1.10; 95% ДІ 1.02-1.18 порівняно із ВР 1.04; 95% ДІ 0.98-1.11). Значних небажаних явищ заявлено не було, також не було достовірної різниці у показниках припинення лікування та рецидивів для двох терапевтичних груп та для груп, що отримували більш високі дози інтраназальних ГКС. У майбутньому необхідні додаткові рандомізовані клінічні дослідження для вивчення ефективності та належного використання антибіотиків та інтраназальних ГКС у якості монотерапії або комбінованої терапії при лікування ГРС різних ступенів тяжкості.
Коментар робочої гупи: після 2012 року з 'явилися нові дослідження щодо ефективності інтраназального мометазону фуроату (АТС-код: R01AD09). Ці дослідження [Eli O. Meltzer, MD; Davis Gates, PhD ; and Claus Bachert. Mometasone furoate nasal spray increases the number of minimal-symptom days in patients with acute rhinosinusitis Ann Allergy Asthma Immunol 108 (2012) 275-279; Johanna Svensson1, Johan Lundberg, Petter Olsson, Pдr Stjдrne, Gunnel Ragnarson Tennvall. Cost-effectiveness of mometasone furoate nasal spray in the treatment of acute rhinosinusitis. Prim Care Respir J 2012; 21(4): 412-418] підтверджують раніше отримані дані щодо ефективності лікування гострого риносинуситу мометазоном фуроатом в дозі 200 мкг двічі на добу. Ці дані (станом на 12 червня 2015 року) узгоджуються із даними інструкцій для медичного застосування препаратів мометазону фуроату (АТС-код: R01AD09), зареєстрованих в Україні.
Результат нещодавнього Кокрановського аналізу показує, що пероральні ГКС у якості допоміжної терапії додатково до пероральних антибіотиків є ефективними для нетривалого полегшення симптомів (наприклад, головного болю, болю в ділянці обличчя, зняття набряку у носі, тощо) при ГРС (рівень переконливості Іа).(314)
Gehano та ін.(315) випробували 8 мг метилпреднізолону тричі на день впродовж 5-ти днів у якості допоміжної терапії до 10-денної терапії із застосуванням амоксициліну з клавуланатом калію у пацієнтів із ГРС (критерії: симптоми <10 днів, краніо-фаціальний біль, гнійні виділення з носа із гнійним відтоком з середнього ходу, затемнення пазух на рентгенограмі або знімку КТ) у плацебо-контрольованому дослідженні. У терапевтичних результатах на 14-й день між групами (n=417) різниці не спостерігалось, але на 4-й день відбувалось значне зменшення головного болю та болю в ділянці обличчя у групі ГКС (Таблиця 3.4.6). У багатоцентровому дослідженні Klossek та ін. (316) оцінювали у подвійному сліпому рандомізованому дослідженні на паралельних групах ефективність та переносимість преднізону, який вводили впродовж 3-х днів додатково до цефподоксиму дорослим пацієнтам, у яких проявлялись симптоми ГБРС (підверджено посівом) із сильним болем. Оцінка, яку проводили впродовж перших 3-х днів лікування, показала статистично достовірну різницю на користь групи, що отримувала преднізон, стосовно болю, назальної обструкції та вживання парацетамолу (Таблиця 3.4.6). По закінченню лікування антибіотиками між цими двома групами різниці не спостерігали. Переносимість, яку вимірювали під час дослідження, була аналогічною у двох групах. Біль значно полегшився під час лікування преднізоном, але після 10 днів антибіотикотерапії різниці між двома групами помітно не було.
Тривале застосування системних ГКС несе широко відомий ризик, пов'язаний із цими препаратами. Оскільки доказів щодо вживання ГКС пацієнтами при ГРС недостатньо, необхідно провести високоякісні дослідження з оцінки ефективності системних ГКС як у якості допоміжної терапії, так і монотерапії в умовах загальної практики, щоб отримати більш чітку відповідь стосовно їх використання. В цих дослідженнях повинно бути зазначено як короткострокові (< 2-х тижнів) та довгострокові (> 2-х тижнів) ефекти, а також інформацію про показники рецидивів та побічних реакцій.(314)
Коментар робочої групи: станом на 23 червня 2015року в Україні преднізон (АТС- код: Н02АВ07) не зареєстрований з показаннями для лікування гострого риносинуситу чи нетривалого полегшення симптомів (наприклад, головного болю, болю в ділянці обличчя, зняття набряку в носі)
Таблиця 3.4.6 в оригінальному документі відсутня.
У дослідженні Рибака та ін. (317)для вивчення профілактичного ефекту флутиказону пропіонату (ФП, 200 мг чотири рази на добу) або плацебо на ризик розвитку ГРС лікування використовували впродовж 6-ти днів на 199 суб'єктах із гострою звичайною застудою, через 24-28 годин після появи симптомів. Частота виникнення синуситу на 7-й день у суб'єктів із позитивним посівом риновірусу у носо-глоткових аспіратах згідно із рентгенограмою складала 18.4% та 24.9 % у групі, що приймала ФП та у групі плацебо відповідно (р=0.07), що вказує на незначний ефект ФП. Насправді, це дуже малий доказ профілактичного ефекту інтраназальних ГКС для профілактики рецидиву епізодів ГРС.
Стосовно вірусного риносинуситу була виконана велика кількість досліджень та Кокранівських аналізів. Загалом, дослідження мали низьку якість, що ускладнює формування чітких рекомендацій.
Стосовно використання антигістамінів (як інтраназальних, так і пероральних) при лікуванні поствірусного ГРС показань немає, окрім використання при супутньому алергічному риніті.
Пероральні антигістаміни препарати є лікарськими засобами, що часто призначаються, особливо при легкому ГРС.(9) Антигістаміни - це стандартна терапія при алергічних хворобах, зумовлених І§Б, таких як алергічний риніт, де гістамін (що вивільнюється мастоцитами та базофілами) є одним з головних ефекторів алергічної реакції.(318, 319) Вважається, що патофізіологія ГРС є вторинною бактеріальною інфекцією, викликаною порушенням механічних, гуморальних та клітинних імунітетів та пошкодженням епітелію через вірусну інфекцію (звичайну застуду).(8) Атигістаміни незначною мірою можуть бути ефективними для послаблення симптомів нежиті та чихання впродовж 2-х днів при вірусному риносинусит.(1365) Стосовно використання антигістамінів (як інтраназальних, так і пероральних) при лікуванні поствірусного ГРС показань немає, окрім лікування супутнього алергічного риніту.
Назальні деконгестанти широко застосовуються для лікування ГРС з метою зменшення застою та в очікуванні покращення вентиляції та відтоку з пазух, а також для симптоматичного полегшення застою у носі. Експериментальні дослідження з ефекту топічних декогестантів за допомогою КТ (320) та знімків МРТ (321) на остіальну проходимість та проходимість остіомеатального комплексу підтвердили виражений ефект на зменшення застою у нижній та середній носових раковинах та слизової оболонки інфудібулярної частини, але ефект на гратчасту та гайморову пазухи був відсутнім. Експериментальні дослідження заявляють про корисний протизапальний ефект ксилометазоліну та оксиметазоліну у вигляді зниження синтетази оксиду азоту(322) та їх антиоксидантні властивості.(323)
На відміну від попередніх досліджень (in vitro) присвячених впливу декогестантів на мукоциліарний транспорт, контрольоване клінічне дослідження (рівень доказовості ІІ) Inanli та ін. заявляє про покращення мукоциліарного кліренсу in vivo через 2 тижні застосування оксиметазоліну при ГБРС порівняно із флутиказоном, гіпертонічним розчином та сольовим розчином; воно не показало достовірного покращення порівняно із групою, до якої не застосовували звичайних назальних процедур. Також перебіг хвороби у групах достовірно не відрізнявся.(324) Ці результати відповідають попередньому контрольованому дослідженню на дорослих із гострим гайморитом (рівень доказовості Ib), що не підтвердило якогось достовірного впливу декогенстантів при додаванні до програми лікування пеніциліном стосовно щоденних показників оцінки симптомів головного болю, обструкції та оцінки пазух на рентгенограмі.(325) Тому результати цього дослідження вказують на те, що зняття набряку отворів пазух не представляє первинну необхідність при лікуванні ГРС.
Однократна доза декогестанту (пероральний норефедрин, топічний оксиметазолін, пероральний псевдоефедрин, назальний ксилометазолін) можуть незначною мірою бути більш ефективними, ніж плацебо при зниженні застою через 3-10 годин у пацієнтів із вірусним риносинусітом.(1365) Лікування з деконгестантами не виявилось більш ефективним за натрію хлорид при додаванні до терапії антибіотиками та антигістамінами у рандомізованому подвійному сліпому плацебо-контрольованому дослідженні стосовно риносинуситу у дітей (рівень переконливості Ib).(326) Проте, подвійне сліпе рандомізоване плацебо-контрольоване дослідження продемонструвало достовірний захисний ефект 14- денного курсу назального деконгестанту (у поєднанні із топічним будесонідом через 7 днів) для профілактики розвитку госпітального гаймориту у пацієнтів відділення реанімації та інтенсивної терапії із штучною вентиляцією.(327) Рентгенологічно підтверджений гайморит спостерігали у 54% пацієнтів у групі, що отримувала активне лікування та у 82% контрольних суб'єктів, відповідно, а інфекційний гайморит спостерігали у 8% та 20% груп, відповідно.(327) Проте, клінічний досвід виступає за топічне застосування деконгестантів у середньому носовому ході при ГРС, але не за допомогою назального спрею або крапель для носа (рівень переконливості IV).
Нещодавно було опубліковано систематичний огляд (Кокранівський аналіз) ефективності деконгестантів, антигістамінів та промивання носа у дітей із клінічним діагнозом ГРС.(328) З 402 досліджень, знайдених за допомогою електронного та ручного пошуку, жодне не відповідало всім критеріям включення (будь-який з цих препаратів порівняно із плацебо або відсутністю препарату). Було зроблено висновок про відсутність обґрунтування для визначення ефективності використання антигістамінів, деконгестантів або промивання носа у дітей із ГРС.
В іншому Кокранівському огляді розглядалась ефективність поєднань антигістамінів, декогестантів та анальгетиків у зменшенні тривалості та послабленні симптомів звичайної застуди у дорослих та дітей. Автори включили 27 рандомізованих контрольованих випробувань (5 117 учасників) з дослідження ефективності лікування звичайної застуди. У чотирнадцяти випробуваннях досліджували поєднання антигістаміну-декогестанту. Автори дійшли висновку, що згідно із сучасними доказами поєднання антигістамінів, декогестантів та анальгетиків мають деякий загальний позитивний ефект у дорослих та дітей старшого віку (рекомендація А). Вони рекомендують зважувати користь по відношенню до ризику небажаних ефектів. Вони не виявили доказів ефективності у дітей молодшого віку.(1363)
Коментар робочої групи: стереоізомер норефедрину фенілпропаноламін (АТС-код R01BA01) та псевдоефедририн (АТС-код R01BA02) станом на 05.03.2015року в Україні не зареєстрований.
Промивання носа сольовим розчином має обмежений ефект у дорослих із ГРС.
Промивання носа - це процедура, при якій носову порожнину промивають водою, ізотонічним або гіпертонічним сольовим розчином. У літературі також використовують й інші синоніми, як, наприклад, назальний душ, промивка або лаваж. У ряді рандомізованих контрольованих досліджень аналізували промивання носа та передньої частини носової порожнини ізотонічним або гіпертонічним сольовим розчином при лікуванні ГРС та ХРС. Хоча сольовий розчин вважається контрольним лікуванням сам по собі, пацієнтам у цих рандомізованих випробуваннях призначали різні методи застосування сольового розчину або гіпертонічного сольового розчину, або гіпертонічний порівняно із ізотонічним. Порівнювали результати у групах. Більшість із них доводять, що назальні промивки або промивання ізотонічним або гіпертонічним сольовим розчином є корисними для полегшення симптомів. Деякі американські автори віддають перевагу гіпертонічному сольовому розчину над ізотонічним при лікуванні риносинуситу, головним чином згідно із роботою, у якій вказується, що він достовірно покращує мукоциліарний кліренс у носі, виміряний за допомогою сахаринового тесту на здорових добровольцях.(329)
У рандомізованому дослідженні (Ib) Adam та ін. (330) із двома контролями порівнювали гіпертонічний назальний сольовий розчин із ізотонічним та відсутністю лікування у 119 пацієнтів із загальною застудою та ГРС (які складали більшість). Підсумковими показниками були суб'єктивні бали оцінки назальних симптомів (застій, секреція, головний біль) на 3-й день, 8/10 день та в день регресії симптомів. Пацієнти із риносинуситом (98%) також отримували антибіотики. Між групами різниці виявлено не було, та тільки 44% пацієнтів використовували спрей із гіпертонічним сольовим розчином повторно. Тридцять два відсотки помітили печію, порівняно із 13% групи, що отримувала фізрозчин.
Антральне промивання не дало достовірного ефекту при додаванні до стандартного 10-денного лікування антибіотиками при (4 антибіотики+декогестанти порівняно із антральними промивками; 50 пацієнтів на групу) ГРС, у кожній групі із промивками показник одужання був кращим приблизно на 5% ніж у групі, що приймала декогестанти, що було недостовірно.(331)
Пізніше був опублікований огляд Кокранівських даних з рандомізованих контрольних досліджень (3 РКД із 618 учасниками), у яких топічне лікування назальним сольовим розчином порівнювали із іншими процедурами у дорослих і дітей з клінічно діагностованими гострими ГВДТТТ (звичайною застудою та риносинуситом). Більшість результатів не показала різниці між лікуванням назальним сольовим розчином та контрольною групою. Проте стосовно користі промивання носа сольовим розчином у дорослих кількість доказів була обмеженою. В одному дослідженні середня різниця склала 0.3 дня (з восьми днів) стосовно регресії симптомів, але це не було достовірним. В одному дослідженні промивання носа сольовоим розчином було пов'язане із меншою кількістю вільного часу. Легкий дискомфорт зустрічався доволі часто, 40% немовлят не переносили краплі сольового розчину для носа.(332)
Для визначення, чи є назальний душ ефективним для лікування ГРС та профілактики рецидиву інфекцій верхніх дихальних шляхів, був зроблений ще один систематичний огляд літератури. Результати показали, що назальний душ із застосування сольового розчину мав обмежений ефект у дорослих із ГРС (рівень доказовості Іа). Він є ефективним у дітей із ГРС як додаток до стандартних лікарських засобів (рівень доказовості Ib) та може попереджати рецидив інфекцій (рівень доказовості ІІb).(333)
Підігріте, зволожене повітря давно використовується тими, хто страждає від загальної застуди. Теоретична база полягає у тому, що пар може сприяти кращому відтоку застійного слизу, а тепло може знищити вірус застуди, як це стається in vitro. В огляд було включено шість досліджень (394 учасники випробування). У трьох дослідженнях, у яких можуть бути об'єднані дані пацієнтів, було виявлено користь від пару для полегшення симптомів звичайної застуди (ВШ 0.31; 95% ДІ 0.16-0.60). Проте, результати стосовно показників симптомів були спірними. Як висновок, парові інгаляції не проявили значного позитивного ефекту при лікуванні звичайної застуди, оскільки вони не рекомендовані при стандартному лікуванні симптомів звичайної застуди, доки не буде проведено більше подвійних сліпих, рандомізованих випробувань із стандартизованими терапевтичними методами (рекомендація А(-)).(1364)
Для складення систематичного огляду ефективності фізичних процедур з метою припинення або зменшення поширення респіраторних вірусів було проведено Кокранівський аналіз. Рандомізовані дослідження припускають, що поширенню респіраторного вірусу можна запобігти за допомогою гігієнічних засобів, таких як миття рук, особливо серед дітей молодшого віку. Посилюючий ефект додавання віруцидних або антисептичних засобів до звичайного миття рук для зменшення респіраторної хвороби залишається сумнівним. Дослідження з дизайном випадок-контроль пропонують, що застосування бар'єрів передачі, ізоляції та гігієнічних засобів є ефективним для обмеження епідемій респіраторних вірусів. Стосовно того, що соціальна ізоляція є ефективною, особливо якщо пов'язана із підверженням ризику (рекомендація А), існує небагато доказів.(1358)
Для визначення дії іпратропію броміду порівняно із плацебо або відсутністю лікування на ступінь тяжкості ринореії та застою у носі у дітей та дорослих із звичайною застудою було проведено кокранівський аналіз. Сім досліджень (2 144 учасників). Чотири дослідження (1 959 учасників) вивчали суб'єктивну зміну ступеню тяжкості ринореї. Всі дослідження узгоджено заявили про статистично достовірні зміни на користь іпратропію броміду. Назальну обструкцію описували у чотирьох дослідженнях, було виявлено відсутність достовірних змін між двома групами. Автори дійшли висновку, що для людей із звичайною застудою існуючий доказ, що має деякі обмеження, вказує на те, що іпратропію бромід імовірно є ефективним при знятті ринореї. Іпратропію бромід не мав ефекту на закладеність носа, його використання було пов'язано із більшою кількістю побічних ефектів порівняно до плацебо або до відсутності лікування, хоча вони виявились такими, що добре переносяться та зникають самостійно (рекомендація А).(1361)
Коментар робочої групи: станом на 23 червня 2015 року в Україні не зареєстровано препаратів іпратропію броміду (ATC-код: R01AX03) з показаннями для лікування гострого риносинуситу.
Для оцінки ефективності та безпеки пробіотиків для профілактики гострих ІВДШ було проведено Кокранівський аналіз. Автори включили 14 РКД, але дані, доступні для мета- аналізу, можна було взяти лише з 10 випробувань (3 451 учасників). При прийомі пробіотиків кількість учасників, що страждають від епізодів гострих ІВДШ та відносний ризик епізодів гострої ІВДШ знизились, а застосування антибіотиків було більш обмеженим, ніж із плацебо (рекомендація А).(1362)
Щеплення не має прямого ефекту на лікування ГРС. Проте, планові щеплення дітей мали результативний вплив на частоту та бактеріологію ГСО та РБРС.(341) Було визначено, що імунізація веде до посилення резистентної здатності господаря, зниження захворюваності гострими респіраторними інфекціями та змін у структурі ускладнень через інфекцію.(342) В іншому досліджені через 5 років після введення 7-валентної пневмококової вакцини (ПКВ7) дітям порівняно з попередніми 5 роками спостерігали значну переміну у збудниках гострого синуситу. Доля S. pneumoniae зменшилась на 18%, але доля H. influenzae збільшилась на 8%.(108)
У багатоцентровому рандомізованому подвійному сліпому плацебо-контрольованому дослідженні з подвійною імітацією 392 пацієнти з ІВДШ отримували однократну дозу аспірину 500-1000 мг, ацетамінофену 500 або 1000 мг або відповідне плацебо.(343) Достовірні зменшення спостерігали у середній інтенсивності головного болю, почуття болю та дискомфорту, пов'язаного із гарячкою, у всіх активних терапіях (р<0.001), але не у чутливості пазухи до перкусії або болю у горлі (рівень доказовості Іb). Для виявлення дії та небажаних ефектів НПЗП порівняно з плацебо та іншими терапіями стосовно ознак та симптомів звичайної застуди було проведено Кокранівський огляд. В огляд входило дев'ять рандомізованих контрольованих досліджень (РКД), в яких описувалось 37 порівняльних досліджень: шість - порівняння НПЗП з плацебо, три - порівняння НПЗП із НПЗП (1 064 пацієнти із звичайною застудою). НПЗП достовірно не зменшували загальні бали оцінки симптомів або тривалість застуди. Проте, стосовно результатів, пов'язаних із анальгетичним ефектом НПЗП (головний біль, біль у вухах, а також біль у м'язах та суглобах) НПЗП мали значні переваги. Стосовно підвищеної частоти небажаних ефектів у групах, що отримували НПЗП, доказів не було. Автори рекомендують НПЗП для послаблення дискомфорту або болю, викликаного загальною застудою.(1357)
Коментар робочої групи: аспірин - це торгова назва препарату, діючою речовиною якого є кислота ацетилсаліцилова; ацетамінофен більш відомий, як парацетамол.
Кокранівський аналіз цинку та звичайної застуди включав 15 рандомізованих контрольованих подвійних сліпих досліджень. Було встановлено, що цинк скорочує тривалість епізоду звичайної застуди і також може використовуватися у якості профілактики для зниження ризику розвитку епізоду звичайної застуди. Занадто рано давати загальні рекомендації стосовно застосування цинку, оскільки у нас немає достатньо знань про оптимальне дозування, формулу та тривалість лікування. Подальші дослідження повинні фокусуватись на ускладненнях після звичайної застуди (рекомендація С).(1352, 1356)
Роль вітаміну С (аскорбінової кислоти) у профілактиці та лікуванні звичайної застуди багато років була предметом протиріч, але він широко продається та використовується як профілактичний та терапевтичний засіб. Було проведено Кокранівське дослідження, що охоплює тридцять випробувань за участю 11 350 осіб, з мета-аналізу відносного ризику (ВР) розвитку застуди при профілактичному прийомі вітаміну С. Незданість добавки у вигляді вітаміну С знизити захворюваність на застуду у нормального населення вказує, що планова профілактика із застосуванням мегадоз раціонально не обґрунтована для використання у суспільстві. Але докази пропонують, що вона може бути обґрунтованою для людей, що іноді займаються тяжкими фізичними вправами або знаходяться в холодному оточенні впродовж нетривалих періодів часу (1366) (Рівень доказовості Іа, рекомендація С).
Муколітики використовуються у якості допоміжних засобів додатково до лікування антибіотиками та/або деконгестантами при ГРС з метою зменшення в'язкості секрецій з пазухи. У нещодавньому оглядовому дослідженні у Франції 45% пацієнтам із гострим гайморитом призначили муколітики.(228) Незважаючи на те, що деякі ліки проявляють муколітичний ефект та були рекомендовані у якості допоміжної терапії при ГРС, користь такого лікування є нечіткою через відсутність стандартизації фармакодинамічних та фармакокінетичних властивостей цих ліків, а також знадобляться подвійні сліпі, плацебо контрольовані (ПСПК) рандомізовані дослідження для доведення їх ефективності.
Існує раннє РКД (звіт італійською мовою), в якому припускається, що бромгексин є кращим за плацебо.(334) У нещодавньому рандомізованому ПСПК дослідженні застосування ердостеїну у якості муколітичного засобу у дітей із ГРС не впливало прямо на успіх лікування.(335) У майбутньому все ще знадобиться додаткова стандартизація муколітиків та крупніші ПСПК рандомізовані дослідження для повної оцінки ефективності муколітиків при лікуванні ГРС.
Для оцінки ефективності рослинних сумішей при лікуванні ГРС було виконано всього кілька ПСПКрандомізованих досліджень, які не представляють повний спектр рослинних препаратів, що використовуються для лікування ГРС. Для розуміння фармакодинамічних та фармакокінетичних властивостей активної суміші лікарських трав та їх механізмів лікування ГРС знадобиться більше таких досліджень та мета-аналізів.
У лікуванні ГРС та ХРС широко використовуються комплементарні/альтернативні препарати, але важко сформувати науково-обґрунтовані рекомендації через нестачу рандомізованих контрольованих досліджень та методологічних проблем у багатьох клінічних дослідженнях та випробуваннях. На сьогоднішній день було проведено лише кілька ПСПК рандомізованих досліджень для оцінки ефективності рослинних сумішей у лікування ГРС (Таблиця 3.4.7), що не представляють усього спектру рослинних препаратів, що використовуються для лікування ГРС. До того ж активні поєднання рослинних сумішей ще не були відкриті, очищені та стандартизовані. Для розуміння фармакодинамічних та фармакокінетичних властивостей активної суміші лікарських трав та їх механізмів лікування ГРС знадобиться більше таких досліджень та мета-аналізів. Вся ця інформація є необхідною, щоб ми могли скласти науково обґрунтовані рекомендації, тому сьогодні ми не можемо приймати або відхиляти рослинні препарати для лікування ГРС (рекомендація С).
У Кокранівському досліджені вивчалась дія екстракту pelargonium sidoides (P. sidoides) при лікуванні гострих інфекцій дихальних шляхів.(336) Проводилось лише одне дослідження на пацієнтах із ГРС, та ще одне із звичайною застудою, що увійшли до аналізу на підставі критеріїв РКД.(337, 338) На закінчення, P. sidoides може бути ефективною для пом'якшення симптомів ГРС та звичайної застуди у дорослих, але ще існують сумніви.(336)
Коментар робочої групи: Pelargonium sidoides - пеларгонія (герань) очіткова.
В іншому ПСПК рандомізованому багатоцентровому досліджені (рівень доказовості Іb) оцінювали ефективність стандартизованого миртолу (4 капсули по 300 мг/добу впродовж 6±2 днів) при лікування ГРС (n=331). Результати показали статистично достовірну різницю стосовно покращення загальних показників оцінки симптомів синуситу, що змінились на 10.5 та 9.2 бали при лікуванні стандартизованим миртолом та плацебо, відповідно.(339) Потреба у лікуванні антибіотиками після миртолу складала 23% порівняно із 40% після плацебо. Цей препарат було рекомендовано для лікування ГРС та ХРС клінічними протоколами Німецької асоціації отоларингології.(340)
В іншому Кокранівському досліджені вивчалась ефективність та безпека застосування китайських рослинних препаратів при звичайній застуді. У нього було включено чотирнадцять досліджень за участю 2 440 пацієнтів. Методи всіх цих досліджень було визнано низької якості. У включених дослідженнях «ефективні препарати» використовувались у якості контролю; проте, ефективність цих контрольних препаратів не була заявлена. У шести дослідженнях п'ять рослинних препаратів були визнані більш ефективними для покращення одужання, ніж контроль; а в інших восьми дослідженнях п'ять рослинних препаратів були визнані рівними контролю. Існує сильна вірогідність систематичних помилок у всіх включених дослідженнях. Китайські рослинні препарати можуть скорочувати симптоматичну фазу у пацієнтів із звичайною застудою. Проте, через відсутність високоякісних клінічних випробувань автори були нездатні порекомендувати будь-який вид китайських рослинних препаратів для звичайної застуди.(1353)
Також для виявлення того, чи є часник (allium sativum) ефективним для профілактики або лікування звичайної застуди порівняно із плацебо, відсутністю лікування та іншими терапіями, було проведено Кокранівське дослідження. Існувало лише одне релевантне випробування, яке припускало, що часник може запобігати виникненню звичайної застуди, але автори рекомендували більше досліджень для оцінки цього результату. Ствердження щодо ефективності вірогідно спираються на низькоякісні докази (рекомендація С) (1356)
Коментар робочої групи: робоча група додатково опрацювала інформацію щодо наявності сучасних даних доказової медицини стосовно ефективності препаратів рослинного походження в лікування гострого риносинуситу. Інформація, не дозволяє робити висновки стосовно ефективності всієї групи рослинних лікарських засобів та відкриває широке поле для майбутніх наукових досліджень. Проте, ми вимушені констатувати, що необхідна достатня доказова база є лише у деяких фітопрепаратів. Тільки відносно них ми можемо скласти науково обґрунтовані рекомендації, тому сьогодні ми можемо рекомендувати для лікування ГРС лише ті рослинні препарати, які мають доказову базу єфективністі застосування, доведену в результаті якісних рандомізованих плацебоконтральованих досліджень. Використання фітопрепаратів з доведенною у клінічних дослідженнях ефективністю та безпечністю дозволяє уникнути поліпрагмазії, забезпечує високий терапевтичний ефекти і прийнятний комплаєнс.
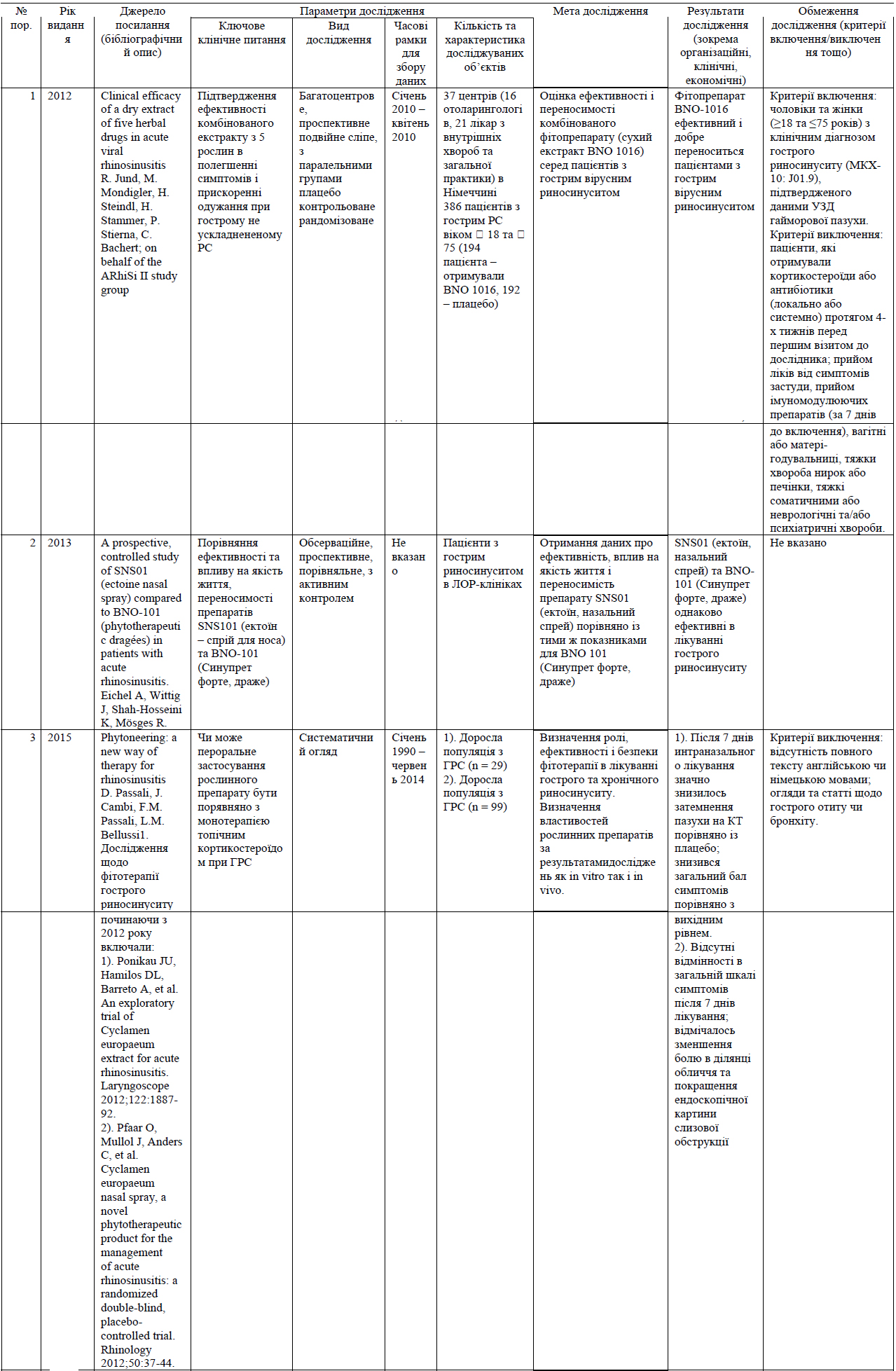
Таблиця 3.4.7. Лікування ГРС рослинними композиціями або гомеопатичними препаратами (подвійні сліпи плацебо-контрольовані дослідження)
Коментар робочої групи: станом на 26 березня 2015 року цинеол (АТС-код: Я05СА13) в Україні не зареєстрований
У рандомізованому подвійному сліпому дослідженні порівнювали натрію кромоглікат із плацебо (сольовий розчин) у вигляді назального спрею для контролю симптомів пост- катарального гіперреактивного риносинусит.(344) Приблизно у 50% пацієнтів кожної терапевтичної групи спостерігались поліпшення симптомів, але достовірної різниці між цими двома методами лікування носоглоткових симптомів, на ультразвуковому скануванні товщини слизової оболонки у гайморових пазухах або при оцінці симптомів риніту у пацієнтів (рівень доказовості Іb-) не було.
Коментар робочої групи: станом на 23 червня 2015 року в Україні не зареєстровано препаратів натрію кромоглікату (АТС-код: R01АС01) з показаннями до лікування гострого риносинуситу. Зареєстровані препарати натрію кромоглікату показані для лікування сезонного чи цілорічного алергічного риніту/
З ефективності ехінацеї було проведено 10 РКД, 5 з яких виявили, що ехінацея значно знижувала показники оцінки симптомів порівняно із плацебо, а 5 РКД не виявили достовірної різниці між групами. Слабкі місця дослідницьких методів та відміни у процедурах роблять складним формування висновків щодо ефективності (рекомендація С) (1365)
Стосовно інших терапій, таких як протигрибкові препарати, бактеріолізати, капса]цин, фуросемід, блокатори протонного насосу, посилений прийом рідини (1360) та антилейкотрієни, при ГРС обґрунтувань на підставі РКД або ПСПК досліджень немає.
Коментар робочої групи: станом на 06 квітня 2015 року капсаїцин (АТС-код: К01ВХ04) в Україні для застосування в отоларингології не зареєстрований.
Очні, внутрішньочерепні та кісткові ускладнення при ГРС трапляються рідко, але є потенційно серйозними клінічними явищами. Периорбітальні ускладнення включають пресептальну флегмону, флегмону очниці, субпериостальний та інтраорбітальний абсцес, їх швидке розпізнання та лікування (у тому числі антибіотиками внутрішньовенно та дренажем, залежно від ситуації) є життєво важливими для уникнення тривалих залишкових явищ. До внутрішньочерепних ускладнень відносяться епідуральний або субдуральний абсцес, абсцес головного мозку, менінгіт, енцефаліт та тромбоз верхнього сагітального та кавернозного синусу. Вони можуть проявлятись за допомогою неспецифічних ознак та симптомів, та їх діагностування потребує високого коефіцієнту підозри. Кісткові ускладнення викликає остеомієліт лицьового черепу, пов'язаний із прогресуванням запалення, вони можуть проявлятись у вигляді одутловатої пухлини Потта або фронтальної шкірної фістули.
Ще до появи антибіотиків ускладнення риносинуситу представляли собою поширені та небезпечні клінічні явища. Сьогодні, дякуючи більш надійним діагностичним методами (КТ, МРТ), покращеним хірургічним технікам та широкому спектру доступних антибіотиків, їх частота та пов'язаний із ними рівень смертності різко скоротились. Проте, у деяких випадках, якщо інфекція пазухи не лікується або лікується недостатньо, все ж можуть з'явитись ускладнення (232). Ускладнення риносинсуситу зазвичай визначають як очні, кісткові та внутрішньочерепні 2, хоча незвичайні ускладнення можуть виникати рідко (Таблиця 3.5.1).(398-402)
Частота виникнення ускладнень ГРС нараховує приблизно 3 на мільйон людей на рік та не зменшується призначенням антибіотиків
Епідеміологічні дані щодо ускладнень риносинуситу широко відрізняються, та відсутня узгодженість щодо точної поширеності різних типів ускладнень. Більш того, зв'язок між ГРС або ХРС та різноманітними ускладненнями у літературі чітко не позначено. У пацієнтів, госпіталізованих із синуситом, заявлений коефіцієнт ускладнень варіюється від 3.7% до 20%, хоча, якщо відбирати за тяжкими хворобами пазух, ця серія явно переоцінює частоту появи ускладнень. Ускладнення типово класифікують як очні (60-75%), внутрішньочерепні (15-20%) та кісткові (5-10%).(403) Загалом, хвороби пазух є передбачуваною причиною приблизно 10% внутрішньочерепного гнійного процесу/404, 405) також хвороби пазух пов'язане із від 10% (пресептальна флегмона) до 90% (флегмона очниці/субпериостальний абсцес/інтраорбітальний абсцес) периорбітальних інфекцій (406). Але, можливо, більш релевантним клінічно є частота виникнення ускладнень у пацієнтів із гострим риносинуситом та у населення, взагалі (Таблиця 3.5.1)
.У чотирьох дослідженнях було зібрано (зроблено спробу зібрати) національні або масштабні дані: Hansel та ін. (232) заявили про 48 ускладнень ГРС у 2004 р. у Нідерландах, що відповідає частоті появи ускладнень 3 на мільйон людей населення на рік (або приблизно 1 на 12 000 ГРС епізодів у дітей та 1 на 36 000 епізодів ГРС у дорослих). Аналогічні результати було виявлено в американському дослідженні (231), в якому було зафіксовано річну частоту виникнення внутрішньочерепних ускладнень у дітей з 2.7 до 4.3 на мільйон на рік. У французькому дослідженні із 12-мільйоною областю обслуговування було зафіксовано річну частоту виникнення ускладнень ГРС 2.5 на мільйон людей населення, за виключенням пацієнтів-дітей (414). Майже у всіх дослідженнях чоловіки були достовірно більше схильними, ніж жінки (231, 232, 412), а ГРС був провокуючим фактором частіше у дітей, ГРС із або без НП був таким фактором частіше у дорослих (411, 443). В усіх дослідженнях найбільш поширеними ускладненнями були очні, що удвічі більше внутрішньочерепних із кістковими, які були менш поширеними (232, 410, 411). Існувала сезонна модель ускладнень, що відображає частоту виникнення ІВДШ та є більш високою впродовж зимових місяців (231). У той час, як очні ускладнення виникають головним чином у малих дітей, внутрішньочерепні ускладнення можуть виникати у будь-якому віці із тенденцією до другого та третього десятку життя (232, 413). Важливо відмити, що і у голландському дослідженні (232), і у дослідженні Babar-Craig (52), яке спиралось на надісланих анкетах членів Британського ринологічного суспільства та, можливо, недооцінило частоту ускладнень, показали, що призначення антибіотиків при ГРС не запобігає виникненню ускладнень. Ці факти разом із ризиком резистентності до антибіотиків та маскування внутрішньочерепних ускладнень наполягають на виключенні стандартного застосування антибіотиків при ГРС.
Найбільш поширеними ускладненнями ГРС є очні, що є приблизно удвічі частішими, ніж внутрішньочерепні, наступними представлені кісткові проявлення.
Найбільш частими ускладненнями риносинсуситу є очні. Вони пов'язані, у порядку зменшення частоти виникнення, із пазухами гратчастої кістки, гайморовими, лобними та рідко клиновидними пазухами.(232, 410, 414-417) Поширення інфекції безпосередньо через тонку очноямкову пластинку,(416) або через вени(418) здійснюється з відносною легкістю. Важливо відмітити, що очні ускладнення у дітей можуть виникати без болю.(419)
Відповідно до класифікації Чандлера очні ускладнення можуть прогресувати за наступними стадіями .(403)
Хоча ця класифікація використовується найчастіше, вона не представляє деякі проблеми: повіка - це передня межа очниці, звідси «пресептальна флегмона» повинна відноситись до інфекції повік, а не очної інфекції, як пропонують Velasco e Cruz (420) та Voegels (421). Насправді, преспетальна флегмона нечасто пов'язана із синуситом та його клінічною картиною, її лікування та прогнозування відрізняються від усіх інших очних інфекцій (422). Очні ускладнення («постсептальна флегмона») проявляються у вигляді набряку, екзофтальму та пошкоджених, болючих рухів зовнішніх м'язів очного яблука із подвоєнням зору - всіх (окрім набряку) характеристик, що не виникають при преспетальній флегмоні та відрізняють її від дійсно очних ускладнень (423).
Окрім того, тромбоз кавернозної пазухи, як було запропоновано Mortimer вже в 1997 р. (411), є внутрішньочерепним ускладненням та необов'язково останньою стадією очної інфекції, хоча він частіше пов'язаний із інфекцією клиновидної пазухи (424), а не інфекцією пазухи гратчастої кістки або лобної пазухи, що є найбільш поширеними джерелами інфекцій при флегмоні очниці.
Периорбітальна флегмона або флегмона очниці можуть виникати в результаті прямого або судинного поширення інфекції пазухи. Оскільки інфекція пазухи через очницю поширюється згідно із чітко описаною схемою, первинними проявами є набряк та почервоніння шкіри центральних частин повіки. Поширення інфекції з гайморової або лобної пазухи проявляється у вигляді набряку нижньої або верхньої повіки, відповідно (425).
Необхідно обов 'язково звертатись за консультацією до офтальмолога, об 'єктивна оцінка проптозу (екзофтальмометр), очний тиск (тонометр), гострота зору, кольоровий зір та рухи ока завжди повинні бути чітко зафіксовані (411)
Пресептальна флегмона (запалення повіки та кон'юктиви) (426) поражає тканину, що знаходиться спереду очноямкової перегородки, та видна на знімках КТ у вигляді набряку м'якої тканини. Вона часто виникає як ускладнення інфекції верхніх дихальних шляхів, дакріоциститу або шкірної інфекції та рідше - синуситу (427-430) та проявляється у вигляді болю в очах, набряку повіки, почервоніння шкіри та (іноді) високої температури. Зазвичай пов'язаного із нею проптозу та обмеження руху ока немає, хоча встановити це може бути важко, особливо у малих дітей (432). Преспетальна флегмона зазвичай реагує на пероральний антибіотик, але якщо її не лікувати агресивно, вона може поширитись за межі очноямкової перегородки.(431) У більшості випадків пресептальна флегмона є клінічним діагнозом та не потребує КТ-сканування.(422)
На відміну від пресептальної перегородки, флегмона очниці, орбітальний абсцес та субпериостальний абсцес виникають частіше як ускладнення гострого риносинуситу (427, 429, 432). Оскільки запальні зміни поражають очницю, проптоз розвивається разом із деякими обмеженнями рухами ока, що вказує на флегмону очниці. Типовими ознаками є набряк кон'юктиву (хемоз), виступаюче очне яблуко (проптоз), біль та чутливість очей, а також обмежені та болючі рухи екстраокулярних м'язів.(411, 433, 434)
Це ускладнення вимагає агресивного лікування із введенням антибіотиків внутрішньовенно, а також виключення субпериостального або інтраорбітального абсцесу.
Будь-яка дитина із проптозем, обмеженим або болючим рухом очей (офтальмоплегія) або зниженою гостротою зору (початково проявляється у вигляді погіршення у розрізнянні зеленого/червоного кольорів) повинна пройти КТ-сканування із внутрішньовенним контрастом пазух з детальним обстеженням очей для диференціації флегмони очниці та інтраорбітального або субпериостального абсцесу. При підозрі на супутнє внутрішньочерепне ускладнення або у випадках невизначеності цінну додаткову інформацію може надати МРТ (435-437). Всі три стани (флегмона очниці, субпериостальний та інтраорбітальний абсцес) викликають проптоз та обмежений рух очей. Підтвердження абсцесу на КТ, прогресуючі пошкодження очей або порушення зору (особливо кольорового зору) після первинної терапії із застосуванням внутрішньовенних антибіотиків вказують на необхідність ревізії та дренування орбіти. Необхідно провести повторні обстеження гостроти зори, лікування внутрішньовенними антибіотиками може бути змінено на пероральне, якщо пацієнт не має високої температури впродовж 48 годин, а офтальмологічні симптоми та ознаки регресують .(438)
Таблиця 3.5.1. Епідеміологічні данні ускладнень при РС
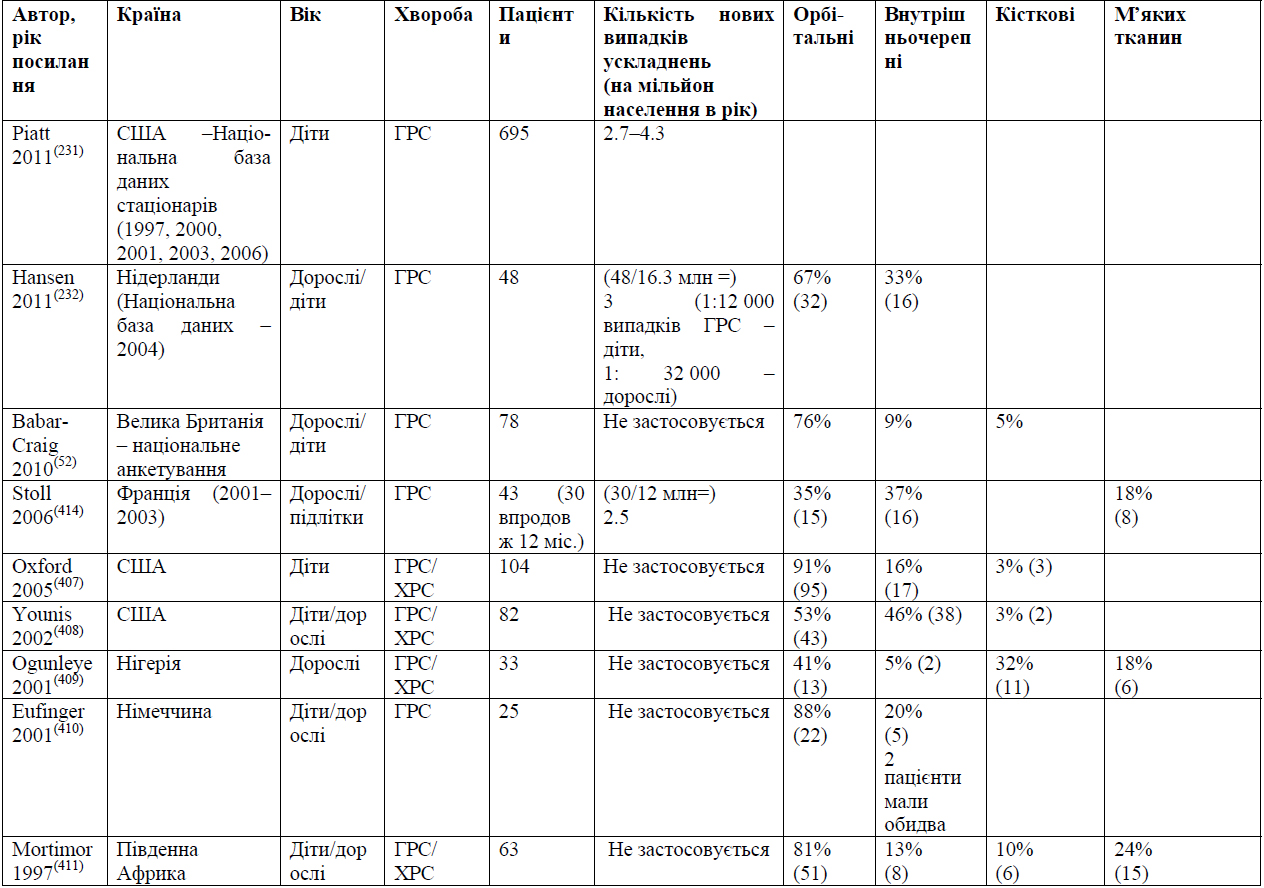
|
Автор, рік |
N |
Вік |
Тип ускладнення |
Лікування |
|
Huang 2011(415) |
64 |
Діти |
Підокісний / інтраорбітальний абсцес 56% (36) |
Тільки внутрішньовенна антибіотикотерапія: 53% (34) |
|
Georgakopoulos 2010(427) |
83 |
Діти |
Пресептальний целюліт 83% (69) |
Тільки медикаментозне: 95% (79) |
|
Siedek 2008(443) |
127 |
Діти/ |
Пресептальний целюліт 36% (46) |
Тільки медикаментозне: 51% (65) |
|
Eviatar 2008(436) |
52 |
Діти |
Пресептальний целюліт 92% (48) |
Медикаментозне: 98% (51) |
|
Mekhitarian 2007(417) |
25 |
Діти |
Пресептальний целюліт 96% (24) |
Медикаментозне: 92% (23) |
|
Oxford 2006(441) |
43 |
Діти |
Підокісний абсцес 100% (43) |
Медикаментозне: 42% (18) |
|
Mortimor 1997(411) |
51 |
Діти/дорослі |
Пресептальний целюліт 55% (28) |
Не вказано |
Субперіостальний абсцес формується між окістям орбіти та пазухами та розташованим за межами м'язів орбіти. Клінічними характеристиками субпериостального абсцесу є набряк, почервоніння шкіри, хемоз та проптоз повіки із обмеженням рухливості ока та, як наслідок, паралічем екстраокулярних м'язів, очне яблуко не рухається (офтальмоплегія), гострота зору слабшає. У більшості серій висока температура та лейкоцитоз, а також зсув лейкоцитарної формули вліво були міцно пов'язані із формуванням (субпериостального або інтраорбітального) абсцесу.(439)
Орбітальний абсцес є інтракональним (тобто знаходиться у межах області, обмеженої м'язами ока) та зазвичай є результатом занадто пізнього діагнозу або ураженням імунної системи людини пацієнта(440) із частотою виникнення 13%(416) - 8.3%(437) у педіатричних дослідженнях очних ускладнень.
У випадку очних ускладнень клінічні або рентгенологічні докази абсцесу або відсутність клінічного покращення через 24-48 годин прийому антибіотиків внутрішньовенно є індикаторами потреби у хірургічному обстеженні та дренажі, бажано ендоскопічному.
Обстеження. КТ-сканування пазух із сканами орбіти може допомогти розрізнити між флегмоною та орбітальним або субпериостальним абсцесом. У випадку субпериостального абсцесу КТ зазвичай показує набряк медіального прямого м'яза, латералізацію периорбіти та зміщення очного яблука до низу та вбік. Якщо КТ показує облітерацію частини зовнішнього очного м'яза та зорового нерва зливною масою, флегмона очниці переросла в інтраорбітальний абсцес, при якому іноді присутнє повітря через анаеробних бактерій. Була встановлена точність прогнозу клінічного діагнозу 82% та точність КТ 91%. У випадку невпевненості у діагнозі або підозри на внутрішньочерепні ускладнення може допомогти МРТ (408, 441, 442)
|
1. |
Докази підокісного або інтраорбітального абсцесу за даними КТ або МРТ (З потенційними винятками, що зазначено вище). |
|
2. |
Зниження гостроти зору/зменшення кольорового зору/порушення аферентного зіничного рефлексу або нездатність оцінити зір. |
|
3. |
Прогресування або відсутність покращення орбітальних ознак (диплопія, офтальмоплегія, екзофтальм, набряк, хемоз) після 48 годин лукуваня внутрішньовенними антибіотиками. |
|
4. |
Прогресування або відсутність покращення загальних симптомів (гарячка, інфекційні параметри) після 48 годин лукуваня внутрішньовенними антибіотиками. |
Ведення. Підтвердження абсцесу на КТ або відсутність клінічного покращення через 24-48 годин прийому антибіотиків внутрішньовенно є індикаторами потреби в обстеженні та дренажі очей (437). Офтальмолог повинен перевіряти гостроту зору, починаючи з ранніх стадій захворювання. Внутрішньовенна терапія антибіотиками повинна охоплювати аеробні та анаеробні патогени. Якщо у пацієнта немає гарячки впродовж 48 годин, терапія може бути змінена на пероральну (435). Згідно із сучасною домовленістю пресептальну флегмону та флегмону очниці потрібно лікувати антибіотиками, а субпериостальний та інтраорбітальний абсцес вимагає хірургічного обстеження (яке повинно включати не тільки дренаж абсцесу, а також навколоносових пазух) (439). У таких випадках домовились дренувати абсцес за допомогою ендоскопічних процедур, відкриваючи очноямкову пластинку та дренуючи абсцес після закінчення ендоскопічної етмоідектомії. При необхідності, також використовують зовнішні підходи до латерального та медіального орбітального абсцесу (Таблиця 3.5.3).
Проте, ряд нещодавніх досліджень демонструють добрі результати із застосуванням внутрішньовенних антибіотиків у маленьких дітей із субпериостальними абсцесами (432, 440, 443). У таких випадках та за умови:
Прогноз - подальше спостереження. Оклюзія центральної артерії сітківки, неврит зорового нерву, формування виразок на рогівці або панофтальміт можуть привести до сліпоти. Нерідко сепсис може поширитись усередину черепа та за передньою областю до очниці.(234)
Внутрішньочерепні ускладнення можуть проявлятись без специфічних симптомів та ознак (висока температура, головний біль, сонливість, послаблена свідомість) або у вигляді осередкових неврологічних ознак або підвищеного внутрішньочерепного тиску
До них входять епідуральний або субдуральний абсцес, абсцес головного мозку, менінгіт, енцефаліт та тромбоз верхньої сагітальної та кавернозної пазухи (231, 404, 312, 417, 435, 444)
Клінічні прояви цих ускладнень можуть бути неспецифічними та характеризуватись лише високою температурою із сильним хронічним головним болем або навіть проходити безсимптомно (411, 442). Проте, у більшості зазвичай проявляються більш специфічні ознаки та симптоми, що вказують на внутрішньочерепні пошкодження, такі як, нудота та блювота, ригідність потилиці та змінений психічний стан (234, 411, 412, 440, 445). Передвісниками внутрішньочерепних абсцесів часто є підвищений внутрішньочерепний тиск, подразнення мозкових оболонок та осередкові неврологічні розлади, у тому числі, паралічі третього, шостого або сьомого черепних нервів (411, 423, 440). Хоча внутрішньочерепний абсцес може бути відносно безсимптомним, часто виникають зміни в емоційному стані та поведінці, що вказує на змінену неврологічну функцію, змінений стан свідомості, нестабільну ходу та сильний прогресуючий головний біль.(431, 446)
Внутрішньочерепні ускладнення найчастіше пов'язані із риносинсутом лобної, грачастої або клиновидної пазухи.(412) Інфекції можуть поширюватись з навколоносових порожнин до внутрішньочерепних структур двома різними шляхами: патогени можуть проникати через диплоїчні вени до мозку; або ж вони можуть досягати внутрішньочерепних структур, роз'їдаючи кістки пазух, або гематологічно.(445)
Усі черепно-мозкові ускладнення починаються у вигляді енцефаліту, але із прогресуванням некрозу та розрідженням тканин головного мозку формується капсула, що приводить до абсцесу мозку. Дослідження виявляють високу наявність анаеробних організмів або змішаних аеробно-анаеробних організмів у пацієнтів із ускладненнями у ЦНС (Табл. 3.5.4).
Для встановлення діагнозу важливо використовувати КТ-сканування із контрастом, оскільки воно дозволяє точно визначити пошкодження кісток. Все більше використовується МРТ, завдяки її вищій чутливості, ніж у КТ (448), також вона більш корисна при тромбозі кавернозної пазухи,(412, 445) де МРТ може бути необхідною (450), або у випадках із пошкодженням м'якої тканини. Окрім того, при підозрі на менінгіт, може допомогти спиномозкова пункція,(445) але тільки після виключення абсцесу за допомогою методів візуалізації.
Для успішного лікування зазвичай вимагається високодозова тривала терапія із застосуванням внутрішньовенних антибіотиків із подальшим дренажем трепанаційного отвору, краніотомією або аспірацією під контролем засобів медичної візуалізації (451, 452). Комбінований дренаж навколоносових пазух (часто лобної пазухи) може виконуватись ендоскопічно (448), хоча він і не заміняє собою дренаж внутрішньочерепного абсцесу (447). Патогенами, що найчастіше беруть участь у патогенезі внутрішньочерепних ускладнень, є види та анаероби стрептококу та стафілококу (404, 451).
|
Автор, рік посилання |
Кількість |
Ускладнення |
Летальність / подальші наслідки |
|---|---|---|---|
|
Hansen 2011(232) |
16 |
9 субдуральна емпієма |
Летальність 19% Хворобливість 19% |
|
DelGaudio 2010(447) |
23 |
8 епідуральні |
Летальність 48% |
|
Bayonne 2009(412) |
25 |
епідуральні абсцеси |
Наслідки 16% |
|
Germiller 2006(448) |
25 (Середній вік 13 років) |
13 епідуральні абсцеси |
Хворобливість 8% |
|
Quraishi 2006(449) |
12 (середній вік |
2 абсцеси лобної частки |
Летальність 8 % |
|
Oxford 2005(407) |
18(середній вік 12 років) |
7 епідуральні абсцеси |
Летальність відсутня Хворобливість 11 % |
|
Younis 2002(408) |
39 |
7 епідуральні абсцеси |
Наслідки 10% |
При ураженні вен, що оточують навколоносові пазухи, подальше поширення може привести до тромбофлебіту кавернозного синуса, що викликає сепсис та множинні ураження черепних нервів.(431) За оцінками таке ускладнення нараховує 9% внутрішньочерепних ускладнень*-444, 445) та, на щастя, є рідкісним та вираженим ускладненням етмоїдального або сфеноїдального синуситу.(453)
До головних симптомів відносяться двостороннє опущення повік, екзофтальм, невралгія зорового нерва, ретро-окулярний головний біль із глибоким болем за очницею, повна офтальмоплегія, набряк зорового нерва та ознаки подразнення оболонок мозку, пов'язані із стрибками температури та прострацією.(425) За результатами загального аналізу крові можна побачити лейкоцитоз із нейтрофілією та поліморфоцитозом, а спиномозкова пункція може виявити неспецифічне подразнення оболонок мозку, посів крові допоможе культивувати шкідливий організм. (445)
В основі діагностики лежить МР флебограма, що вказує на відсутність венозного току в ураженій кавернозній пазусі. КТ з високою роздільністю із контрастом також може виявити дефект заповнення. Рівень смертності у дорослому населенні залишається 30%, а коефіцієнт хворобливості - 60%. Для дитячого населення, у якому рівень смертності через внутрішньочерепні ускладнення становить 10-20%, даних немає (454). Використання антикоагулянтів у цих пацієнтів залишається суперечливим,(425) але, можливо, призначається за умови, що методи візуалізації не показують ознак яких-небудь гемологічних змін у мозку.(455) ГКС можуть допомогти зменшити запалення та, імовірно, мають позитивний ефект при застосування разом із антибіотиками. Рекомендовано дренаж запаленої пазухи (майже завжди клиновидної).
Інфекція пазух також може поширитись на кістки, викликаючи остеомієліт та згодом уражуючи мозок та нервову систему. Навіть, якщо найчастіше внутрішньочерепне ураження є результатом фронтиту, будь-яка інфекція пазухи може привести до такого ускладнення (425). Найпоширенішими кістковими ускладненнями є остеомієліт верхньощелепової (зазвичай у немовлят) або лобової кісток (398).
Оскільки некроз судин викликається оститом лобної пазухи, остеомієліт передньої або задньої пластинки лобної пазухи є явним. На передній стінці він проявляється клінічно «рихлим» набряком шкіри над лобною кісткою, формуючи масу (набряклу пухлину Потта), при чому з задньої стінки ураження поширюється напряму або через тромбофлебіт безклапанних диплоїчних вен, викликаючи менінгіт, перидуральний абсцес або абсцес мозку.(425) Інфекція може поширюватися вперед через остеолізис передньої стінки.
У цьому контексті Gallaghere (445) вивчив карти 125 пацієнтів із ускладненим риносинуситом та виявив, що остеомієліт розвинувся приблизно у 9% випадках. Стінки пазухи були уражені у 32% пацієнтів, згідно із даними Ogunleye.(409) Lang у 2001 р. зафіксував 100 випадків субдурального набряку у дорослих та дітей, викликаного інфекцією лобної пазухи: серед них у чотирьох була набрякова пухлина Потта, а в одного периорбітальний абсцес.(456)
Ознаки та симптоми внутрішньочерепного ураження: набряк м'яких тканин (особливо верхньої повіки), сильна гарячка, сильний головний біль, подразнення оболонок мозку, кома та осередкові неврологічні ознаки. Очні ознаки можуть з'являтись на протилежних сторонах. КТ-сканування з контрастуванням підтверджує діагноз. Може бути корисною і спиномозкова пункція, хоча вона протипоказана при підвищеному внутрішньочерепному тиску.
До терапії входить поєднання застосування внутрішньовенних антибіотиків широкого спектру із хірургічним обробленням секвестрованої кістки та дренажем.(425)
|
Автор, рік |
Ускладнення |
|---|---|
|
Mirza 2001(398) |
Абсцес сльозної залози |
|
Park 2010(457) |
Орбітальна гематома |
|
Gradoni 2010(458) |
Абсцес носової перегородки |
|
Sibbery 1997(460) |
Перфорація носової перегородки |
|
Wu 2008(461) |
Лобно-шкірний свищ |
|
Laurens 2008(462) |
Остеомієліт схилу (англ. сііуш), параліч VI пари черепних нервів |
|
Righini 2009(463) |
Гострий ішемічний інсульт |
|
Rimal 2006(464) |
Септицемія |
Лікування ускладнень ГРС завжди є багатодисциплінарним – обов'язкова консультація офтальмолога у випадках ураження ока та невролога/нейрохірурга при внутрішньочерепних ускладненнях
Необхідно підкреслити, що деякі ускладнення можуть іноді виникати одночасно (наприклад, набряклі пухлини Потта та внутрішньочерепне поширення, очні та внутрішньочерепні ускладнення). Для моніторингу повної регресії хвороби та виключення рецидиву хвороби або будь-якого ускладнення після терапії рекомендується спостереження таких пацієнтів впродовж щонайменше 6 місяців.
ГРС у дітей є поширеним явищем, що зазвичай виникає у контексті вірусного захворювання верхніх дихальних шляхів. Багато спеціалістів згодні, що у дітей, у яких ця хвороба самостійно не виліковується та триває більше 7-10 днів, імовірна бактеріальна інфекція. Діагноз головним чином базується на анамнезі симптомів та їх тривалості, а також на результатах фізичного обстеження. У більшості випадків цей процес виліковується самостійно, але вважається, що антибіотикотерапія прискорює одужання. Чи цей ефект переважує ризики, пов'язані із частим призначенням антибіотиків - ще потрібно визначити. Інтраназальні ГКСможуть бути корисним доповненням до антибіотиків при лікуванні ГРС, та дуже небагато доказів вказують на те, що у дітей старшого віку вони можуть бути корисними як єдиний засіб при лікуванні. Допоміжна терапія у вигляді промивань, антигістамінів, деконгестантів або муколітиків довела свій ефект.
ГРС за етіологією найчастіше є вірусним та купірується самостіно.
Гострий риносинусит у дітей визначається як різка поява двох або більше симптомів (прозорі виділення з носа, закупорення/обструкція/застій у носі, кашель вдень та вночі) впродовж менш ніж 12 тижнів, оцінка може бути проведена за телефоном або за допомогою опитування. Якщо проблема є рецидивуючою, то можуть виникати безсимптомні інтервали.
Як і у дорослих звичайна застуда/вірусний ГРС визначається за тривалістю симптомів менш ніж 10 днів; поствірусний ГРС за погіршенням симптомів через 5 днів або збереження симптомів понад 10 днів; ГБРС імовірний, якщо присутні принаймні 3 симптоми/ознаки з наступних: прозорі виділення (переважно, односторонні) та гнійна секреція у носовій порожнині, сильний локальний біль (переважно, односторонній), гарячка (>38°С), підвищені ШОЕ/СРБ та друга хвиля (тобто погіршення після початкової більш легкої фази захворювання) (див. також главу 2).
Ні всі пазухи є розвинутими вже при народжені. Лобні пазухи не можливо відрізнити від передніх гратчастих клітин, вони ростуть повільно після народження так, що їх майже непомітно анатомічно у віці 1 рік. Через чотири роки лобні пазухи починають збільшуватись, їх зазвичай можна побачити приблизно у 20-30% дітей віком 6 років.(465) Їх розмір проводжує збільшуватись у старшому підлітковому віці, та у понад 85% дітей віком 12 років при КТ-скануванні можна відрізнити повітроносні лобні пазухи.(465) Згідно із оцінкою об'єму за допомогою обстеження тримірної реконструкції знімків КТ об'єм складає приблизно 2 мл у віці 10 років та досягає дорослого розміру приблизно у віці 19 років, при цьому середній об'єм після повного формування складає 3.46 мл.(466)
При народженні пазухи гратчастої кістки та гайморові пазухи - єдині пазухи, що є достатньо великими, щоб бути клінічно достовірною причиною риносинуситу. В одному дослідженні у понад 90% суб'єктів на рентгенограмі можна було побачити пазухи гратчастої кістки при народженні.(465) Пазухи гратчастої кістки різко збільшуються у розмірі до настання віку 7 років та припиняють свій ріст до віку 15-16 років, при чому середній об'єм після повного формування складає 4.51 мл.(466) Гайморові пазухи зазвичай повітроносні при народженні, їх об'єм у пацієнтів віком 2 роки складає приблизно 2 мл.(466) Пазуха росте швидко, досягаючи приблизно 10 мл в об'ємі десь у 9 років, а її об'єм після повного зростання до 15 років складає 14.8 мл. Більша частина росту після дванадцяти років напрямлена до нижньої частини із пневматизацією альвеолярного відростка після прорізання постійних зубів. До вступу у дорослий вік дно гайморової пазухи зазвичай на 4-5 мм нижче дна носової порожнини.
При народженні клиновидна пазуха є малою та дещо більшою за евагінацію клиновидно-гратчастого заглиблення. До 7 років клиновидна пазуха розширюється назад до рівня турецького сідла, у понад 85% пацієнтів у віці 8 років повітроносні клиновидні пазухи візуалізуються при КТ-скануванні.(465) Клиновидна пазуха робить стрибок у рості між 6 та 10 роками, її ріст припиняється до віку 15 років, при чому середній об'єм після повного формування складає 3.47 мл.(466) У старшому підлітковому віці більшість клиновидних пазух насичується повітрям до спинки сідла, у дорослих можуть відбуватись деякі додаткові збільшення.
Поставити клінічний діагноз ГРС у дітей важко через перемежування симптомів із іншими загальними дитячими хворобами носа, як, наприклад, вірусними інфекціями верхніх дихальних шляхів та алергічного риніту, а також через труднощі пов'язані із медичним обстежуванням. Симптоми часто невиражені, а анамнез обмежений лише спостереженнями та суб'єктивною оцінкою, наданою батьками дитини. Оскільки деякі діти молодшого віку можуть не переносити назальну ендоскопію, лікарі іноді скуті у засобах медичного огляду, тому, щоб поставити відповідний діагноз, їм доводиться спиратись на анамнез та/або обстеження за допомогою візуалізації.
До симптомів ГРС у дітей входить гарячка (50-60%), ринорея (71-80%), кашель (50-80%) та біль (29-33%).(8) У нещодавньому дослідженні 69 дітей віком від 3 до 12 років діагноз ГРС ставили за гнійними виділеннями з носа, що тривали понад 7 днів, та за патологічними результатами у гайморових пазухах на проекції Уотерса. У цих дітей симптомами, що викликали найбільший неспокій, були постназальний затік, назальна обструкція та кашель.(76) В анкетному дослідженні американських педіатрів загальної практики симптоми вважались дуже важливими при діагностуванні ГРС, у тому числі тривала наявність симптомів, гнійна ринорея та застій у носі. (230)
У дітей ГРС дуже часто проявляється серйозною хворобою верхніх дихальних шляхів із температурою >39°С, гнійною ринореєю та болем в ділянці лиця або, частіше, як тривала ІВДШ із хронічним кашлем та виділеннями з носа. У дослідженні зв'язку між симптомами гострої респіраторної інфекції та об'єктивними змінами у пазухах, що визначаються за допомогою МРТ, брали участь 60 дітей (середній вік = 5.7 років), які мали симптоми в середньому впродовж 6 днів до сканування.(467) Приблизно 60% дітей мали відхилення від норми у гайморових пазухах та пазухах гратчастої кістки, 35% - у клиновидній пазусі та 18 % - у лобній пазусі. У 26 дітей із значними відхиленнями додаткові МРТ-знімки, зроблені через 2 тижні, показали значне зменшення ступеню відхилень незалежно від регресії клінічних симптомів. Це дослідження підкріплює точку зору про те, що як і у дорослих кожна інфекція верхніх дихальних шляхів переважно є епізодом риносинуситу, де зазвичай вірусом уражаються навколоносові пазухи.
Лише небагато епізодів вірусного ГРС переростають у бактеріальний ГРС.
Незважаючи на відсутність ґрунтовних досліджень, більшість спеціалістів-практиків та дослідників погоджуються, що діагноз «бактеріальний ГРС» можна поставити після вірусного ІВДШ, якщо дитина має стійкі симптоми ІВДШ понад 10 днів без покращень (виділення з носа, денний кашель, що погіршується у ночі) або раптове погіршення симптомів після початкового покращення симптомів ІВДШ, або якщо ІВДШ здається більш тяжким, ніж звичайно (сильна гарячка, сильні гнійні виділення з носа, периорбитальний набряк та біль).(8, 96, 468)
У лонгітудінальному дослідженні за участю 112 дітей віком 6-35 місяців дослідники спостерігали 623 випадки ІВДШ впродовж 3-х років та фікусвали епізоди синуситу відповідно до вищезазначеного визначення.(31) Вісім відсотків випадків ІВДШ мали ускладнення у вигляді синуситу, при чому 29% епізодів діагностували через погіршення тяжкості симптомів до сплину 10 днів хвороби, а останні діагностували на підставі стійких симптомів, що тривали понад 10 днів. Випадки синуситу у контексті ІВДШ складали 7% у групі віком 6-11 місяців та у дітей старше 24 місяців та 10% у дітей віком 12-23 місяці. У більш давньому, але аналогічному, дослідженні збирався катамнез 159 доношених новонароджених впродовж 3-х років, та оцінювалась частота виникнення ІВДШ та ускладнень у вигляді синуситу.(469) Автори підрахували відсоток дітей, що мали симптоми за межами 2-х стандартних відхилень від середньої тривалості респіраторних симптомів, (у днях) та прийняли це за індикатор ГРС. Цей показник варіювався із віком та нараховував від 16 до 22 днів. Частота виникнення згідно із цими припущеннями складала від 4 до 7.3% та була найвищою у дітей впродовж першого року життя та тих, що відвідували дитячий садок. У середньому, дитина молодше 5 років має від 2 до 7 епізодів ІВДШ на рік,(470, 471) а дитина, що відвідує дитячий садок, може мати до 14 епізодів на рік.(472) Із захворюваністю, зазначеною вище, кількість епізодів гострого синуситу у дітей щороку є значною.
Диференціація ГРС та ХРС базується на тривалості хвороби як у дітей, так і дорослих. ГРС визначається за симптомами, що тривають менше 12 тижнів із повною регресією симптомів. Симптоми, що тривають 12 тижнів або більше без повної їх регресії є характерними для ХРС. Дуже поширеним клінічним сценарієм у дітей, що звертаються до отоларинголога, є ХРС із загостреннями, викликаними інфекцією верхніх дихальних шляхів.
Якщо у дитини проявляються перераховані вище симптоми ГРС, диференційний діагноз повинен включати стороннє тіло у носі та однобічний стеноз хоани. У цих випадках симптоми зазвичай односторонні та можуть бути відносно легко диференційовані клінічно від ГРС за анамнезом та за допомогою медичного огляду, у тому числі ендоскопією носа. Серед клінічних проявів АР зазвичай немає гнійних виділень. Аденоїдит може мати аналогічні клінічні прояви, у тому числі передні та задні гнійні виділення та кашель, та є дуже суттєвим при встановленні диференційного діагнозу у групі дитячого віку. У дослідженні розміру аденоїдів за допомогою МРТ у групі пацієнтів без симптомів, пов'язаних із аденоїдами або хворобами аденоїдів, розмір аденоїдів був збільшеним у групі дитячого віку та зменшувався у старшому віці.(473) Піковий розмір спостерігався у віці від 7 до 10 років, а найбільші розміри були у групі віком 4-15 років. Щоб диференціювати аденоїди та ГРС на підставі результатів ендоскопічного обстеження, Marseglia та колеги провели міжгрупове дослідження за участю 287 дітей, відібраних у порядку їх звернення до лікаря, із підозрою на ГРС на підставі симптомів, що тривають понад 10 днів (270). Проводили ендоскопію носа, діагноз ГРС ставили при виявленні гнійних виділень в остіомеатальній або сфеноетмоїдальній областях, а діагноз аденоїдиту ставили при наявності гнійних виділень над аденоїдами. Згідно із цими критеріями риносинусит підтверджували у 89.2% пацієнтів, він був ізольованим у 80.8% та супроводжувався аденоїдитом у 19.2%. Тільки аденоїдит підтвердили у 7% контингенту. Одночасне ураження пазух та аденоїдів зустрічалось частіше у пацієнтів молодшого віку (групі віком 2-5 років), при чому ізольований риносинусит був поширенішим у дітей старшого віку. Хоча це дослідження можна піддати критиці за тим, як був поставлений діагноз, оскільки можна очікувати, що виділення з пазух будуть уражати аденоїди, оскільки вони рухаються по задній стінці з носа, та через відсутність більш об'єктивних засобів діагностики риносинуситу, таких як КТ-сканування, дані підтверджують високий ступінь сумісної появи інфекції аденоїдів та навколоносових пазух у вищеописаному клінічному контексті. Також очевидно, що на підставі лише клінічних проявів диференціація між аденоїдитом та ГРС є дуже складною.
Wald та ін. вивчали бактеріологію ГРС у 1981 р.(474) Вони взяли посіви у дітей із затемненням гайморових пазух, зафіксованих на рентгенограмі в проекції Уотера, за допомогою аспірації рідини з пазух та виявили, що найпоширенішими організмами, виділеними з аспіратів гайморових пазух цих дітей, були S. pneumoniae, H. influenzae та M. catarrhalis. Кілька досліджень, проведених з того часу, підтвердили, що найбільш поширеними організмами, що відповідають за бактеріальний ГРС у дітей, є S. pneumoniae, H. influenzae, M. catarrhalis, S. pyogenes та анаероби.(8) На відміну від частоти звертань до лікарні при гострому середньому отиті у дітей молодше 18 років, яка знизилась з 1998 до 2007 рр. після введення семивалентної пневмококової кон'югатної вакцини у Сполучених Штатах, частота звертань до лікарні при ГРС залишалась стабільною - 11-14 візитів на 1000 дітей.(475) У пізнішому дослідженні Hwang та ін. виконали ретроспективний огляд всіх пацієнтів-дітей, що вимагали втручання при ГРС, за семирічний період.(476) Вони заявили, що замість звичайної бактерії, основним патогеном у посівах з пазух була S. viridans. Brook та ін. також виявили анаеробну бактерію при гострих інфекціях, проте, ці організми найчастіше спостерігаються при верхньощелепному ХРС через одонтогенні причини. Найпоширенішими анаеробними бактеріями були грам-негативні бацили, такі як Peptostreptococcus та Fusobacterium.(477, 478)
Після отримання детального медичного та сімейного анамнезу потрібно провести повний медичний огляд. Обстеження носа у дітей повинно починатись із передньої риноскопії для вивчення середнього ходу, нижніх носових раковин, характеру слизової оболонки та наявності гнійних виділень. Це зазвичай легко здійснюється за допомогою найбільшого дзеркала отоскопа або із налобним ліхтарем та носовим дзеркалом. Для покращення візуалізації може застосовуватись локальне зняття набряку. Назальна ендоскопія, яка забезпечує кращу візуалізацію середнього ходу, ложа аденоїдів та носоглотки наполегливо рекомендується у дітей, які можуть винести таке обстеження. При обстеженні ротової порожнини можна виявити постназальні гнійні виділення, «булижний» характер стінки глотки або гіпертрофію мигдаликів.
Взяття посіву зазвичай не є обов'язковим у контексті ГРС без ускладнень. Посів може бути корисним у пацієнтів, що не реагують на традиційне медичне лікування впродовж 48-72 годин, у пацієнтів із пошкодженим імунітетом, при наявності ускладнень та якщо дитина страждає від тяжкої хвороби або проявляє симптоми інтоксикації/8, 479) Хоча золотим стандартом є аспірація рідини з гайморових пазух, це відносно інвазивна процедура, яку важко застосувати до дитини у кабінеті. Було виявлено, що культури із середнього ходу при ендоскопічній візуалізації можуть мати зв'язок із антральним посівом. Стосовно дітей дані про користь цього підходу обмежені, головним чином базуються на дослідженнях ХРС та будуть описані у відповідній главі.
Хоча діагноз ГРС у дітей зазвичай роблять на клінічних підставах, з методів візуалізації у цьому випадку підходить комп'ютерна томографія (КТ).(279)
Рекомендації Американської академії педіатрів, опубліковані у 2001 р., зазначають, що КТ слід застосовувати до пацієнтів, у яких симптоми не проходять через 10 днів належної терапії, та до пацієнтів, у яких є підозра на ускладнення (особливо у мозку та очах) (96). У дітей із клінічним діагнозом «риносинусит» найчастіше уражується гайморова пазуха (99%), на другому місці - пазуха гратчастої кістки (91%).(480) При наявності підозр на ускладнення при риносинуситі необхідно виконати МРТ пазух, очниць та мозку.
|
Автор, посилання |
Втручання/діагноз |
Результат |
Час до настання результату |
Рівень доказовості |
|---|---|---|---|---|
|
Wald 2009(351) |
Амоксицилін/ клавуланова кислота порівняно з плацебо при ГРС |
Значно вища частота одужання при антибіотикотерапії (50%) порівняно з плацебо (14%) (р=0.01) |
Швидке розрішення на тлі антибіотикотерапії (2.26 днів) порівняно з плацебо (2.6 днів) |
Ib |
|
Falagas 2008(345) |
Антибіотикі порівняно з плацебо при ГБРС (мета-аналіз) |
Помірно краща швидкість одужання (покращення) при антибіотикотерапії впродовж 7-15 днів |
Швидке розрішення на тлі антибіотикотерапії порівняно з плацебо |
Ia |
|
Poachanukoon 2008(481) |
Цефдиторен порівняно з амоксицилін/ клавуланова кислота при ГРС |
Порівнянні темпи поліпшення для цефдиторену (78.8%) та амоксицилін/ клавуланова кислота (84.7%) |
Час покращення склав 3 дні в обох групах |
Ib |
Більшість епізодів ГРС виліковуються самостійно та регресують спонтанно
Антибіотики є найпоширенішими лікарськими засобами при ГРС (Таблиця 3.6.1.). У недавньому мета-аналізі рандомізованих контрольованих випробувань розглядались опубліковані дослідження на дітях та дорослих з оцінки лікування ГРС антибіотиками, в яких 3 з 17 досліджень, що пройшли оцінку, виконувались у групі дитячого віку (345). Загалом 3 291 амбулаторних пацієнтів (2 915 дорослих та 376 дітей) проходили лікування у дослідженнях, включених до мета-аналізу. Діагноз ГРС у більшості досліджень базувався на клінічних критеріях; на рентгенологічних та інших лабораторних критеріях в інших випадках. У більшості досліджень включення пацієнтів із вірусними інфекціями верхніх дихальних шляхів не проводилось, участь брали пацієнти, симптоми яких тривали понад 7-10 днів. Результати вказують на те, що, порівняно із плацебо, антибіотики були пов'язані із вищими показниками одужання або покращення впродовж 7-15 днів, при чому швидкість регресії симптомів була вищою при антибіотикотерапії у більшості рандомізованих контрольованих випробуваннях. Загальний позитивний результат на користь антибіотиків був достовірним, але обмеженим. Коли аналіз у підгрупах виконувався за віком, різниці в показниках одужання не було. У новішому рандомізованому, плацебо контрольованому випробуванні, не включеному до мета-аналізу, оцінювали ефективність амоксициліну (90 мг/кг) із клавуланатом калію (6.4 мг/кг) або плацебо у дітей віком 1-10 років, що мали клінічні проявлення бактеріального ГРС (стійкі симптоми, синдроми, що гостро погіршуються, або із тяжкими симптомами).(351) Бали оцінки симптомів встановлювали у кількох моментах часу, дітей оглядали на 14 день після початку лікування, їх стан оцінювали як «одужання», «поліпшення» або «невдача». Дослідження пройшли двадцять вісім пацієнтів з кожної групи, їх середній вік складав близько 5 років. Діти, що отримували антибіотики були більш схильними до одужання (50% порівняно із 14%, р=0.01) та менш схильними до невдалого лікування (14% порівняно із 68%, р<0.001), ніж у дітей, що отримували плацебо. Як і в інших дослідженнях у групі, яка отримувала антибіотики, побічних ефектів було більше, ніж у групі плацебо (44% порівняно із 14% дітей, р=0.014). В іншому рандомізованому, контрольованому дослідженні на пацієнтах віком 1-15 років із клінічними та рентгенографічними ознаками та симптомами ГРС пацієнти отримували або цефалоспорин (цефдиторен 8-12 мг/кг щоденно) або амоксицилін/клавуланат (80-90 мг/кг амоксициліну щоденно) впродовж 14 днів (481). Результати показують порівняльні, але статистично різні показники покращення через 14 днів: 78.8% для цефдиторену та 84.7% для амоксициліну/клавуланату. Середній час до поліпшення стану складав 3 дні в обох групах, а частота випадків діареї була достовірно вищою у пацієнтів, які отримували амоксицилін/клавуланат (18%), порівняно до пацієнтів, які отримували цефдиторен (4.5%).
Більшість цих досліджень можна піддати критиці за потенційне включення пацієнтів із існуючими вірусними ІВДШ та обрання пацієнтів тільки на підставі клінічних симптомів та огляду без рентгенологічного підтвердження. Результати, проте, вказують на те, що у більшості випадків гострого синуситу без ускладнень поліпшення наступають незалежно від застосованого лікування, але вони наступають швидше із більш високими шансами для поліпшення при застосуванні антибіотиків. На підставі доказів розумним буде рекомендувати тільки симптоматичне лікування епізодів ГРС у дітей без ускладнень. Лікування антибіотиками слід застосовувати до дітей із ускладненнями або супутньою хворобою, яка може бути погіршена ГРС (астма, хронічний бронхіт). У деяких ситуаціях дітям із гнійною ринореєю забороняється залишатись у дитячому садку, що, таким чином, складає проблеми для батьків, які працюють. Чи переважує прискорення поліпшення симптомів антибіотиками у цих дітей підвищений ризик виникнення резистентності до протимікробних препаратів, ще не визначено. (Ступінь переконливості рекомендації: А).
Вважається, що лікування антибіотиками прискорює одужання дітей із ГРС, але чи переважує прискорення поліпшення симптомів у цих дітей підвищений ризик виникнення ризику резистентності до протимікробних препаратів, ще не визначено.
Розглядаючи варіанти антибіотиків, треба пам'ятати, що лише дитина із ГРС без ускладнень, яка не отримувала кілька курсів антибіотиків до того, може отримувати лікування амоксициліном (40 мг/кг/день або 80 мг/кг/день). Іншими розумними та безпечними варіантами є амоксицилін/клавуланат та цефалоспорини, вони охоплюють широкий спектр типових мікроорганізмів, особливо організмів, що виробляють Р-лактамазу.(8) При підозрі на гіперчутливість до будь-якого з вищеперерахованих протимікробних препаратів альтернативні варіанти включають триметопрім/ сульфаметоксазол, азитроміцин або кларитроміцин. Кліндаміцин є корисним при підозрі на наявність анаеробних організмів, але не охоплює грам-негативні організми.
Інтраназальні ГКС можуть мати позитивний допоміжний ефект при лікування ГРС.
У педіатричних дослідженнях за участю 89 дітей із ГРС отримували амоксицилін- клавуланат та у довільному порядку отримували назальні спреї або з будесонідом, або з плацебо впродовж 3 тижнів (307). У показниках стосовно кашлю та виділень з носа на кінець другого тижня у групі, що отримувала ГКС спостерігались достовірні поліпшення порівняно із групою плацебо, що вказує на користь додавання інтраназальних ГКС до антибіотиків при лікуванні ГРС. Кілька випробувань на змішаному (дорослому та дитячому) населенні (зазвичай 12-14 років та старше) показали аналогічну користь застосування інтраназальних ГКС разом із антибіотиками для лікування ГРС.(306, 482) Тому існують обґрунтовані докази на користь додавання інтраназальних ГКС до антибіотиків при лікуванні ГРС (рівень доказовості рекомендації: А). Нарешті, у рандомізованому, плацебо контрольованому досліджені за участю пацієнтів старше 12 років із ГРС мометазон 200 мкг двічі на добу (у два рази більше дози при алергічному риніті) більш ефективно контролював симптоми, ніж плацебо та амоксицилін.(310) Таким чином, існують деякі докази, що висока доза інтраназальних ГКС у дітей старшого віку може бути більш ефективною як монотерапія при ГРС. Проте, поширення цих висновків на дітей молодшого віку не обґрунтоване за відсутністю додаткових досліджень.
| Автор | Втручання/діагноз | Результат | Вікова група | Рівень доказовості |
|---|---|---|---|---|
| Shaikh 2010(328) | Деконгестанти, антигістамінні препарати і носові зрошення. Систематичний оглядпри ГРС | Не добре проведенне дослідження для вирішення питання єфективністі цього лікування | Діти (<18 років) | Ia (-) |
| Unuvar 2010(335) | Ердостеїн порівняно з плацебо | Немає суттєвої різниці між двома групами | Діти (8.5±3.2 років) | Ib (-) |
| Barlan 1997(307) | Амоксицилін/клавуланова кислота з Будесонідом або плацебо | Значне покращення при кашлі та виділенняз з носа на кінець другого тижня в групі ГКС (р<0.05) | Діти (будесонід: 7.3±3.4 років; амоксицилін/клавуланова кислота: 6.6 ±2.9 років) | Ib |
(-) – докази досліджень з негативним результатом
Допоміжні терапії не довели свою ефективність при ГРС.
Для оцінки ефективності деконгестантів (пероральних або інтраназальних), антигістамінів та промивання носа у дітей із клінічним діагнозом «гострий синусит» було проведено систематичний огляд літератури.(328) До нього входили рандомізовані контрольовані випробування (РКТ) або квазі-РКТ, що оцінювали дітей віком 0-18 років із ГРС, встановленого через 10-30 днів ринореї, застою або денного кашлю. З 402 вивчених статей було знайдено 44, що були виключені через невідповідність критеріям. Автори дійшли висновку, що обґрунтувань для визначення, чи є ефективним застосування зазначених вище засобів для дітей із ГРС, не існує. У новішій публікації у рандомізованому, плацебо контрольованому випробуванні вивчали ердостеїн - муколітичний засіб.(335) Це дослідження пройшов 81 пацієнт; їх середній вік складав 8.5 років; всі вони мали симптоми, характерні для ГРС. Їх рандомізували на групи, що отримували ердостеїн або плацебо впродовж 14 днів; симптоми фіксувалися. Обидві терапевтичні групи мали поліпшення симптомів на 14 день, але між активною групою та групою плацебо статистично достовірної різниці не було. Тому у підтримку застосування допоміжної терапії при лікуванні ГРС у дітей (Таблиця 3.6.2.) надійних доказів немає (Рівень переконливості рекомендації: А-, негативний).
Інформація, опублікована на даному сайті, орієнтована на загальне ознайомлення та жодним чином не може бути використана в якості медичних, практичних або комерційних рекомендацій. У зв’язку з цим, Сайт «Школи доказової медицини» не несе жодної відповідальності за негативні наслідки, отримані через використання матеріалів, викладених на даному сайті. Документація з фармацевтичних продуктів не є рекламою та не призначена для того, щоб використовувати її замість консультації з кваліфікованими фахівцями в галузі медицини та інших галузях. Документація з фармацевтичних продуктів надається за вашою згодою відповідно до вимог ч.ч. 1, 2 ст. 15 Закону України «Про захист прав споживачів» від 12.05.1991 р. № 1023-XII. Якщо вам потрібна консультація з конкретного питання, пов’язаного зі здоров’ям, необхідно звернутися до фахівців- професіоналів.
Продовжуючи своє перебування на сайті, ви підтверджуєте свою згоду на дистанційне отримання інформації про лікарські та косметичні засоби (включаючи інформацію про рецептурні лікарські засоби) на підставі вимог ч.ч. 1, 2 ст. 15 Закону України «Про захист прав споживачів» від 12.05.1991 р. № 1023-XII.
Уся інформація, яка міститься на даному сайті, подана з освітньою метою виключно для медичних та фармацевтичних працівників і не замінює консультації лікаря.