Медичним працівникам, які прагнуть отримати інформацію про ситуацію з захворюваністю на грип, слід звертатися до місцевих департаментів охорони здоров'я. Більш детальну інформацію щодо ситуації з захворюваністю на грип на території Сполучених Штатів можно отримати за посиланням .
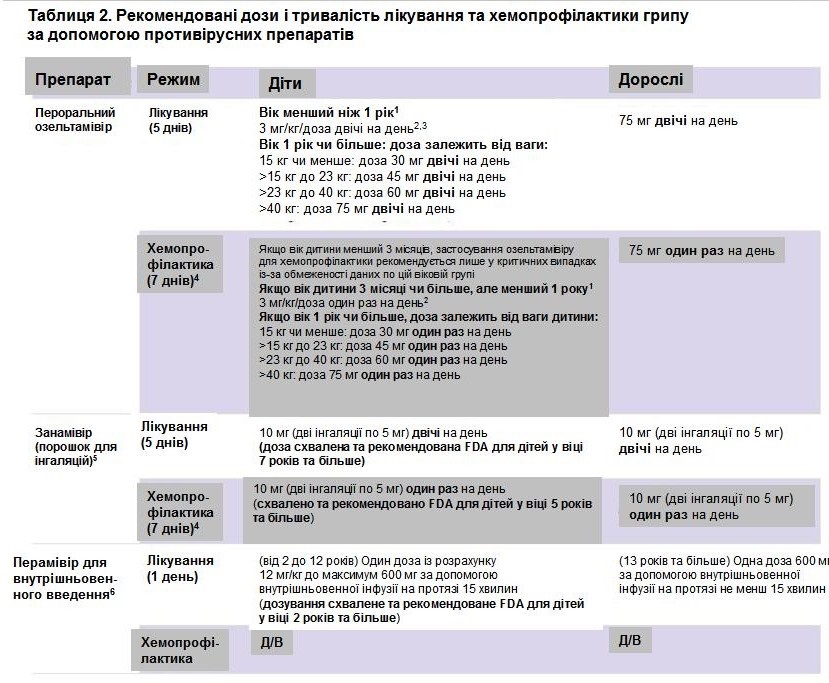
Абревіатури: Д/В = дані відсутні
1Озельтамівір для перорального застосування схвалений FDA для лікування грипу з гострим перебігом без ускладнень на протязі перших 2 днів хвороби у пацієнтів у віці 14 днів і більше, а також для хемопрофілактики грипу у осіб у віці 1 рік і більше. Крім того, згідно з рекомендаціями Центрів з контролю та профілактики захворювань США (CDC) та Американської асоціації педіатрів (American Academy of Pediatrics) дозволяється лікування грипу за допомогою перорального озельтамівіру у немовлят у віці менш ніж 14 днів та для хемопрофілактики грипу у дітей у віці від 3-х місяців до 1 року – хоча таке застосування озельтамівіру є поза межами реєстрації FDA (Комітет з інфекційних хвороб, 2017).
2Це дозування для пероральної терапії озельтамівіром у дітей у віці 14 днів і більше а також у віці до 1 року. Такі дози забезпечують педіатричним пацієнтам експозицію по препарату, аналогічну тій, яку дорослим хворим забезпечує доза в 75 мг двічі на день. Таку аналогію було підтверджено авторами двох клінічних досліджень, присвячених фармакокінетиці озельтамівіру у дітей (Kimberlin, 2013 [CASG 114], EU study WP22849, FDA Clinical Pharmacology Review). Американська асоціація педіатрів рекомендує застосовувати озельтамівір при лікуванні дітей у віці 9-11 місяців у дозі 3,5 мг/кг двічі на день. Ця рекомендація базується на даних, які свідчать, що для досягнення необхідної експозиції по цьому препаратові у відповідності з протоколом лікування необхідно застосовувати підвищену дозу в 3,5 мг/кг. Це було визначено в ході дослідження CASG 114 study (Kimberlin, 2013). Невідомо, чи така підвищена доза здатна забезпечити покращення результатів лікування а також запобігти розвитку резистентності до терапії. З іншого боку, не існує даних, які б свідчили про те, що доза в 3,5 мг/кг є шкідливою чи здатна викликати більшу кількість побічних ефектів у дітей із цієї вікової групи.
3Існуючі рекомендації стосовно доз препаратів у відповідності до маси тіла пацієнтів непридатні для застосування у недоношених дітей. У таких дітей метаболізм озельтамівіру може сповільнюватися з-за недорозвинутої функції нирок. У результаті застосування доз озельтамівіру, рекомендованих для доношених дітей, для лікування недоношених пацієнтів дитячого віку може стати причиною дуже високих концентрацій препарату у крові хворих із цієї вікової групи. Згідно з рекомендаціями Центрів з контролю та профілактики захворювань США (CDC) та Американської асоціації педіатрів (American Academy of Pediatrics) для розрахунку дози при лікуванні недоношених дітей слід використовувати показники їх постменструального віку (гестаційний вік + хронологічний вік): 1,0 мг/кг/доза перорально двічі на день для дітей, чий постменструальний вік < 38 тижнів; 1,5мг/кг/доза перорально, двічі на день для тих дітей, чий постменструальний вік складає 38-40 тижнів; 3,0 мг/кг/доза перорально двічі на день для дітей, чий постменструальний вік > 40 тижнів.
4Див. розділ «Особливості профілактики грипу у соціальних закладах», що знаходиться нижче. В розділі представлені рекомендації відносно термінів хемопрофілактики у разі спалахів грипу у соціальних закладах (будинки-інтернати для осіб похилого віку, лікувальні заклади для хронічних хворих і т. п.).
5Занамівір (порошок для інгаляцій) схвалений FDA для лікування грипу з гострим перебігом без ускладнень на протязі перших 2 днів хвороби у пацієнтів у віці 7 років і більше, а також для хемопрофілактики грипу у осіб у віці 5 років і більше.
6Перамівір для внутрішньовенного введення схвалений FDA для лікування грипу з гострим перебігом без ускладнень на протязі перших 2 днів хвороби у пацієнтів у віці 2 роки і більше. Перамівір у такій добовій дозі на протязі 5 днів застосовувався під час клінічних досліджень за участю пацієнтів з грипом, госпіталізованих у стаціонар (de Jong, 2014, Ison, 2014).
Інформація, опублікована на даному сайті, орієнтована на загальне ознайомлення та жодним чином не може бути використана в якості медичних, практичних або комерційних рекомендацій. У зв’язку з цим, Сайт «Школи доказової медицини» не несе жодної відповідальності за негативні наслідки, отримані через використання матеріалів, викладених на даному сайті. Документація з фармацевтичних продуктів не є рекламою та не призначена для того, щоб використовувати її замість консультації з кваліфікованими фахівцями в галузі медицини та інших галузях. Документація з фармацевтичних продуктів надається за вашою згодою відповідно до вимог ч.ч. 1, 2 ст. 15 Закону України «Про захист прав споживачів» від 12.05.1991 р. № 1023-XII. Якщо вам потрібна консультація з конкретного питання, пов’язаного зі здоров’ям, необхідно звернутися до фахівців- професіоналів.
Продовжуючи своє перебування на сайті, ви підтверджуєте свою згоду на дистанційне отримання інформації про лікарські та косметичні засоби (включаючи інформацію про рецептурні лікарські засоби) на підставі вимог ч.ч. 1, 2 ст. 15 Закону України «Про захист прав споживачів» від 12.05.1991 р. № 1023-XII.
Уся інформація, яка міститься на даному сайті, подана з освітньою метою виключно для медичних та фармацевтичних працівників і не замінює консультації лікаря.