Антигістамінні препарати (АГП), за деяким винятком, швидко і повністю абсорбуються після перорального застосування, досягаючи пікової концентрації в плазмі за 1-4 години. метаболізму та споживання препарату тканинами.
Класифікація відомого фармакологічного класу передбачає поділ ЛЗ щодо їх дії. У випадку Н1-антагоністів багато препаратів, що відносяться до II покоління АГП, зарекомендували себе як ефективні при лікуванні алергічних захворювань. У зв'язку з тим, що ці препарати використовують для лікування не загрожують життю захворювань, таких як алергічний риніт, визначення співвідношення користь/ризик є дуже важливим [1, 2]. Таким чином, прогрес у даному класі ЛЗ повинен включати не лише збільшення ефективності, а й покращення профілю безпеки та специфічності.
Більшість ЛЗ, доступних нині, надмірно розподіляються за всіма органами людського тіла. Це відбувається тому, що ЛЗ жиророзчинні і не іонізуються, відповідно, переходять у тканини завдяки пасивній дифузії після прийняття внутрішньо.
Жиророзчинність не впливає на селективність переміщення в органи, а лише дозволяє відбуватися пасивної дифузії через будь-яку клітинну мембрану. І, нарешті, розподіл ЛЗ часто більш виражено, ніж це необхідно для терапевтичного ефекту з огляду на потенційну втрату значної частини активності. Це особливо справедливо для Н1-антагоністів, які метаболізуються у печінці. Очевидно, що оптимальний розподіл – це мінімальний розподіл, що забезпечує кількість ЛЗ, необхідну для ефективного досягнення певних рецепторів, за умови уникнення тих органів, в яких ЛЗ неефективне або токсичне.
ОР можна визначити як низький, коли він менший, ніж об'єм води в організмі, яка вільно та швидко циркулює між міжклітинною рідиною (МР) та цитозолем (рис. 1). За допомогою проби з антипірином встановлено, що об'єм води, що циркулює, становить 0,6 л/кг [3]. Циркулююча вода в організмі включає об'єм плазми, МР та рідини, що знаходиться в стані рівноваги між МР і цитозолем.
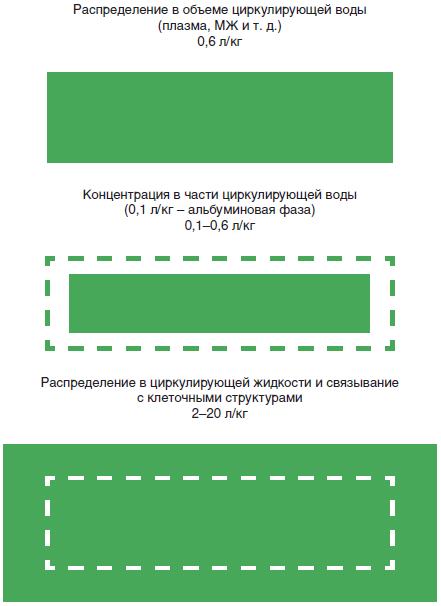
Рис. 1. Схематичне зображення можливих ОР ЛЗ
У разі, коли ОР нижче, ніж обсяг циркулюючої води в організмі, ЛЗ не може розподілитися рівномірно і, як наслідок, накопичується в одному з її компонентів. Змішування вільних та пов'язаних форм ЛЗ веде до часткового обмеження розподілу ЛЗ (VD=0,6–0,1 л/кг). Коли ЛЗ практично повністю пов'язані з білками плазми, ОР залежить від пов'язаних протеїнів і становить 0,1 л/кг. І навпаки, при ОР вище, ніж 0,6 л/кг, ЛЗ не тільки не зможе дифундувати в рідину, що циркулює, а й зв'язатися з клітинними структурами. Низький ОР є кращим для Н1-антагоністів, оскільки оптимізує розподіл ЛЗ по рецепторам-мішенях, а також мінімізує можливість проходження ЛЗ через гематоенцефалічний бар'єр (ГЕБ).
У людини 40% загальної кількості Н1-рецепторів міститься в головному мозку [5]. В ідеалі Н1-антагоніст не повинен взаємодіяти з цими рецепторами, а отже, не повинен проходити через гематоенцефалічний бар'єр. Відомо, що ЛЗ із порівняно високою жиророзчинністю легко проникають через гематоенцефалічний бар'єр за допомогою пасивного транспорту. Очевидно, що необхідно запобігти взаємодії АГП із рецепторами головного мозку. Повністю запобігти контакту ЛЗ з рецепторами головного мозку неможливо, особливо для тих клітин, які знаходяться в безпосередній близькості до ендотеліальних клітин, проте проникність ГЕБ для АГП може бути суттєво знижена [6].
Ті ж положення стосуються і серцевих рецепторів, оскільки неможливо запобігти контакту цього органу з кров'ю, можна лише зменшити проникнення ЛЗ у певних дозах. Н1-рецептори розташовані на зовнішній поверхні клітинних мембран, які знаходяться в безпосередньому контакті з кров'ю (ендотеліальні клітини, еозинофіли) або на поверхні клітин, що мають контакт з МР (гладком'язові клітини бронхів). Невелика кількість Н1-рецепторів представлена на поверхні клітин інших тканин, наприклад серце.
Не-Н1-рецептори та інші небажані для впливу рецептори можна розділити на 3 основні групи:
Низький ОР призводить до низької концентрації ЛЗ у тканинах, відповідно деякі внутрішньоклітинні мішені не будуть взаємодіяти з ЛЗ. Важливо пам'ятати, що концентрація більшості ЛЗ залишається дуже низькою позаклітинної рідини. У такому разі токсичність ЛЗ для не-Н1-рецепторів (наприклад, іонних каналів), мабуть, пов'язана з його акумуляцією в клітинах. Н1-рецептори легше взаємодіють при контакті з кров'ю, ніж нецільові рецептори, отже, немає необхідності для АГП переміщатися всередину клітини.
Цікавим є той факт, що рецептори-мішені легко взаємодіють з ЛЗ з кров'яного русла, якщо вони знаходяться в безпосередньому контакті з кров'ю (як ендотеліальні клітини) або дуже близько і, відповідно, легкодоступні (як гладком'язові клітини судин). Зі сказаного вище можна зробити висновок, що Н1-аантагоністам для здійснення своєї фармакологічної дії не потрібно надмірно проникати в тканини. Взаємозв'язок між потенційним розподілом Н1-антагоніста в тканинах та ОР продемонстровано на рис. 2.
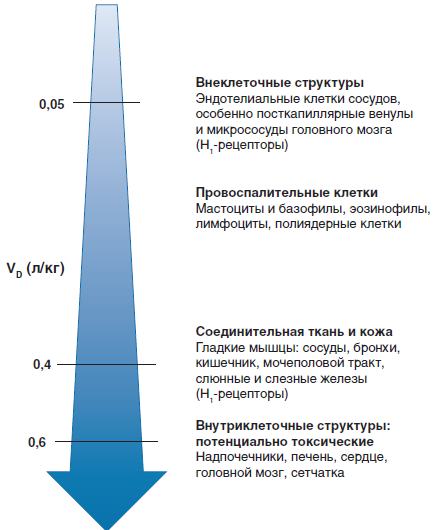
Рис. 2. Взаємозв'язок між потенційним місцем впливу та ОР основних Н1-антагоністів
У таблиці подано основні фармакокінетичні параметри для доступних АГП II покоління. Як видно, у цетиризину та акривастину найнижчий ОР, що означає, що вони погано розподіляються в органах та тканинах. Більшість інших ЛЗ мають високий ОР та загальний кліренс [7, 8]. Винятково низький ОР цетиризину може частково пояснити безпеку цього ЛЗ. У терапевтичних дозах цетиризин слабо проникає у серце, печінку та головний мозок. Цей факт пояснює відсутність будь-яких дозозалежних ефектів на ці органи.
|
ЛС |
Період напіввиведення (г) |
Зв'язування з білками плазми (%) |
ОР |
|---|---|---|---|
|
Астемізол |
26 |
96 |
48 |
|
Азеластін |
25 |
- |
14,5 |
|
Ебастин |
10-12 |
- |
- |
|
Лоратадін |
12±4 |
97 |
120 |
|
Меркітазін |
18 |
90 |
67 |
|
Мізоластин |
12,9±4,5 |
98 |
1,4±0,4 |
|
Терфенадін |
16-23 |
98 |
2,2-2,9 |
|
Акривастін* |
1,7±0,2 |
50 |
0,64±0,13 |
|
Каребастін* |
13-16 |
98 |
2,1-2,4 |
|
Цетиризин* |
10 |
88-90 |
0,4 |
|
Фексофенадин* |
18,3±2,0 |
65 |
5,6±0,7 |
Оскільки цетиризин трохи проникає в печінку, біотрансформація лише 10% ЛЗ викликає необхідний ефект. Це означає відсутність будь-яких дозозалежних ефектів і мінімальну варіабельність вираженості терапевтичного ефекту в різних індивідів. Серед усіх доступних АГП лише акривастин, цетиризин та фексофенадин екскретуються, демонструючи незначний печінковий метаболізм [9–11]. Розподіл Н1-антагоністів у тканинах для здійснення їхнього терапевтичного ефекту є небажаним. Необхідно встановити, чи існує кореляція між частотою побічних ефектів та ОР, також ці фактори можуть бути пов'язані з акумуляцією класу ЛЗ.
З огляду на наведені дані можна поставити резонне питання: що забезпечує цетиризину виключно низький ОР? З даних таблиці видно, що залежність між відсотком зв'язування ЛЗ з білками плазми і ОР немає. Низький ОР може бути пов'язаний з низькою іонізацією молекул, низькою їх ліпофільністю, низьким афінітет до Н1-рецепторів.
Класичний Н1-антагоніст має ліпофільні властивості, має одиничний центр, який при фізіологічному рН складається з ліпофільних катіонів. Однак ряд АГП існує у формі цвіттер-іону (акривастин, цетиризин, лівокабастін, фексофенадин). Така хімічна форма ЛЗ може проводити його фармакокінетичні властивості, що було досліджено для цетиризина [13].
Метою даного дослідження було вивчити іонізаційні та ліпофільні властивості цетиризину; було продемонстровано, що цетиризин практично завжди існує у формі цвіттер-іону при рН=3,5–7,5, має постійно низьку ліпофільність до октанолу/води порівняно з іншими катіонними АГП (log D=log Pz=1,5) та щодо високу водень-зв'язуючу активність (Δlog Pz≥3,1). Обчислення конформаційного, електронного та ліпофільного потенціалу показало, що цетиризин у формі цвіттер-іона демонструє часткову нейтралізацію інтрамолекулярної заряду в конформації, знижуючи фактори полярності. Дані спостереження можуть допомогти краще зрозуміти фармакологічну дію цетиризину.
Насамкінець слід зазначити, що цетиризин демонструє унікальні структурні характеристики порівняно з іншими Н1-антагоністами II покоління. Перевагами малого ОР ЛЗ є мінімальний ризик дозозалежної токсичної дії на клітини та органи, мінімальна варіабельність вираженості терапевтичного ефекту у різних індивідів, низький рівень небажаних взаємодій з іншими ЛЗ, відсутність акумуляції у серці чи печінці.
Реферативний огляд статті «» J-P. Tillement підготувала Марія Ковальчук
Інформаційний матеріал підготовлений за підтримки компанії «Др. Редді'с Лабораторіс Лімітед»
Цитується за джерелом: Клінічна імунологія. Алергологія. Інфектологія. № 4 (73) 2014
ЦЕСОЗ1-06/07/2017-ОТС
Запрошуємо переглянути запис прямого ефіру на тему "Запалення як мета комплексної терапії хронічних захворювань верхніх дихальних шляхів"
Науково-практичний кейс-марафон SHDM.SCHOOL
SHDM.FORUM'24: головна подія року!
Інформація, опублікована на даному сайті, орієнтована на загальне ознайомлення та жодним чином не може бути використана в якості медичних, практичних або комерційних рекомендацій. У зв’язку з цим, Сайт «Школи доказової медицини» не несе жодної відповідальності за негативні наслідки, отримані через використання матеріалів, викладених на даному сайті. Документація з фармацевтичних продуктів не є рекламою та не призначена для того, щоб використовувати її замість консультації з кваліфікованими фахівцями в галузі медицини та інших галузях. Документація з фармацевтичних продуктів надається за вашою згодою відповідно до вимог ч.ч. 1, 2 ст. 15 Закону України «Про захист прав споживачів» від 12.05.1991 р. № 1023-XII. Якщо вам потрібна консультація з конкретного питання, пов’язаного зі здоров’ям, необхідно звернутися до фахівців- професіоналів.
Продовжуючи своє перебування на сайті, ви підтверджуєте свою згоду на дистанційне отримання інформації про лікарські та косметичні засоби (включаючи інформацію про рецептурні лікарські засоби) на підставі вимог ч.ч. 1, 2 ст. 15 Закону України «Про захист прав споживачів» від 12.05.1991 р. № 1023-XII.
Уся інформація, яка міститься на даному сайті, подана з освітньою метою виключно для медичних та фармацевтичних працівників і не замінює консультації лікаря.
