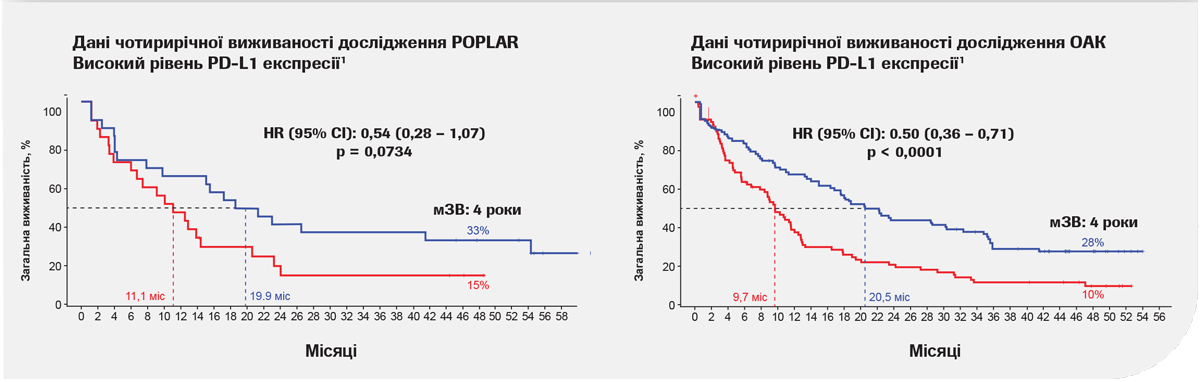
Фінальний аналіз результатів досліджень POPLAR та OAK продемонстрував послідовну та стійку перевагу збільшення загальної виживаності при застосуванні атезолізумабу проти доцетакселу у пацієнтів із раніше лікованим НДКРЛ, з різним рівнем експресії PD-L1 та у різних гістологічних підгрупах.
Найбільша користь спостерігалася у підгрупі з високою експресією PD-L1 (експресія ≥ 50% на TC або ≥ 10% на IC [TC3 або IC3])1
Тецентрик®. Склад: Діюча речовина: atezolizumab; 1 флакон (20 мл концентрату для розчину для інфузій) містить 1200 мг атезолізумабу. Лікарська форма. Концентрат для розчину для інфузій. Механізм дії. Атезолізумаб є моноклональним антитілом, що блокує ліганд 1 програмованої смерті клітин (PD-L1) та блокує його взаємодію з рецепторами PD-1 і B7.1, наслідком чого є усунення опосередкованого PD-L1/PD-1 пригнічення імунної відповіді, включаючи активацію протипухлинної імунної відповіді без індукування антитілозалежної клітинної цитотоксичності. Показання. Уротеліальна карцинома: Лікування дорослих пацієнтів з місцево поширеною або метастатичною уротеліальною карциномою: яким не підходить цисплатинвмісна хіміотерапія та у яких пухлина експресує PD-L1 (PD-L1-пофарбовані імунні клітини, що інфільтрують пухлину, покривають ≥ 5% площі пухлини) або яким не підходить жодна платиновмісна хіміотерапія незалежно від рівня експресії PD-L1 пухлиною, або у яких наявне прогресування захворювання під час або після платиновмісної хіміотерапії або протягом 12 місяців після неоад'ювантної або ад'ювантної хіміотерапії. Недрібноклітинний рак легень: Лікування першої лінії у режимі монотерапії дорослих пацієнтів із метастатичним недрібноклітинним раком легень (НДКРЛ) із високою експресією PD-L1 (PD-L1-забарвлені пухлинні клітини ≥ 50 % або PD-L1-забарвлені імунні клітини, що інфільтрують пухлину, покривають ≥ 10 % площі пухлини) та без геномних пухлинних аберацій EGFR або ALK. Лікування першої лінії у комбінації з бевацизумабом, паклітакселом та карбоплатином дорослих пацієнтів з метастатичним неплоскоклітинним НДКРЛ без геномних пухлинних аберацій EGFR або ALK. Лікування першої лінії у комбінації з паклітакселом, зв'язаним з білком, та карбоплатином дорослих пацієнтів з метастатичним неплоскоклітинним НДКРЛ без геномних пухлинних аберацій EGFR або ALK. Лікування дорослих пацієнтів з метастатичним НДКРЛ, у яких спостерігається прогресування захворювання під час або після хіміотерапії, що включає препарати платини. У пацієнтів з EGFR- або ALK-геномними пухлинними абераціями до отримання препарату Тецентрик ® повинно спостерігатися прогресування захворювання на фоні терапії, що схвалена для НДКРЛ з такими абераціями. Дрібноклітинний рак легені: Лікування першої лінії у комбінації з карбоплатином та етопозидом дорослих пацієнтів з дрібноклітинним раком легені на поширеній стадії (ПС-ДКРЛ). Гепатоцелюлярна карциномa: Лікування у комбінації з бевацизумабом пацієнтів із неоперабельною або метастатичною гепатоцелюлярною карциномою, які не отримували попередню системну терапію. Протипоказання. Підвищена чутливість до атезолізумабу або будь-якої допоміжної речовини лікарського засобу. Рекомендоване дозування при уротеліальній карциномі, НДКРЛ: 840 мг кожні 2 тижні, або 1200 мг кожні 3 тижні, або 1680 мг кожні 4 тижні. Рекомендована доза препарату Тецентрик® при НДКРЛ становить 1200 мг кожні 3 тижні внутрішньовенно при застосуванні в комбінації з бевацизумабом, паклітаксеклом та карбоплатином. Після завершення 4-6 циклів лікування паклітакселом та карбоплатином та у разі припинення застосування бевацизумабу рекомендована доза становить: 840 мг кожні 2 тижні або1200 мг кожні 3 тижні або 1680 мг кожні 4 тижні. Рекомендована доза препарату Тецентрик® при ДКРЛ становить 1200 мг кожні тижні. Після завершення 4 циклів лікування карбоплатином та етопозидом рекомендована доза препарату Тецентрик® становить: 840 мг кожні 2 тижні або 1200 мг кожні 3 тижні або 1680 мг кожні 4 тижні При ГЦК рекомендоване дозування препарату Тецентрик® становить 1200 мг у вигляді внутрішньовенної інфузії , із наступним введенням бевацизумабу в дозі 15 мг/кг у той же день, кожні 3 тижні до прогресування захворювання або виникнення неприйнятної токсичності. Побічні реакції. Для пацієнтів, які отримували препарат Тецентрик® як монотерапію, найбільш поширеними побічними реакціями (≥ 20%) пацієнтів були слабкість/астенія (48%), зниження апетиту (25%), нудота (24%), кашель (22%) та задишка (22%) та інші. У пацієнтів з НДКРЛ та ДКРЛ, які отримували препарат Тецентрик® у комбінації з іншими протипухлинними засобами, найбільш поширеними побічними реакціями (≥20%) пацієнтів були слабкість/астенія (49%), нудота (38%), алопеція (35%), запор (29%), діарея (28%) та зниження апетиту (27%) та інші. При ГЦК найбільш поширеними побічними реакціями, що призвели до відміни препарату Тецентрик® були кровотеча (1,2 %), підвищення рівня трансаміназ або білірубіну (1,2 %); інфузійні реакції/синдром вивільнення цитокінів (0,9 %), аутоімунний гепатит (0,6 %) та інші. Термін придатності. 3 роки. Категорія відпуску. За рецептом. Виробник Ф.Хоффманн-Ля Рош Лтд, Вурмісвег, 4303 Кайсераугст, Швейцарія. Інформацію наведено у скороченому вигляді. Більш детальна інформація щодо лікарського засобу Тецентрик® міститься у інструкції для медичного застосування, що затверджена наказом МОЗ України від 20.03.2017 № 295, реєстраційне посвідчення №UA/15872/01/01. Зміни внесені Наказом МОЗ України від 9.09.2020 № 2069
TC - пухлинні клітини, ІС - імунні клітини
Mazieres et al Journal of Thoracic Oncology. 2020 https://doi.Org/10.1016/j.jtho.2020.09.022.
Інструкція для медичного застосування, що затверджена наказом МОЗ України від 20.03.2017 № 295, реєстраційне посвідчення №UA/15872/01/01. Зміни внесені Наказом МОЗ України від 9.09.2020 № 2069
Інформація для професійної діяльності медичних і фармацевтичних працівників
ТОВ «Рош Україна», м.Київ, 04070, вул. П.Сагайдачного, 33. Тел.: +380 (44) 354 30 40, факс: +380 (44) 354 304. www.roche.ua
Повідомити про побічні явища під час лікування лікарським засобом ТОВ «Рош Україна» або поскаржитись на якість лікарського засобу ви можете за контактними реквізитами офісу або на електронну адресу ukraine.safety@roche.com
Підготовлено при інформаційній підтримці ТОВ «Рош Україна
Для розміщення в спеціалізованих виданнях, призначених для медичних закладів або спеціалістів охорони здоров'я
Запит медичної інформації про лікарські засоби ТОВ «Рош Україна» ви можете надіслати на електронну адресу: ukraine.medinfo@roche.com
Запрошуємо переглянути запис прямого ефіру на тему "Закладеність носа"
Необґрунтований антибіотик при риносинуситі. Як запобігти?
Алергічний риніт у дітей. Проблема, що не дає дитині нормально розвиватись
Лідерська програма для лікарів MEDFUTURE
Інформація, опублікована на даному сайті, орієнтована на загальне ознайомлення та жодним чином не може бути використана в якості медичних, практичних або комерційних рекомендацій. У зв’язку з цим, Сайт «Школи доказової медицини» не несе жодної відповідальності за негативні наслідки, отримані через використання матеріалів, викладених на даному сайті. Документація з фармацевтичних продуктів не є рекламою та не призначена для того, щоб використовувати її замість консультації з кваліфікованими фахівцями в галузі медицини та інших галузях. Документація з фармацевтичних продуктів надається за вашою згодою відповідно до вимог ч.ч. 1, 2 ст. 15 Закону України «Про захист прав споживачів» від 12.05.1991 р. № 1023-XII. Якщо вам потрібна консультація з конкретного питання, пов’язаного зі здоров’ям, необхідно звернутися до фахівців- професіоналів.
Продовжуючи своє перебування на сайті, ви підтверджуєте свою згоду на дистанційне отримання інформації про лікарські та косметичні засоби (включаючи інформацію про рецептурні лікарські засоби) на підставі вимог ч.ч. 1, 2 ст. 15 Закону України «Про захист прав споживачів» від 12.05.1991 р. № 1023-XII.
Уся інформація, яка міститься на даному сайті, подана з освітньою метою виключно для медичних та фармацевтичних працівників і не замінює консультації лікаря.
