Безшапочний С.Б., Зайков С.В., Лобурець В.В.
Традиційно, у структурі загальної захворюваності дитячого та дорослого населення значну частину займають захворювання органів дихання (ЗОД). Так, вони становлять до 50% у структурі загальної захворюваності дітей та до 30% у дорослих.
Крім того, захворювання верхніх та нижніх дихальних шляхів становлять 1/3 усіх амбулаторних звернень до лікарів загальної практики. Саме гострі респіраторно-вірусні інфекції (ГРВІ) є найпоширенішим інфекційним захворюванням у розвинених країнах, у середньому за рік дорослий хворіє не рідше 2-3 разів, дитина – 6-10 разів на рік. Гострі респіраторні захворювання (ГРЗ), зокрема і ГРВІ, займають основне місце у структурі захворюваності в дітей віком, а серед захворювань інфекційної природи стійко утримують перше місце. Віруси грипу та інших ГРВІ викликають масові спалахи захворювань, які набувають майже щороку характеру епідемій, вражаючи від 5 до 20% населення світу. При цьому практично кожен 6-й житель України залучений до епідемічного процесу. За даними Всесвітньої організації охорони здоров'я, від ГРВІ та їх ускладнень щороку помирають 4 млн дітей у віці до 5 років. Серед дітей захворюваність на ГРЗ/ГРВІ у 3–4 рази вища, ніж у дорослих. При цьому найвищий рівень захворюваності на респіраторні інфекції відзначається у дітей дошкільного віку, які відвідують організовані колективи. Однак, з іншого боку, контакт та взаємодія з респіраторними інфекціями – це необхідні умови становлення імунної системи (ІС) дитини, набуття ним імунологічного досвіду для адекватного реагування на мікробну агресію.
Часті ГРЗ, безумовно, мають на дітей та дорослих негативний вплив. Лише грип та інші ГРВІ становлять до 90% всіх випадків інфекційної патології та є однією з найбільш значущих медичних та соціально-економічних проблем. За даними ВООЗ, щорічно під час спалахів епідемії грипу у світі хворіє до 500 млн. осіб, з яких 2 млн. помирають. ГРВІ та грип часто призводять до загострення хронічної патології: бронхіальної астми, хронічного обструктивного захворювання легень (ХОЗЛ), серцево-судинних захворювань та хвороб нирок, а також розвитку пневмоній. ГРВІ є причиною 80-85% випадків загострення астми у дітей та 75% – у дорослих. Небезпека цих захворювань полягає також у тому, що рецидивна бактеріальна та грибкова інфекція при тривалій персистенції може призводити до розвитку сенсибілізації та сприяти подальшому формуванню таких алергічних захворювань, як бронхіальна астма, алергічний риніт, атопічний дерматит. Таким чином, широка поширеність, висока частота ускладнень та смертності, особливо у дитячому віці, короткочасність специфічного імунітету після перенесених ГРВІ, великі економічні витрати суспільства роблять проблему профілактики та лікування респіраторних інфекцій надзвичайно актуальною з медичної та соціально-економічної точок зору.
Оскільки часті рецидивні респіраторні інфекції характерні для пацієнтів з порушенням функції ІС, нижче будуть викладені основні дані щодо її будови та функціонування, у тому числі у дітей, будуть описані клінічні особливості респіраторних інфекцій на тлі вторинної імунної недостатності, переваги комплексного підходу терапії та профілактики респіраторних інфекцій, що найчастіше зустрічаються.
Імунна система (ІС) – система, яка забезпечує підтримку генетичного гомеостазу. Функції її спрямовані на захист організму від бактерій, вірусів, найпростіших, гельмінтів, клітин, які несуть ознаки чужорідності (пухлинні клітини, клітини, інфіковані вірусами, «старі» клітини та ін.) та формування імунітету. Імунітет – це несприйнятливість організму до генетично чужорідних агентів екзогенного та ендогенного походження.
Імунітет є одним із найважливіших характеристик всім живих організмів, створених у процесі еволюції. Принцип роботи захисних механізмів полягає у розпізнаванні, переробці та елімінації чужорідних структур. Захист організму здійснюється за допомогою двох систем – неспецифічного (вродженого, природного) та специфічного (адаптивного, набутого) імунітету. Ці дві системи є дві стадії єдиного процесу захисту організму. Неспецифічний імунітет виступає як перша лінія захисту та як заключна її стадія, а система набутого імунітету виконує проміжні функції специфічного розпізнавання та запам'ятовування чужорідного агента та підключення потужних засобів вродженого імунітету на заключному етапі процесу. Система вродженого імунітету діє на основі запалення та фагоцитозу, а також захисних білків (комплемент, інтерферони, фібронектин та ін.) Ця система реагує тільки на корпускулярні агенти (мікроорганізми, чужорідні клітини та ін.) та токсичні речовини, що руйнують клітини та тканини, на корпускулярні продукти цієї руйнації Друга і найскладніша система - набутого імунітету - заснована на специфічних функціях лімфоцитів, клітин крові, що розпізнають чужорідні макромолекули і реагують на них або безпосередньо або виробленням захисних білкових молекул (антитіл). Схематично можна уявити будову ІС так, як це представлено на рис. 1.
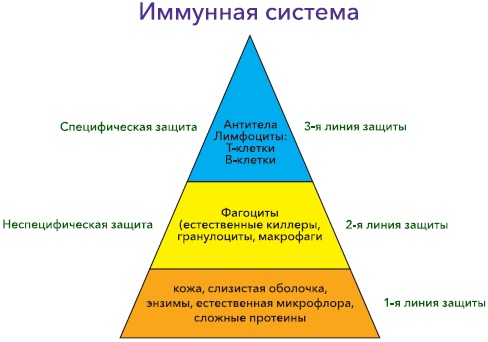
Як уже зазначалося вище, існує 2 групи механізмів, що лежать в основі функціонування ІС, які будуть розглянуті нижче.
У дихальних шляхах анатомічно розрізняють три відділи: верхній (носоглотка), середній (гортань, трахея та головні бронхи до моменту входження в легені), нижній (легкі), хоча у практичній діяльності зручніше розділяти дихальні шляхи на верхній та нижній відділи, межа між якими проходить на рівні 5-6 кільця трахеї. У цій роботі ми зупинимося переважно на анатомо-фізіологічних особливостях верхнього та середнього відділів дихальних шляхів. При цьому необхідно зазначити, що дихальні шляхи до рівня голосових зв'язок колонізовані аутохтонною мікрофлорою, а починаючи з підв'язного простору дихальні шляхи прийнято вважати стерильними.
У дітей хвороби верхніх дихальних шляхів зустрічаються часто, оскільки цьому сприяють анатомо-фізіологічні особливості організму дитини. Так, ніс новонародженої дитини зазвичай короткий і широкий, є два носові ходи, слизова пухка і швидко набрякає. Ніс з'єднаний з вухом короткою євстахієвою трубою, тому дуже небезпечне інфікування патогенними мікроорганізмами, які швидко проникають з носа у вухо, чим пояснюється висока частота отитів у дітей. Носовою порожниною виконуються такі найважливіші функції: очищення вдихуваного повітря, його зігрівання і зволоження, і навіть мовної резонанс і нюх. При народженні у дитини присутні комірки ґратчастих пазух та верхньощелепні пазухи. Вважається, що ґратчасті пазухи можуть формуватися з 6-місячного віку, а верхньощелепні – пневматизуються до 2 років. Клиноподібна пазуха формується до 5 років, лобові починають формуватися з 7-8 років. Основними анатомічними особливостями носової порожнини у дітей, на додаток до вищесказаного, є відносна вузькість носових ходів і відсутність волосся напередодні носа. Зменшення просвіту лише на 1 мм створює більш значну перешкоду потоку повітря в порівнянні з дорослими, у зв'язку з чим у дітей молодшого віку риніт практично завжди супроводжується вторинним кон'юнктивітом внаслідок обтурації слізного каналу.
Анатомо-фізіологічні особливості глотки у дітей полягають у тому, що вона відносно маленька та вузька, є гіперплазія лімфоїдної тканини, відрізняється розташуванням слухових труб (широкі, прямі, короткі та розташовані горизонтально). Приблизно до 7-10 років розташування слухових труб стає аналогічним у дорослих, що сприяє зниженню частоти отитів у старших дітей. У глотці розташоване лімфатичне ковткове кільце, і якщо мигдалики в нормі, то вони не виходять через дужки, що служить бар'єром для подальшого поширення інфекції. Мигдалики розвиваються з 2,5 років, а в деяких дітей можуть розвинутися патологічні носоглоткові мигдалики-аденоїди. Вони можуть ускладнювати дихання дитини, тому у неї з'являються характерні симптоми: одутле обличчя, дихає відкритим ротом, хропе, погіршується слух. Гіперплазія лімфоїдної тканини на задній поверхні глотки у дітей молодшого віку обумовлює можливість розвитку заглоткового абсцесу, а гіперплазія аденоїдної, трубних та піднебінних мигдаликів часто сприяє порушенню носового дихання та резонансу голосу, а також частим отитам.
Гортань бере участь у проведенні повітря у легені, формуванні голосу та захисті дихальних шляхів від аспірації їжі та слизу верхніх дихальних шляхів. Надгортанник та голосові зв'язки забезпечують захист від аспірації сторонніх тіл. Гортань у дітей також відрізняється від такої у дорослих: має лійкоподібну форму (у дорослих вона циліндрична), розташована вище, на рівні 4-го шийного хребця (у дорослих на рівні 6-го), голосова щілина щодо вузька, голосові зв'язки пухкі, є лімфоїдна тканина у підв'язному просторі. У зв'язку з тим, що гортань у новонароджених вузька, слизова – багато забезпечена судинами, тому для неї характерний швидший набряк. Високе розташування гортані дозволяє в дітей віком молодшого віку побачити надгортанник під час огляду зіва. Наявність лімфоїдної тканини та пухкого підслизового шару в підзв'язному просторі пояснює можливість виникнення стенозуючого ларинготрахеїту (хибного крупу) та зберігається у дітей до 5-7 років. Крім того, лімфоїдна тканина підзв'язкового простору обумовлює високу частоту поширення постінтубаційних стенозів гортані порівняно з дорослими.
Трахея дитини складається з хрящових кілець і поділяється на два бронхи. Правий бронх короткий та широкий, а лівий навпаки. Біля трахеї та бронхів розташовані лімфатичні вузли. Під час проходження повітря через верхні дихальні шляхи відбувається його зігрівання, у результаті температура в трахеї відрізняється від температури тіла не більше ніж на 0,36°С. Легкі новонароджені малоеластичні, тому їх паренхіма швидко спадає. Легкі стиснуті діафрагмою знизу та грудною клітиною навколо, тому дихання малюка дуже часто і поверхове. Новонароджений зазвичай дихає 40-60 разів на хвилину, а в однорічному віці кількість вдихів та видихів знижується до 30-35 разів.
З урахуванням всього вищесказаного, до загальних анатомо-фізіологічних особливостей органів дихання у дітей відносять наступне: відносну вузькість просвіту дихальних шляхів, недосконалі механізми мукоциліарного кліренсу, недостатній розвиток хрящового каркасу трахеї та бронхів, високу частоту аспірації бронхообструктивного синдрому та ін.
При вродженому імунітеті розпізнається «чуже» у вихідній, не обробленої формі («патерни»), тоді як формування адаптивного імунітету спочатку необхідна попередня обробка (процесинг) «чужого», після чого відбувається його розпізнавання. Звичайно, що це вимагає додаткового часу. Структури, що забезпечують природний імунітет, існують у неклональній формі.
На відміну від імунної відповіді імунологічна толерантність (immunological tolerance) є станом, для якого характерна специфічна невідповідність на конкретний антиген.
Функціональна організація ІС може бути розглянута на органному, клітинному та молекулярному рівнях.
Існує два типи органів ІВ: центральні (або первинні) та периферичні (або вторинні). Кістковий мозок - центральний орган, в якому народжуються всі клітини ІС і дозрівають В-лімфоцити (В-лімфопоез або В-коммітмент). Тимус (вилочкова залоза) – центральний орган, у якому диференціюються Т-лімфоцити (Т-лімфопоез або Т-коммітмент) і який також є загальнокоординуючим для всієї ІС. У периферичних органах відбувається антигензалежне диференціювання лімфоцитів (імунна відповідь або праймінг), після якої розгортаються ефекторні реакції щодо елімінації даного антигену. До периферичних органів належать: 1) лімфатичні вузли, лімфатичні протоки та селезінка; 2) лімфоїдна тканина, асоційована зі слизовими оболонками, mucosae (Mucous-Associated Lymphoid Tissue - МАLT), яка розташована на п'яти рівнях: носоглотка (Nasal-Associated Lymphoid Tissue - NALT) та євстахієва труба (Tube-Associa) різними мигдаликами; наступний рівень – бронхи (Bronchus-Associated Lymphoid Tissue – BALT) та грудні залози (у жінок); верхні відділи шлунково-кишкового тракту (Gut-Associated Lymphoid Tissue - GАLТ) мають пейєрові бляшки, нижні відділи – апендикс та солітарні фолікули; 3) лімфоїдна тканина, асоційована зі шкірою.
Всі клітини ІС у функціональному відношенні можна розділити на чотири групи: 1) антиген-презентуючі клітини (antigen-presenting cells): макрофаги, дендритні клітини типів 1 і 2, В-лімфоцити; 2) регуляторні клітини (regulatory cells): природні регуляторні Т-клітини, T-індуктори, Т-хелпери типів 1, 2 та 3, Т-регулятори типу 1; 3) ефекторні клітини (effector cells): плазматичні клітини (що диференціюються з В-лімфоцитів); цитотоксичні клітини з фенотипом CD8+ (або T-кілери); ефекторні Т-клітини запалення з фенотипом CD4+ (або Т-лімфоцити, відповідальні за гіперчутливість уповільненого типу); нейтрофіли, еозинофіли, базофіли, огрядні клітини, натуральні кілери (NK-клітини), макрофаги; 4) клітини пам'яті (memory cells): Т-клітини пам'яті з фенотипом CD8+, Т-клітини пам'яті з фенотипом CD4+; довгоживучі плазматичні клітини, В-клітини пам'яті.
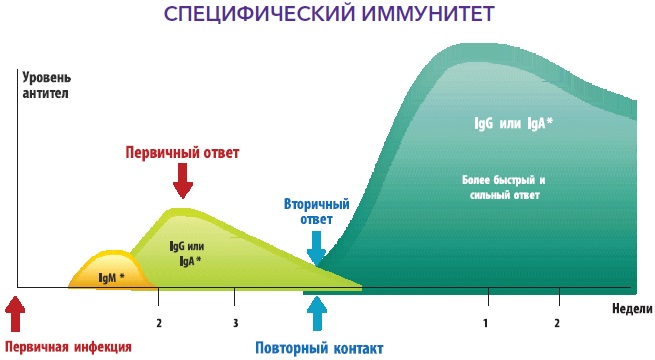
Лімфоцити, як головні клітини ІС, мають відмінні риси: 1) постійна «патрульна» рециркуляція по кровотоку, лімфотоку, міжтканинним просторам та секретам; 2) здатність розпізнавати, тобто. взаємодіяти зі «своїм» та «не своїм» за принципом «ліганд – рецептор»; 3) клональна організація та здатність формувати мережеві елементи; 4) здатність до безперервних реаранжувань у своєму геномі у будь-якому віці у зв'язку з потребами формування специфічної відповіді на патоген; 5) вміння запам'ятовувати про факт зустрічі з будь-яким антигеном та забезпечувати у майбутньому швидку та високоефективну відповідь на нього.
Відповідно до вищесказаного, виділяють вроджений та адаптивний або набутий імунітет. Вроджений імунітет є антиген-неспецифічним, існує з моменту народження дитини, використовує анатомічні (шкіра та слизові), хімічні (лізоцим, молочна, соляна кислота, слина, секрети залоз та ін.), фізичні (температура тіла, низький рН, рухи вій миготливого) епітелію, повік та ін.) та біологічні (симбіотична мікрофлора шкіри, порожнини рота, кишечника, урогенітальної, вагінальної сфер) бар'єри, клітинний та гуморальний компоненти, запускає та посилює набутий імунітет, але не залишає пам'яті після контакту з антигенами. Основні механізми вродженого імунітету включають фагоцитоз за допомогою нейтрофілів, моноцитів і тканинних макрофагів, процеси запалення (запальні медіатори, цитокіни), функціонування натуральних кілерних клітин, що знищують пухлинні та інфіковані клітини. Адаптивний імунітет є специфічним, формується в процесі життя, посилюється наступною експозицією антигенів, передбачає участь клітинних і гуморальних компонентів (Т-, В-лімфоцити, антитіла тощо), залишає пам'ять, але, на жаль, малоефективний без вродженого імунітету. Схематично функціонування адаптивного імунітету представлено на рис. 2., а тісний взаємозв'язок між двома видами імунітету зображено на рис. 3.1 та 3.2.
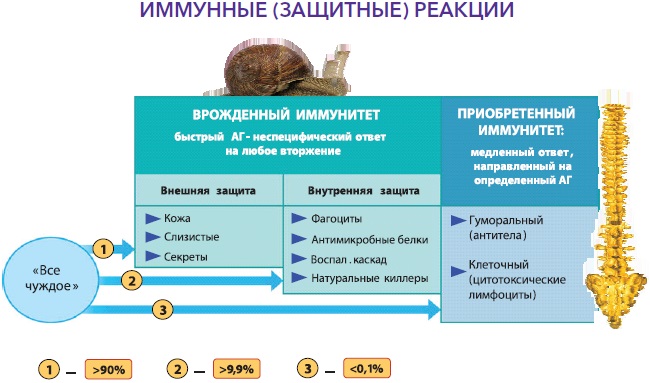
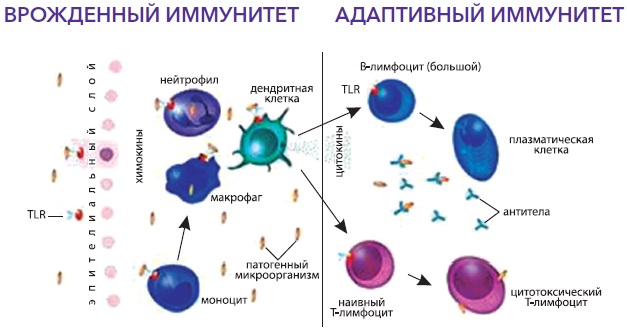
ІС дитини має свої особливості, що зумовлює високу схильність дитячого організму до респіраторних інфекцій. Діти першого півріччя життя хворіють не часто. У перші 6-9 місяців життя дитина досить добре захищена материнськими імуноглобулінами класу G, отриманими внутрішньоутробно, а також імуноглобулінами класу A, що надходять з грудним молоком. У дітей раннього віку відзначається досить низький рівень утворення інтерферонів та їх активності, що послаблює противірусний захист. Фагоцитоз у дитини перших років життя має незавершений характер, незважаючи на його високу активність. Крім цього, шкіра та слизові дитини пухкі та тонкі, що знижує їх бар'єрні властивості та полегшують адгезію та проникнення збудника.
Дозрівання специфічного імунного захисту, Т-і В-лімфоцитів, відбувається у дитини аж до періоду статевого дозрівання. Так, до 6-9 місяців життя з організму дитини повністю елімінуються імуноглобуліни (переважно класу G), отримані від матері. Синтез власних імуноглобулінів G досягне рівня дорослого лише до 6–8 років. Рівень імуноглобулінів класу А, які здійснюють місцевий захист слизових, у новонароджених та дітей раннього віку низький і досягає рівня дорослого до 10-12 років, що зумовлює більш високу сприйнятливість дитини до респіраторних інфекцій. З огляду на всі ці фактори стає зрозумілим, чому несприятливий перебіг вагітності, недоношеність, внутрішньоутробне інфікування, штучне вигодовування та інші фактори значно підвищують ризик розвитку ГРВІ/ГРЗ.
З народження дитини «знайомиться» з навколишнім світом, невід'ємною частиною якого є мікроорганізми. «Знайомство» з мікроорганізмами передбачає контакт із нею, що часто призводить до розвитку захворювання. Поступово діти звикають до збудників, які персистують у батьків і членів сім'ї, в будинку. У віці 3-4 років переважна більшість дітей починає відвідувати дитячі дошкільні заклади, куди кожен приносить «своїх» збудників. Саме на цей період припадає перша, найбільша хвиля захворюваності на ГРЗ. Другий підйом захворюваності на ГРЗ припадає на 6-7 років, коли дитина починає ходити до школи, де формується новий колектив. Таким чином, своєрідність функціонування імунітету та високе інфекційне навантаження є основними причинами вищої захворюваності на ГРВІ/ГРЗ у дітей порівняно з дорослими. Хоча дозрівання ІС продовжується протягом усього дитячого віку, проте часті захворювання у поєднанні з іншими несприятливими факторами у дітей призводять до зриву становлення імунітету, внаслідок чого патологічний процес стає рецидивуючим, не піддається стандартним методам лікування.
Діти, що часто хворіють (ЧБД) – офіційний термін, запропонований ВООЗ ще в 1980 р., хоча в останні роки цей термін на практиці використовується не так часто і не в усіх країнах. Проблема ЧБД є однією з найбільш важливих у сучасній педіатрії, тому що дитина, що хворіє, відстає від однолітків у своєму розвитку. До часто хворих відносять дітей, у яких частота гострих захворювань становить 4 і більше разів на рік. Нерідко діти хворіють як часто, а й довго – понад 10-14 днів однією гостре респіраторне захворювання (ГРЗ). Діти, що довго хворіють, також відносяться до категорії ЧБД. Віднесення чи не віднесення дітей до категорії ЧДБ ґрунтується на частоті перенесених ними епізодів ГРЗ на рік залежно від віку дитини. Так, для ЧДБ віком до 1 року життя частота епізодів ГРЗ становить 4 і більше, до 3 років – 6 і більше, 4-5 років – 5 і більше, старше 5 років – 4 і більше. У групі ЧБД до 90% випадків посідає захворювання ЛОР-органів, у переважній більшості яких першорядне значення належить імунним порушенням. Так, не менше ніж у половини їх визначається гіперплазія лімфоїдної тканини носоглотки (до аденоїдних вегетацій включно).
В даний час основна увага лікарів приділяється питанням ендогенної схильності дитини, імунної недостатності її організму. При цьому, як інфекційні агенти, так і форми захворювань можуть бути різними. Діти, що часто хворіють, страждають від інфекцій верхніх дихальних шляхів (риніт, назофарингіт, тонзиліт, ларингіт, трахеїт), бронхітів, пневмоній, а також вірусно-бактеріальних захворювань ЛОР-органів (отит, євстахіїт, аденоїдит, синусити). Найчастішим збудником цих захворювань є віруси, хоча вірусна інфекція часто ускладнюється бактеріальною, тому нерідко лікар має справу з інфекцією змішаного генезу. Приєднання бактеріальної інфекції призводить до наростання тяжкості захворювання та підвищення ризику розвитку ускладнень.
Причинами ГРЗ в дітей віком найчастіше є віруси грипу, парагрипу, респіраторно-синцитіальні віруси, аденовіруси, риновіруси, серед бактеріальних збудників провідні місця займають Str. pneumoniae, Haemophylus influenzae, Staph. aureus, останнім часом все частіше виділяється Moraxella catarrhalis. Багато хто з цих збудників циркулює в загальній популяції цілий рік і викликає захворювання незалежно від сезону, але деякі здатні формувати епідемічну ситуацію (що відбувається практично щорічно з вірусом грипу). Але навіть у неепідемічний період ГРЗ у багато разів перевищують будь-яку іншу інфекційну патологію. Так, часті повторні ГРЗ властиві насамперед дітям раннього віку з недостатнім імунітетом, зумовленим конституційними особливостями та генетичною схильністю до бронхолегеневої патології. Однак існує чимало факторів, що сприяють посиленню цієї несприятливої ситуації, які можуть бути ендо- та екзогенними, різними за походженням та біологічною дією. До них відносяться преморбідні фонові стани дітей раннього віку (гіпотрофія, вітамінна та білкова недостатність), перенесені захворювання (рахіт, анемія), забруднення довкілля, стресові ситуації в сім'ї та інші. При впливі таких факторів у дитини з незрілими захисно-пристосувальними механізмами (з боку клітинного та/або гуморального імунітету, а також неспецифічних факторів захисту) замикається порочне коло: антигенна стимуляція ІС призводить не до напруження імунітету, а до виснаження його резервів, потім до розвитку вторинних імунодефіцитних станів, що сприяє рецидивуванню патології та підвищенню захворюваності дітей. При цьому у багатьох дітей до шкільного віку формуються вогнища хронічного запалення ЛОР-органів та дихальних шляхів, передумовою цього є фізіологічна незрілість ІВ, особливо місцевого імунітету слизових оболонок дихальних шляхів.
Риніт — гостре або хронічне захворювання слизової оболонки носа, що викликається патогенними або дратівливими факторами навколишнього середовища, (мікроорганізми, алергени, полютанти, термічні, механічні та інші впливи) або розвивається при деяких соматичних захворюваннях (вегетосудинна дистонія), захворювання енд. Вплив зазначених факторів призводить до розвитку запального процесу або до стійких порушень вегетативної іннервації, що може виявлятися набряком слизової оболонки, гіперсекрецією, проліферацією сполучної тканини або рідше метаплазією епітелію. Це призводить до появи різних комбінацій наступних симптомів: утруднення носового дихання, виділення, свербіж у порожнині носа, напади чхання або утворення кірки та порушення нюху.
Інфекційний риніт – це запалення слизової оболонки порожнини носа, викликане вірулентними мікроорганізмами, що виявляється утрудненням носового дихання, виділеннями з носа та чханням, рідше – печінням, зниженням нюху, головним болем та закладеністю носа.
Практично кожна людина знайома із симптомами гострого риніту. Особливо поширений гострий інфекційний риніт у дитячому віці. Вважається, що діти, які відвідують дошкільні заклади, переносять від 2 до 6 епізодів гострого інфекційного риніту на рік. Через велику кількість збудників, які можуть викликати дане захворювання, чіткої його сезонності не існує. Спалахи аденовірусної інфекції часто виникають влітку у дитячих оздоровчих таборах та серед новобранців в армії. Епідемія захворювань, викликаних респіраторно-синцитіальним вірусом, відзначається взимку, піки риновірусної інфекції припадають на весну та осінь.
Етіологія та патогенетичні механізми гострого риніту. Гострий інфекційний риніт зазвичай буває одним із проявів ГРВІ, але може бути і наслідком травмування слизової оболонки. Збудниками гострого інфекційного риніту можуть бути понад 200 серотипів різних вірусів, до яких відносять віруси грипу, парагрипу, аденовіруси, коронавіруси, ентеровіруси, респіраторно-синцитіальний вірус та ін.
Найбільш типовими збудниками риніту є риновіруси, серед яких налічується щонайменше 100 серотипів. Риновіруси відносять до сімейства пікорнавірусів, які здатні до реплікації лише у людини та вищих приматів. Риновіруси викликають від 1/3 до половини ГРВІ у дорослих, тоді як коронавіруси близько 10%. Значення риновірусів велике, вони відповідальні більш ніж 80% випадків захворювань під час осінніх епідемій.
Основними бактеріальними збудниками гострого інфекційного риніту вважають Streptococcus pneumoniae, Streptococcus pyogenes та Haemophilus influenzae. Різні серотипи цих мікроорганізмів, послідовно змінюючи один одного, починають колонізувати носоглотку відразу після народження, внаслідок чого навіть у здоровій популяції вони присутні в носоглотці у 1/3 дорослих та 2/3 дітей.
Спектр збудників хронічного інфекційного риніту значно ширший. Він включає Staphylococcus epidermidis, Staphylococcus aureus, Pseudomonas spp., Klebsiella spp. та багато інших, у тому числі умовно-патогенних бактерій. У пацієнтів з імунодефіцитними станами збудниками риніту можуть бути гриби, бактеріально-грибкові асоціації та опортуністичні мікроорганізми.
Вважають, що індивідуальна сприйнятливість до вірусної інфекції залежить багатьох чинників: віку, фізичного розвитку, санітарно-гігієнічних умов, ступеня адаптації до метеорологічним зрушень і загартованості поверхні тіла до впливу низьких чи контрастних температур, наявності интеркуррентных захворювань. Недостатнє або неправильне харчування, що призводить до дефіциту різних вітамінів та мікроелементів (зокрема вітамінів С, групи В, А та Е, а також цинку, міді, заліза та ін.), — один із важливих патогенетичних факторів, що сприяють підвищенню сприйнятливості до респіраторних інфекцій . Не менше значення може мати фактор стресу. Відповідно до існуючої гіпотези, зміни вищої нервової діяльності через ендокринну і вегетативну нервову систему, що викликаються стресом, можуть стимулювати продукцію кортикостероїдних гормонів і таким чином пригнічувати імунну відповідь організму.
Загальновідомо, що симптоми гострого нежитю зазвичай з'являються після загального переохолодження чи охолодження окремих частин тіла, зокрема стоп, кистей рук, волосистої частини голови, носіння мокрого одягу чи взуття. Цей факт дозволив свого часу припустити, що охолодження тіла і викликані ним рефлекторний спазм і ішемія слизової оболонки носа можуть сприяти активації латентної вірусної інфекції, що вегетує у верхніх дихальних шляхах.
Сучасна концепція, яка пояснює зв'язок між гострим нежиттю і переохолодженням організму і, отже, сезонністю респіраторних вірусних інфекцій, базується на так званій теорії айсберга. Вважається, що у заданій популяції, де циркулюють респіраторні віруси, є певна кількість інфікованих осіб. Однак не у всіх інфікування проявляється вираженими симптомами риніту та ГРВІ. В результаті динамічного процесу взаємодії між вірусом та ІС людини, крім осіб з явною клінічною картиною захворювання, є багато тимчасових носіїв вірусу і тих, у кого інфікування ще не виявилося (а можливо, і не виявиться) скільки-небудь помітними симптомами захворювання. Кількість інфікованих, але не хворих (або не помітили мінімальні прояви хвороби) у природній популяції значно більша, і саме вони становлять основну невидиму підводну частину цього айсберга.
Переохолодження організму вважають основною причиною, яка може сприяти переходу із субклінічної групи до групи явних хворих. Охолодження окремих частин тіла (спини, стоп) є сильним рефлекторним стимулом, що призводить до ішемії та зниження температури слизової оболонки носа та носоглотки.
Як будь-які біологічні процеси, функції респіраторного епітелію залежать від метаболічної активності, яка, безумовно, пригнічуватиметься при зниженні температури навколишнього середовища. В умовах ішемії нестачі кисню та поживних речовин, недостатнього фагоцитозу та неспецифічних факторів імунного захисту страждають два основні захисні бар'єри слизової оболонки: мукоциліарний транспорт та імунна відповідь.
Зниження температури тіла сприяє не лише гнобленню захисних механізмів, а й посилює реплікацію вірусів. Так, культивування риновірусу - основного збудника гострого риніту - можливе лише при зниженні температури культури клітин до 33°С. Таким чином, припустити, що переохолодження сприяє розвитку риніту не шляхом підвищення ймовірності самого вірусного інфікування, а за рахунок активації реплікації вірусу та пригнічення бар'єрних властивостей респіраторного епітелію у вже інфікованих осіб, які в результаті переходять із «підводної» субклінічної частини «айсберга» надводну», де клінічні прояви захворювання маніфестують повністю чи частково.
Зміни епітелію носа та носоглотки після інокуляції вірусу. Риновірус – найбільш типовий збудник гострого нежитю. Інкубаційний період при риновірусній інфекції становить 1-3 дні. Потрапляючи на слизову оболонку, віруси прикріплюються до неї, використовуючи спеціальний механізм. Цей механізм здійснюється шляхом з'єднання з молекулами внутрішньоклітинної адгезії, які постійно експресовані на епітеліальних клітинах порожнини носа та носоглотки. Приблизно 90% вірусів проникають в організм господаря в ділянці глоткової мигдалики, багатої на згадані рецептори. Після з'єднання з молекулами адгезії вірус проникає через мембрану клітини до її цитоплазми і вносить туди свою РНК для реплікації. У міру реплікації вірус поширюється слизовою оболонкою порожнини носа, вражаючи її або тотально, або формуючи окремі острівці пошкодженого епітелію.
При інфікуванні риновірусом основна частина миготливого епітелію порожнини носа залишається відносно інтактною, у зв'язку з чим викликаний риніт протікає відносно легко і рідше супроводжується ускладненнями. На відміну від риновірусів, віруси грипу та аденовіруси викликають більшу поразку та десквамацію епітелію.
Вірусне інфікування ініціює каскад захисних реакцій та формування імунної відповіді. Запальні зміни, що відбуваються у слизовій оболонці, включають розширення кровоносних судин та підвищення їх проникності, клітинну інфільтрацію, гіперпродукцію залоз, виділення медіаторів та стимуляцію чутливих нервових закінчень. Опосередковане молекулами адгезії виділення клітинами епітелію цитокінів та прозапальних медіаторів призводить до стимуляції двох основних захисних механізмів. Перший з них – це активація клітин-кілерів, які мають віруцидну активність. Другий механізм – стимулювання наївних Т-лімфоцитів через каскад імунних реакцій на синтез противірусних антитіл. Таким чином, каскад захисних реакцій, регульований цитокінами, призводить до елімінації вірусу та формування захисного імунного механізму. Цей механізм не є стійким і не запобігає повторному вірусному інфікуванню.
За наявності тимчасових або стійких дефектів імунітету або порушення функції мукоциліарного транспорту вірусне інфікування стає лише першою фазою захворювання, яка відкриває шлях бактеріальної суперінфекції. Коли вії клітин миготливого епітелію, уражених вірусом, тимчасово не функціонують, бактерії, що знаходяться в порожнині носа, отримують можливість для досить тривалого контакту з поверхнею епітелію і проникнення у власний шар слизової оболонки через утворилися в результаті впливу вірусу дефекти в епітеліальному покриві. Це, у свою чергу, веде до активації механізмів антибактеріального захисту, які переважно представлені фагоцитуючими клітинами, системою комплементу та антитілами.
Первинний фагоцитоз, здійснюваний нейтрофілами та макрофагами, суттєво зменшує кількість бактерій, що проникли в слизову оболонку. Система комплементу активується внаслідок контакту плазматичних білків із поверхнею бактеріальної клітини. Результатом є розвиток каскадної реакції. Продукція специфічних антитіл починається з презентації макрофагами фрагментів переварених ними бактерій, причому ця презентація відбувається за участю білків, що продукуються макрофагами, головного комплексу гістосумісності другого класу. Поява на поверхні антиген-презентуючої клітини (макрофага) таких білків у комплексі з фрагментами переварених бактеріальних протеїнів є стимулом, який змушує активно проліферувати певні клони Т-клітин.
Таким чином, функціонує комплекс механізмів антибактеріального захисту, що призводить до елімінації бактеріального запалення та зникнення клінічних симптомів інфекційного риніту.
Різні форми хронічного інфекційного риніту рідко зустрічаються у чистому вигляді. Хронічний катаральний риніт може переходити в субатрофічну (атрофічну) чи гіпертрофічну форми. Гіперплазія підслизового шару часто поєднується з атрофічними змінами епітелію або зі збільшенням кількості залоз та гіперпродукцією слизу.
Клінічна картина. У більшості випадків інфекційний риніт має типовий клінічний перебіг. Для нього характерні гострий початок, що передує контакту з хворим на ГРВІ та (або) переохолодження, класична послідовність появи симптомів. У типовій ситуації клінічні прояви гострого інфекційного риніту проходять три стадії.
У кожному конкретному випадку окремі стадії можуть бути більш менш вираженими або повністю відсутніми, наприклад, якщо не настає бактеріального інфікування.
Перша стадія (рефлекторна чи продромальна) розвивається швидко, невдовзі після переохолодження. Триває кілька годин. Спочатку відбувається спазм, потім паралітичне розширення судин порожнини носа та носових раковин. Турбують сухість, печіння в порожнині носа, утруднення носового дихання, багаторазове чхання. Слизова оболонка носа при передній риноскопії виглядає гіперемованою та сухою.
Друга стадія (катаральна або серозна) триває два-три дні і, ймовірно, є наслідком активації реплікації вірусу в слизовій оболонці носа та носоглотки. Для цієї стадії характерні закладеність носа, рясні прозорі рідкі виділення з носа, зниження нюху, іноді сльозотеча, закладеність вух і гугнявий відтінок голосу. Рясні виділення можуть викликати подразнення шкіри присінка носа та верхньої губи, особливо у дітей. Слизова оболонка носа на цій стадії набрякла, волога, має яскраво-червоний колір.
Початок третьої стадії характеризується приєднанням бактеріального запалення. Загальний стан покращується, поступово відновлюються носове дихання і нюх, але виділення набувають слизово-гнійного характеру і густішої консистенції. При передній риноскопії або ендоскопічному дослідженні таке відокремлюване видно у загальному (рідше в середньому) носовому ході та на дні порожнини носа (рис. 4)
Зміна характеру секрету може пояснюватися особливостями реакції слизової оболонки носа на інокуляцію риновірусу, який викликає підвищення в назальному секреті концентрацій ІЛ-8, та лізоциму, а також загальної кількості білка та мукоглікопротеїнів, що формують гелевий шар слизу, що покриває респіраторний.
Стікання носового секрету по задній стінці глотки може призводити до розвитку болісного кашлю, що особливо характерно для дітей (post-nasal syndrome). У третій стадії інфекційного риніту слизово-гнійне відокремлюване буває добре видно на задній стінці глотки та задній поверхні м'якого піднебіння при ендоскопічному огляді носоглотки. Слизова оболонка носа на цій стадії залишається гіперемованою та набряковою, але колір її поступово наближається до нормального, а просвіт носових ходів поступово розширюється. Весь цикл хвороби зазвичай завершується за 7-10 днів, але може мати більш короткий абортивний перебіг або в несприятливих умовах затягуватися і призводити до розвитку ускладнень синуситу, отиту, трахеїту, бронхіту та ін.
Хронічний інфекційний риніт може протікати у вигляді простого катара слизової оболонки. При тривалому перебігу зазвичай трансформується на гіпертрофічну або атрофічну. Ці форми рідко зустрічаються у чистому вигляді. Гістологічні дослідження показують, що гіперплазія підслизового шару часто поєднується з атрофічними або метапластичними змінами епітелію або зі збільшенням кількості залоз та гіперпродукцією слизу. Гіпертрофічні процеси найчастіше стосуються нижніх носових раковин, які збільшуються у розмірах, поступово займають усі нижні відділи порожнини носа. Гіпертрофія може бути локальною і захоплювати переважно задні кінці раковин, які в цьому випадку набувають характерного вигляду.
Основними симптомами хронічного інфекційного риніту є утруднення носового дихання та виділення з носа. Вони можуть бути непостійними, супроводжуватися періодичною закладеністю то однієї, то другої половини носа. Симптоми мають тенденцію посилюватися в нічний годинник, практично завжди поступово прогресують, змушують регулярно користуватися судинозвужувальними краплями, що зрештою і призводить пацієнта до лікаря. Носове дихання може бути утруднено з різних причин: внаслідок набряку або збільшення носових раковин або через накопичення виділень або кірки в загальному носовому ході. Виділення при хронічному піогенному риніті зазвичай густі жовтуватого, зеленого або сірого кольору, можуть відходити з носа у вигляді скоринок, іноді у виділеннях є домішка крові.
Діагностика. Основну інформацію при обстеженні хворого з інфекційним ринітом дає передня риноскопія, яка виявляє типові зміни зовнішнього вигляду слизової оболонки і секрету, що продукується їй. Додаткові методи дослідження зазвичай не потрібні. При тривалому персистуванні симптомів та неефективності стандартних методів лікування може знадобитися культуральне дослідження мазка з порожнини носа, але його значення не слід переоцінювати через високу ймовірність контамінації матеріалу колійною мікрофлорою напередодні порожнини носа – насамперед золотистим та епідермальним стафілококами. Наявність прихованого запального процесу в приносових пазухах можна уточнити при виконанні комп'ютерної томографії (КТ), причому при цьому патологічні зміни краще видно в коронарній проекції. Зображення в цій проекції дозволяють правильно оцінити індивідуальні особливості будови порожнини носа та виявити анатомічні аномалії внутрішньоносових структур (булла середньої носової раковини, збільшена ґратчаста булла, клітина aggernasi, інфраорбітальна клітина Халлера та ін.). Дослідження мукоциліарного транспорту одним із доступних методів (сахариновий тест) дає можливість встановити або виключити ще одну причину завзятого перебігу риніту.
Диференціальний діагноз рецидивуючого гострого інфекційного та алергічного риніту у дітей молодшого віку може становити великі складнощі, оскільки весняні епізоди вірусних інфекцій можуть збігатися із сезонами цвітіння дерев. У дітей слід проводити диференціальну діагностику з чужорідним тілом порожнини носа (риноліт), хронічним риносинуситом, первинною циліарною дискінезією, муковісцидозом, синдромами Картагенера і Янга.
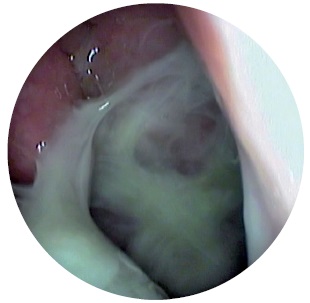
Хронічний гіпертрофічний риніт (rhinitis chronica hipertrophica) характеризується гіперплазією слизової оболонки, часто із залученням окістя та кісткової тканини носових раковин і може мати дифузну або обмежену, локалізовану форми. Найчастіше розростання та потовщення слизової оболонки відбувається на нижній носовій раковині, рідше – середній, у місцях локалізації кавернозної тканини (рис. 5).
Клініка захворювання характеризується тривалим перебігом, постійним утрудненням носового дихання, що не проходить після введення в ніс судинозвужувальних препаратів, слизовим або слизово-гнійним відокремлюваним, періодичним головним болем, сухістю в роті, ротоглотці. У деяких хворих відзначається зниження нюху та смаку різної виразності. Постійна закладеність носа обумовлює зміну тембру голосу та появу закритої гугнявості (rhinolalia clausa).
Гіпертрофія заднього кінця нижньої носової раковини може порушити вентиляцію слухової труби з ознаками закладеності вуха та зниженням слуху (тубоотит). При гіпертрофії передніх відділів нижньої носової раковини може стискатися отвір слізноносового каналу, що викликає сльозотечу, дакріоцистит, кон'юнктивіт.
При передній риноскопії відзначають характерні ознаки гіперплазії слизової оболонки носа, переважно нижньої носової раковини, меншою мірою – середньої, тобто. переважно у місцях локалізації кавернозної тканини. Поверхня гіпертрофованих ділянок може бути гладкою, бугристою, крупнозернистою. Слизова оболонка помірно гіперемована, потовщена, злегка ціанотична. У деяких хворих відзначається поліпозне переродження слизової оболонки, частіше в ділянці середньої носової раковини.
Лікування включає різні хірургічні методи, метою яких є відновлення носового дихання за рахунок видалення або зменшення гіпертрофованих ділянок слизової оболонки. Критерієм для раціонального вибору методу лікування у кожному конкретному випадку є ступінь гіпертрофії носових раковин чи інших відділів слизової оболонки носа, а також ступінь порушення носового дихання.
При невеликій гіпертрофії, коли після анемізації (змазування судинозвужувальним препаратом) слизова оболонка помірно скорочується і носове дихання покращується, застосовують найбільш щадні хірургічні втручання: підслизову ультразвукову дезінтеграцію нижніх носових раковин, підслизову вазотомію.
При вираженій формі гіпертрофії слизової оболонки, що супроводжується значним порушенням носового дихання з вираженим збільшенням носових раковин виконується нижня конхотомія, що щадить, підслизове видалення кісткового краю нижньої носової раковини (остеоконхотомія, латеропозиція (сублюксація)) носових раковин.
Оперативні втручання у порожнини носа зазвичай виробляють під наркозом або місцевою інфільтраційною та аплікаційною анестезією.
Конхотомію завжди необхідно виробляти обережно, особливо переднього кінця раковини, так як повне видалення її може призвести до атрофії слизової оболонки порожнини носа. В амбулаторних умовах можна проводити ультразвукову дезінтеграцію нижніх носових раковин.
Стійкого рубцювання кавернозної тканини можна досягти і шляхом підслизової вазотомії нижньої носової раковини.
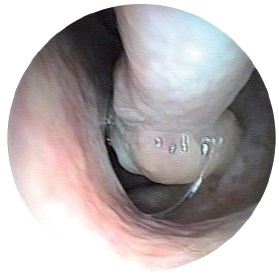
Атрофічний риніт. Атрофічний риніт (rhinitis atrophica) є обмеженими або дифузними неспецифічними змінами слизової оболонки порожнини носа, в основі яких лежить дистрофічний процес (рис. 6). Залежно від поширеності процес може мати локальний чи дифузний характер, залежно від етіології буває первинним (озена) чи вторинним.
При вторинному атрофічному риніті причиною є вплив несприятливих факторів навколишнього середовища, виробничих або кліматичних факторів – пилу, газів, пари та ін. ін. Важливу роль грають ендокринно-гормональні порушення та часті запальні захворювання порожнини носа, що ведуть до наростання трофічних змін слизової оболонки.
Гістологічна картина характеризується метаплазією циліндричного епітелію в плоский, різного ступеня вираженості стоншення багаторядного циліндричного епітелію та зменшення їх кількості та зникнення вій, облітерація або зменшення кількості судин та кавернозної тканини.
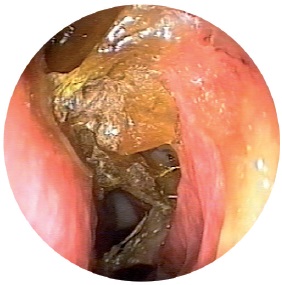
Клініка. Хворі скаржаться на відчуття сухості в носі, утворення кірки, утруднення носового дихання, зниження нюху. Корки в носі нерідко викликають свербіж, тому хворий намагається видалити їх пальцем, що призводить до пошкодження слизової оболонки, періодичних кровотеч, виразки, що прискорює появу перфорації перегородки носа зазвичай в області зони Кіссельбаха (рис. 7).
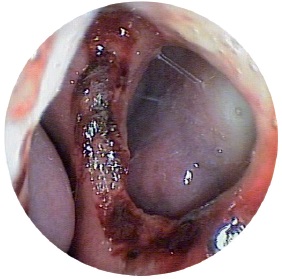
При передній риноскопії характерні широкі носові ходи, атрофії носових раковин можна побачити задню стінку носоглотки. У загальному носовому ході є густе жовто-зелене відділення, місцями воно прилипає до стінок слизової оболонки, висихає з утворенням кірок, які видаляються великими шматками і у вигляді зліпків при певному зусиллі.
До патології верхніх дихальних шляхів, що найбільш часто зустрічається, відносять запальні захворювання навколоносових пазух. За даними багатьох авторів, вони становлять близько 30% стаціонарної ЛОР-патології.
Найчастіше уражається верхньощелепна пазуха – верхньощелепний синусит, максиліт (гайморит), далі – запалення клітин решітчастого лабіринту – етмоїдит, запалення лобової пазухи – фронтит і, нарешті, клиноподібної пазухи – сфеноїдит.
У дітей, що найчастіше зустрічається захворюванням приносових пазух, є етмоїдит. Якщо є поєднане запалення кількох пазух полісинусит, поразка всіх пазух з одного боку гемісинусит, всіх пазух з обох боків пансинусит.
Доречно уточнити деякі терміни, що характеризують поразку приносових пазух.
Піосинус - скупчення натічного гною в пазусі (наприклад, затікання гною з клітин решітчастого лабіринту та лобової пазухи у верхньощелепну). Піоцеле - кістоподібне розтягування пазухи гнійним вмістом, мукоцеле - те саме, але зі слизовим вмістом, пневмосинус - з повітрям, гематосинус - з кров'ю.
Етіологія та патогенез. В етіології синуситів важливе значення мають фактори, зокрема анатомічні відхилення внутрішньоносових структур (викривлення гребені, шипи перегородки носа), а також гострий і хронічний риніт, аденоїдні вегетації (рис. 8.1 і 8.2). Важливими є несприятливі фактори зовнішнього середовища, зниження загальної та місцевої реактивності та супутні захворювання, при цьому створюються умови, що порушують аерацію та дренування приносових пазух.
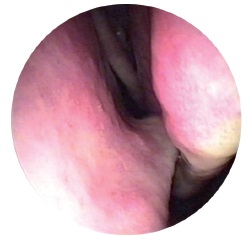
При мікробіологічному дослідженні патологічної флори верхньощелепної пазухи виявляють, перш за все, бактеріальну флору — пневмококи (Streptococcus pneumoniae), Haemophilus influenzae, Moraxella cataralis, staphylococcus aureus, гемолітичний стрептокок, кишкову. Рідше виявляють анаероби, дуже часто – змішану інфекцію, гриби, віруси.
Найчастіше уражається верхньощелепна пазуха. Певну роль при цьому грає і те, що співустя з носом розташована вгорі, що ускладнює відтік слизу.
У розвитку гострого та хронічного синуситу важливе значення має порушення секреторної та транспортної функції мукоциліарного апарату слизової оболонки порожнини носа.
При несприятливих умовах зовнішнього середовища (загазованість, пил, виробничі шкідливості) пригнічуються залізисті клітини і спрямований рух вій миготливого епітелію (мукоциліарного кліренсу), що призводить до застою слизу, порушення евакуації сторонніх тіл з порожнини носа і навколоносових пазух. , Провокує подальший розвиток в них інфекції та запалення.
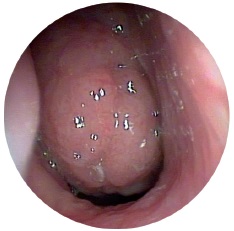
У патогенезі гострого синуситу патологоанатомічні зміни характеризуються катаральною чи гнійною формами запалення. При катаральній формі відбувається серозне просочування слизової оболонки та виражений її набряк. Маючи в нормі товщину до 1 мм, слизова оболонка при катаральному запаленні стає товще в десятки разів і може заповнити більшу частину пазухи. Вії миготливого епітелію зникають. Порушується архітектоніка власної платівки слизової оболонки, вона наповнюється, утворюються псевдокісти (рис. 9). На відміну від гнійного запалення, при катаральному – періостальний шар запальний процес не залучається. Гнійна форма синуситу має виражену інфільтрацію клітин всіх шарів слизової оболонки, головним чином лейкоцитами. У важких випадках запалення поширюється і на кістку, розвивається періостит, що спричиняє затяжний перебіг та перехід у хронічну форму захворювання, формування риногенних ускладнень.
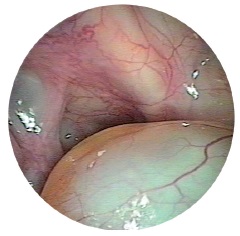
Патологоанатомічні процеси при хронічному запаленні приносових пазух відповідають його формам: ексудативні, продуктивні, альтеративні та змішані типи запальних реакцій. Ексудативні розвиваються при катаральному, серозному алергічному та гнійному, продуктивні при гіперпластичному, поліпозному та алергічному запаленні. Альтеративні зміни характерні для атрофічної та некротичної (остеомієлітичної) форм хронічного синуситу. Часто зустрічаються змішані форми захворювання та, відповідно, змішані типи патанатомічних змін.
Як гострий, так і хронічний процес, може проникнути з пазух через кісткові стінки численними венозними анастомозами або через кістковий каріозний дефект, що виник в результаті хронічного запалення кістки, в різні відділи черепа і загальний струм крові, зумовити флегмону орбіти, абсцеси мозку, сепсис.
Верхньощелепний синусит є найчастішою формою серед інших форм синуситу. Для його місцевих проявів характерні закладеність носа, відчуття розпирання та болю в ділянці відповідної пазухи. У разі порушення дренажної функції пазухи та підвищення в ній тиску біль може бути значним, іррадіювати в зуби, око, скроневу та лобову ділянку. При нахилі голови донизу біль зазвичай посилюється. Спостерігаються виділення із носа: спочатку серозні, а потім гнійні. Внаслідок закупорки слізно-носового каналу іноді виникає сльозогінність та світлобоязнь.
Нерідко хворі відзначають зниження нюху. Загальними симптомами є погіршення самопочуття, особливо у разі двостороннього порушення носового дихання, підвищення температури тіла, що супроводжується ознобом. При обстеженні іноді можна виявити припухлість щоки та біль при натисканні в ділянці собачої ямки. Під час передньої риноскопії визначається гіперемія та набряк слизової оболонки порожнини носа. Під середньою носовою раковиною можна знайти скупчення гною як смужки. Іноді поява гною може спостерігатися лише після анемізації слизової оболонки та нахилу голови у здоровий бік. Однак наявність гною в середньому носовому ході може бути обумовлено попаданням його не тільки з верхньощелепної, але і з лобової пазухи, передніх клітин лапки. Для уточнення діагнозу необхідно провести рентгенографію приносових пазух, комп'ютерну томографію, діагностичну пункцію верхньощелепної пазухи з її промиванням.
Хронічне запалення верхньощелепної пазухи у більшості хворих є продовженням гострого процесу. Найчастіше зустрічається гнійна, гнійно-поліпозна та поліпозна форми хронічного гаймориту, рідше – катаральна, серозна (алергічна) та пристінні – гіперпластична, рідко – холестеатомна, казеозна, некротична форми.
Скарги пацієнтів визначаються формою гаймориту. У разі ексудативного процесу однією з головних скарг є виділення з носа. При гнійному процесі – густий гній, часто із неприємним запахом. Якщо процес серозний (алергічний), то ексудат має рідкий характер, накопичується в пазусі і відходить порціями за умови нахилу голови вниз. На боці ураження відзначається утруднення дихання та порушення нюху респіраторного характеру.
Біль у ділянці пошкодженої пазухи відсутній або з'являється в період загострення процесу або у разі утруднення відтоку вмісту з пазухи. У разі загострення можуть спостерігатися підвищення температури тіла, поява хворобливої припухлості щоки та набряк повік, розлитого або локального головного болю.
Під час огляду входу в ніс іноді спостерігаються тріщини шкіри, ділянки мацерації, що утворюються в результаті постійного рясного виділення при ексудативній формі. Якщо відбувається підсихання виділень, у передніх відділах носової порожнини можуть утворюватися скоринки. Секрет, що випливає з пазухи, викликає запальний набряк слизової оболонки носа, створює схильність до утворення дифузних пухких гіпертрофій та виникнення набрякових поліпів, що виходять із середнього носового ходу. Вони поширюються у верхньощелепну пазуху або у бік носової частини горла, іноді утворюючи хоанальний поліп. Розрізняють справжні поліпи (без вмісту в них еозинофілів), але найчастіше утворюються поліпи на алергічному фоні з еозинофілами, які звуться алергійними гранульом.
Тривала емпієма верхньощелепної пазухи, що веде до метаплазії миготливого епітелію в плоский, може призвести до утворення холестеатоми. Вона може розвиватися за наявності одонтогенних запальних процесів.
Діагностика захворювання проводиться на підставі даних анамнезу, скарг та об'єктивного обстеження. Додатково хворим можуть виконуватися рентгенографія, термографія, КТ, діагностична пункція верхньощелепної пазухи, а у разі неясної картини захворювання – контрастна рентгенографія верхньощелепної пазухи (виконується оториноларингологам в умовах ЛОР-відділення). Патологічні виділення з носової порожнини та пазухи досліджуються на мікрофлору та її чутливість до антибіотиків. Необхідно пам'ятати про можливість одонтогенної природи захворювання, особливо за наявності гнійного процесу в корінні 4-6 верхніх зубів, верхівки яких прилягають до нижньої стінки верхньощелепної пазухи. Важливе діагностичне значення має ендоскопічне дослідження пазухи та ділянки її сполучення з носовою порожниною.
Аденоїдит (ретроназальна ангіна) – гостре запалення глоткової мигдалики, що зустрічається значно частіше у дітей, що пов'язано з розростанням у цьому віці аденоїдної тканини. У відносно поодиноких випадках ангіна глоткової мигдалики з'являється і у дорослих, коли ця мигдалина не зазнала вікової інволюції.
Етіологія. Причиною виникнення гострого аденоїдиту є активізація сапрофітної флори носоглотки під впливом переохолодження, вірусної інфекції, а також інших загальних інфекційних захворювань.
Клініка. Гострий аденоїдит у дітей раннього віку починається з підвищення температури тіла до 40 ° С і нерідко появи загальних симптомів інтоксикації, блювання, рідкого випорожнення. Носовий подих утруднений, з'являються слизово-гнійні виділення з носа, збільшуються регіонарні лімфатичні вузли, голос стає з носовим відтінком. Поява кашлю вказує на подразнення гортані та трахеї слизово-гнійним відокремлюваним з носоглотки, що може стати причиною трахеїту та бронхіту. Нерідко до гострого аденоїдиту приєднується ангіна тубарних мигдаликів, бічних валиків, лімфоїдних гранул глотки. Може приєднатися також євстахіїт, катаральний отит, ретрофарінгеальний абсцес.
При об'єктивному дослідженні на гіперемованій задній стінці ротоглотки видно характерну для цього захворювання смужку слизово-гнійного секрету, що стікає з носоглотки. Нерідко одночасно спостерігається гіперемія задніх піднебінних дужок. При передній риноскопії після анемізації слизової оболонки носа можна побачити гіперемовану та набряклу аденоїдну тканину, покриту слизово-гнійною плівкою. При задній риноскопії глоткова мигдалина різко набрякла, гіперемована, її поверхні можуть бути точкові або зливні гнійні нальоти. Загальний вигляд відповідає картині при катаральній, фолікулярній чи лакунарній ангіні.
Гострий гнійний середній отит (otitis media purulenta acuta) є гостре гнійне запалення слизової оболонки барабанної порожнини, при якому в катаральне запалення залучаються всі відділи середнього вуха.
Етіологія. Причиною захворювання є поєднання таких факторів, як зниження місцевої та загальної резистентності та потрапляння інфекції до барабанної порожнини. Через слухову трубу в барабанну порожнину нерідко потрапляє мікрофлора, що сапрофітує і не викликає запалення, якщо місцева та загальна реактивність організму знаходиться в межах норми. Основними збудниками гострого середнього отиту у дорослих є S. Pneumoniae та Н. influenzae, дещо рідше М. catarrhalis, S. pyogenes. S. aureus чи асоціації мікроорганізмів. Вірусні отити найчастіше спостерігаються при епідеміях вірусних захворювань.
Найчастіший шлях проникнення інфекції – тубарний через слухову трубу. У порожнинах середнього вуха нормі мікробної флори немає, що пояснюється бар'єрною функцією слизової оболонки слуховий труби. Тут продукується слиз, що має протимікробну дію, а ворсинки миготливого епітелію постійно переміщують слизовий секрет у напрямку до носоглотки. При різних загальних інфекційних захворюваннях, загострення гострих та хронічних локальних інфекцій, запальних захворювань верхніх дихальних шляхів захисна функція епітелію слухової труби порушується і мікрофлора може проникати в барабанну порожнину. Рідше інфекція потрапляє в середнє вухо через пошкоджену барабанну перетинку при її травмі або через пошкодження соскоподібного відростка. У цьому випадку говорять про травматичний середній отит. Порівняно рідко трапляється третій шлях проникнення інфекції в середнє вухо - гематогенний. Він можливий за таких інфекційних захворювань, як грип, скарлатина, кір, тиф, туберкульоз.
Патогенез. Гострий середній отит починається із запалення слизової оболонки слухової труби та барабанної порожнини. При цьому спостерігається набряк слизової оболонки та її лейкоцитарна інфільтрація. Слизова оболонка барабанної порожнини дуже тонка (0,1 мм) і є мукоперпост (тобто одне ціле з окістям), тому запальна реакція носить характер мукоперіоститу. В результаті різкого порушення функції слухової труби середнє вухо наповнюється ексудатом, який спочатку може бути серозним, а потім набуває гнійного характеру (рідкий, густий, тягучий). Слизова оболонка стає значно потовщеною (у десятки разів), на її поверхні виникають ерозії, виразки. У розпал запалення барабанна порожнина виявляється заповненою ексудатом, грануляціями та потовщеною слизовою оболонкою. При порушеній дренажній функції слухової труби це призводить до вибуху назовні барабанної перетинки. Внаслідок сильного тиску гнійного ексудату та розладу кровообігу часто настає розплавлення якоїсь ділянки та прорив барабанної перетинки з наступною отореєю.
Кількість гнійних виділень поступово зменшується та повністю припиняється. Після цього перфорація барабанної перетинки може мимоволі закритися, але закладеність вуха ще деякий час зберігається. Критерієм одужання є нормалізація отоскопічної картини та повне відновлення слуху.
Клінічна картина. Зазвичай гострий середній гнійний отит характеризується стадійністю течії. Місцеві та загальні симптоми захворювання виражені по-різному залежно від стадії та тяжкості процесу. Розрізняють три стадії гострого гнійного середнього отиту:
Однак далеко не завжди процес проходить всі три стадії. В результаті мобілізації захисних сил організму та при своєчасному проведенні адекватної терапії захворювання може придбати абортивний перебіг.
Доперфоративна стадія захворювання характеризується вираженими місцевими та загальними симптомами. Провідна скарга біль у вусі нерідко дуже різка, що віддає у скроню, темрява. Неухильно наростаючи, вона іноді стає болісною, нестерпною. Біль виникає внаслідок запальної інфільтрації слизової оболонки барабанної порожнини та скупчення в ній ексудату. При цьому відбувається подразнення рецепторних закінчень гілок трійчастого та язикоглоткового нервів. Іноді спостерігається болючість при пальпації та перкусії соскоподібного відростка, що обумовлено запаленням його слизової оболонки. Одночасно виникає закладеність, шум у вусі, як наслідок запалення та обмеження рухливості барабанної перетинки та ланцюга слухових кісточок. Зазвичай виявляється зниження слуху за кондуктивним типом.
Порушується загальний стан хворого: з'являються ознаки інтоксикації, підвищується температура тіла до 39 ° С, у периферичній крові виявляються характерні для запального процесу зрушення.
При отоскопії спочатку визначається ін'єкція судин у процесі рукоятки молоточка і радіальних судин перетинки, що супроводжується укороченням світлового конуса. Потім гіперемія барабанної перетинки наростає, стає розлитою, зникають її розпізнавальні пункти. Перетинка випинається, часто покривається білуватим нальотом. Тривалість початкової стадії гострого середнього отиту від кількох годин до трьох діб.
Перфоративна стадія характеризується проривом барабанної перетинки та появою гноєтечі. При цьому біль у вусі швидко вщухає, покращується самопочуття, знижується температура тіла. Виділення з вуха при цьому гнійного або слизово-гнійного характеру, іноді з геморагічним компонентом. У ряді випадків спостерігається так званий пульсуючий рефлекс, коли гній видно через перфорацію і синхронно пульсує пульсу пацієнта. Пульсуючий світловий рефлекс з'являється при відображенні пучка світла, який падає на краплю відокремлюваного перфорації.
Іноді потовщена слизова оболонка барабанної порожнини пролабує через перфорацію барабанної перетинки у вигляді утворення, що нагадує грануляцію. Через кілька днів кількість виділень зменшується, вони стають густими і набувають гнійного характеру. Гноетечение зазвичай триває до 7 днів. Перфорація при гострому середньому отіті зазвичай невелика, кругла з дефектом перетинки. Щілеподібні перфорації без дефекту тканини зустрічаються рідше. Найбільші перфорації бувають на тлі скарлатини, кору, туберкульозу.
Репаративна стадія характеризується як припиненням гноетечения, а й у переважній більшості випадків і спонтанним рубцюванням перфорації, відновленням слуху. Зникає гіперемія та інфільтрація барабанної перетинки, з'являється її блиск, стають помітними розпізнавальні контури. Невеликі перфорації (до 1 мм) закриваються досить швидко, не залишаючи жодних слідів. При великій перфорації середній фіброзний шар у місці дефекту зазвичай не регенерує і тоді, якщо перфорація все ж таки закривається, відновлюються епідермальний шар зовні і слизовий і зсередини. Ця ділянка виглядає атрофічною, витонченою. Перфорації округлої форми із вираженим дефектом часто не закриваються.
Типова течія гострого гнійного середнього отиту може бути змінена в будь-якій стадії процесу. У деяких випадках захворювання одразу набуває млявого, затяжного характеру із слабовираженими загальними симптомами. Перфорації барабанної перетинки не настає, а в барабанній порожнині накопичується в'язкий, густий секрет, який важко евакуювати. Після цього часто розвивається ліпкий (адгезивний) процес у барабанної порожнини.
У деяких пацієнтів, незважаючи на перфорацію барабанної перетинки, температура тіла не знижується і стан суттєво не покращується. Такий перебіг процесу пов'язаний зазвичай з активним поширенням запалення на соскоподібний відросток та розвитком мастоїдиту.
Витік гною, що не припиняється протягом тривалого часу (3-4 тижнів), коли після очищення вуха гнійний ексудат знову заповнює слуховий прохід, вказує на емпієму соскоподібного відростка (мастоїдит), при якому зазвичай настає розплавлення його кісткових перемичок.
Лікування хворого на гострий гнійний середній отит має бути диференційованим залежно від стадії захворювання, вираженості клінічних симптомів та враховувати особливості соматичного статусу пацієнта.
Мастоїдит є гнійним запаленням слизової оболонки і кісткової тканини соскоподібного відростка скроневої кістки.
Збудниками мастоїдиту є ті ж мікроорганізми, які викликають розвиток гострого середнього гнійного отиту. Це найчастіше ускладнення гострого середнього отиту. Зміни в соскоподібному відростку при мастоїдиті різні залежно від стадії захворювання. При 1-й ексудативній стадії процес залучаються слизова оболонка осередків соскоподібного відростка, осередки виконані ексудатом, слизова оболонка потовщена. Для другої стадії характерні проліферативно-альтеративні зміни, що поширюються і на кісткові структури соскоподібного відростка (стадія альтерації). При цьому відбувається руйнування кістки остеокластів, утворення грануляцій. Кісткові перемички між осередками некротизуються. Процес руйнування кістки може дійти до твердої мозкової оболонки середньої чи задньої черепної ямки. У цьому виникають грізні внутрішньочерепні ускладнення.
Можливе поширення гною в зону розташування 9-11 черепних нервів та внутрішньої яремної вени з розвитком парезів цих нервів та флебіту. Гній може піти у напрямку до глотки, внаслідок чого утворюється навколо-або заглотковий абсцес.
У новонароджених соскоподібний відросток, крім антруму, немає повітроносних клітин, тому гнійний процес з барабанної порожнини може поширюватися лише в антрум. Гнійно-запальний процес в антрумі та остеомієліт навколишньої кістки, отримав назву отоантриту. Якщо у новонародженого гострий гнійний середній отит приймає затяжний перебіг, слід передбачити наявність запалення антруму, особливо коли з'являється набряк м'яких тканин за вухом або симптоми субперіостального абсцесу. У разі на рентгенограмі видно затемнення антрума.
При латентній формі отоантриту спостерігається значна інтоксикація: порушення апетиту, блювання, лейкоцитоз, субфебрилітет. У той же час зміни барабанної перетинки можуть бути мінімальними. У діагностиці допомагають рентгенографія скроневих кісток, парацентез чи антропункція. Для перебігу латентного отоантриту характерні часті ремісії, що змінюються погіршенням загального стану, та зміни барабанної перетинки у вигляді помутніння, незначного випинання у задньоверхніх відділах.
Фарингіт – запалення слизової оболонки поверхні глотки. Існує дві форми фарингіту: гостра та хронічна. Гострий фарингіт зустрічається як у вигляді окремого захворювання, так і у вигляді одного з найчастіших проявів ГРВІ. Так, більшість ГРЗ протікає на тлі симптомів фарингіту. Запальний процес слизової глотки може бути спровокований запаленням ротової порожнини (в результаті карієсу) або носа (внаслідок риніту або синуситу). Гострий фарингіт виникає найчастіше при ураженні верхніх дихальних шляхів різними респіраторними вірусами. Нерідко причиною фарингіту є утруднене носове дихання, а також застосування судинозвужувальних крапель, що потрапляють з носової порожнини в горлянку і мають подразнювальну дію. Крім того, часто гострий фарингіт розвивається внаслідок впливу агресивних факторів навколишнього середовища: надмірно холодного або гарячого повітря, пари, тютюнового диму, алкоголю, рідин, газів, забрудненого повітря, хімічних агентів. До розвитку фарингіту можуть призвести також патологія серцево-судинної, дихальної систем та хвороби нирок.
За етіології гострий фарингіт поділяється на бактеріальний, вірусний, грибковий, травматичний (виникає внаслідок хірургічного втручання або потрапляння стороннього тіла), алергічний, викликаний дратівливими факторами (холодною або гарячою рідиною, повітрям, парою, опроміненням, хімічними речовинами: лугами).
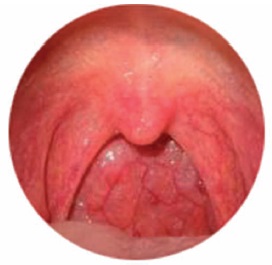
Клінічна картина. Основними симптомами гострого фарингіту є: 1) дискомфорт та першіння у горлі; 2) неприємні відчуття чи біль при ковтанні; 3) сухий кашель; 4) підвищення температури тіла (37,2-37,5 ° С); 5) загальне нездужання; 6) збільшення та болючість шийних лімфатичних вузлів. Біль у горлі зазвичай буває помірним, з'являються поколювання, першіння, особливо в момент сухого ковтка (ковтання слини). Під час їжі ці ознаки можуть слабшати, а при прийомі теплої їжі та рідини навіть тимчасово проходити. При поширенні запального процесу на тубофарингеальні валики біль, як правило, іррадіює у вуха. Якщо процес запалення включені піднебінний язичок і задня стінка глотки, може бути відчуття грудки в горлі. Іноді може відчуватись стікання по задній стінці глотки надлишкової кількості прозорого слизу, що провокує кашель. Кашель при фарингіті може бути пов'язаний із залученням у процес запалення слизової оболонки гортані або верхніх дихальних шляхів, а також обумовлений виділеннями з носа (постносове затікання секрету). Дихання ротом через закладеність носа призводить до відчуття сухості в роті, особливо в першій половині дня. Виділення з носа, як правило, в'язкі, слизові, білі або жовто-зелені, що не завжди свідчить про бактеріальну етіологію фарингіту. При фарингіті також характерний неприємний запах із рота, може відзначатися головний біль.
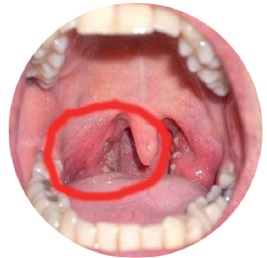
Фарингоскопія (рис. 10) виявляє почервоніння піднебінних дужок, задньої глоткової стінки, запалені лімфоїдні гранули. Запалення піднебінних мигдаликів (характерного для ангіни) немає. Гостра форма фарингіту може бути не самостійним захворюванням, а одним із перших симптомів таких інфекційних патологій, як скарлатина, кір, корова краснуха. При необхідності призначається диференціальна діагностика із синдромом Стівенса-Джонсона та хворобою Кавасакі.
Хронічна форма фарингіту у дітей відзначається рідко, оскільки виникає через постійне подразнення слизової глотки внаслідок куріння, вживання алкогольних напоїв, впливу холодного повітря, пилу, хімічних речовин, газів, закидання кислого вмісту зі шлунка під час сну, рецидивуючих запальних захворювань глотки, мигдалин. , носа, органів травлення, порушення системного та місцевого імунітету, вимушеного дихання через рот та ін. У деяких випадках хронічний фарингіт пов'язаний з порушеннями діяльності ендокринної та гормональної систем (захворювань щитовидної залози, клімактеричного синдрому), обмінних порушень (діатезу, цукрового діабету).
Класифікація хронічного фарингіту базується на характері змін у слизовій оболонці глотки, у зв'язку з чим виділяють такі форми захворювання: 1) проста або катаральна; 2) атрофічна чи субатрофічна; 3) гіпертрофічна. Однак ці форми рідко зустрічаються в чистому вигляді, оскільки можуть часто поєднуватися між собою.
Клінічна картина хронічного фарингіту переважно аналогічна прояву гострої форми захворювання. При цьому у пацієнтів також спостерігаються першіння та сухість у горлі, нерідко – відчуття грудки, що веде до постійного бажання прочистити горло, відкашлятися. Відчуття дискомфорту в горлі виникає через утворення слизу на її задній стінці і необхідність її ковтати, що призводить до порушення звичайного порядку дня, втрати сну, внаслідок чого з'являється нервова напруга, хворі стають дуже дратівливими. Відмінною особливістю клініки хронічного фарингіту є підвищення температури тіла і значного погіршення самопочуття. Атрофічний фарингіт призводить до витончення та сухості слизової оболонки глотки. При обстеженні на ній помітні сліди засохлого слизу, а блискуча поверхня її покрита ін'єктованими судинами. Гіпертрофічна форма захворювання характеризується наявністю вогнищ гіперплазії лімфоїдної тканини. При фарингоскопії виявляється помітне збільшення або безладне розташування тубофарингеальних валиків, що знаходяться за задніми піднебінними дужками. У гострі періоди захворювання слизова оболонка набрякає, спостерігається її гіперемія.
Первинні ангіни. Серед гострих тонзилітів найбільш поширені катаральна, лакунарна та фолікулярна ангіни (синонім – стрептококова ангіна). Найчастіше хворіють діти віком від 3 до 7 років. Найчастіше збудником ангіни є β-гемолітичний стрептокок групи А, який може проникнути в мигдалики від хворої людини повітряно-краплинним або побутовим шляхом.
Часто ангіна може розвинутись за умови активізації аутоінфекції, що міститься у криптах мигдаликів у здорових осіб. Крім інфекції, важливе значення мають умови, що призводять до зниження функції ІС організму (загальне охолодження, локальне переохолодження ніг чи рук, вживання холодних напоїв чи продуктів тощо). У виникненні ангіни має значення екзогенний чи ендогенний гіповітаміноз, перевтома, недосипання.
Перебіг катаральної ангіни порівняно легкий. Спочатку з'являється почуття жару, дряпання, сухості та біль у горлі. Хворі скаржаться на слабкість, розбитість, їх турбує біль голови. У більшості хворих температура тіла підвищується до субфебрильних цифр. Діти молодшого віку катаральна ангіна нерідко супроводжується температурою тіла до 38°З і вище. Піднебінні мигдалики дещо збільшені, гіперемовані, на шиї пальпуються збільшені та малоболючі регіонарні щелепні лімфовузли. Тривалість захворювання – 3-5 днів.
Фолікулярна та лакунарна ангіни протікають з яскравішою клінічною картиною. Після короткого продромального періоду із загальним нездужанням та субфебрилітетом, протягом декількох годин у хворих підвищується температура тіла до 38-39°С, посилюється біль у горлі. У осіб середнього та похилого віку, які раніше часто хворіли на ангіну, температура тіла може бути невисокою у зв'язку з розвитком гіпореактивності організму. Хворі скаржаться на загальну слабкість, головний біль, біль у попереку, кінцівках, м'язах. У багатьох пацієнтів відзначається виражений лейкоцитоз, підвищення рівня ШОЕ, альбумінурія, гематурія.
У хворих на лакунарну ангіну піднебінні мигдалики збільшені, і гіперемовані. Спочатку в області крипту з'являються білі нальоти, які, збільшуючись у площині, зливаються і можуть вкрити всю мигдалину, не виходячи за її межі. Нальоти легко знімаються без ушкодження покривного епітелію. При обох формах ангіни виявляються збільшені та болючі регіонарні лімфовузли. Тривалість фолікулярної та лакунарної ангін – до 7 днів.
Виразково-плівкова ангіна. Збудником захворювання є веретеноподібні палички та спірохета порожнини рота, які у симбіозі набувають вірулентних властивостей. Передумовами розвитку хвороби є зниження загальної та місцевої реактивності організму, наслідки перенесених гострих та хронічних інфекцій, захворювань кровотворних органів, гіповітамінозу. До місцевих причин відносять каріозні зуби, гінгівіт, стоматит. Ротовий тип дихання також сприяє розвитку захворювання.
На початку захворювання хворі скаржаться на відчуття стороннього тіла при ковтанні, слинотечу, гнильний запах із рота. Загальний стан суттєво не змінюється. Температура тіла може бути нормальною чи субфебрильною. У крові помірний лейкоцитоз зі збільшенням відсотка лімфоцитів та моноцитів. Рівень ШОЕ дещо збільшений – до 20 мм/год. При фарингоскопії в області верхнього полюса частіше однієї з піднебінних мигдаликів виявляють сірувато-жовтий наліт, який легко знімається, при цьому оголюється виразкова поверхня з нерівними краями, що трохи кровоточить. На боці виразки збільшені та різко болючі регіонарні лімфовузли. Тривалість захворювання від 2 до 4 тижнів, але процес може тривати кілька місяців.
Діагностика виразково-плівчастої ангіни здійснюється на підставі типової клінічної картини та виявлення у свіжому мазку веретеноподібних паличок та спірохет. Диференціальну діагностику варто проводити з виразковою формою раку мигдаликів, дифтерією глотки, сифілісом та туберкульозом, хворобою Вегенера.
Хронічний тонзиліт може бути специфічним та неспецифічним. Специфічний хронічний тонзиліт є поразкою мигдаликів інфекційними гранульомами (туберкульозом, сифілісом, склеромою). Хронічний неспецифічний тонзиліт є захворюванням інфекційно-алергічного характеру з місцевими проявами як стійкої запальної реакції мигдалини.
Важливість цієї проблеми визначається насамперед великою частотою захворювання. Так, за даними різних авторів, вона коливається від 2 до 15% випадків. З хронічним тонзилітом пов'язане виникнення та погіршення перебігу цілого ряду захворювань серцево-судинної системи, нирок, суглобів, тиреотоксикозу.
Домінуюче місце в етіології хронічного неспецифічного тонзиліту займає асоціація гемолітичного стрептокока групи А, стафілокока та аденовірусів. Формування вогнища хронічного запалення в мигдаликах та розвиток тонзилогенного процесу в організмі відбувається внаслідок тривалої взаємодії інфекційного агента та макроорганізму. Пусковим моментом є порушення помпового механізму мигдаликів. Порушується дренаж лакун та їх вміст накопичується у надмірній кількості. Лакуни кістозно розширюються, у них утворюється гній, казеозні маси. Це призводить до тривалого контакту мікробної флори з лімфаденоїдною тканиною.
До зниження загальної та місцевої реактивності організму ведуть такі фактори:
З осередку інфекції бактерії потрапляють у крипти мигдаликів, виникає регіонарний лімфаденіт, що погіршує відтік лімфи з мигдаликів. Це сприяє виникненню хронічного тонзиліту. Сприяючим фактором є і утруднення носового дихання будь-якої етіології.
При хронічному тонзиліті до патологічного процесу залучається нервовий апарат мигдаликів. Патологічні зміни нервових елементів призводять до спотворення рецепторної функції мигдаликів та нервово-рефлекторного зв'язку їх із деякими внутрішніми органами, зокрема із серцем. Зміни нервового апарату, впливаючи на трофіку лімфоїдної тканини, посилюють викликані хронічним тонзилітом функціональні та структурні розлади мигдалин та поглиблюють порушення їхньої бар'єрної функції. Це сприяє розвитку стану декомпенсації. Відповідно до класифікації хронічного тонзиліту І.Б.Солдатова (1975), розрізняють компенсовану та декомпенсовану форми захворювання. При компенсованій формі є лише місцеві ознаки хронічного запалення мигдаликів. Декомпенсована форма поєднується із низкою патологічних станів організму.
Ознаки хронічного тонзиліту:
При встановленні діагнозу слід мати на увазі такі положення:
Декомпенсована форма хронічного тонзиліту характеризується не лише місцевими ознаками хронічного запалення мигдаликів, але й проявами декомпенсації у вигляді рецидивуючих гострих тонзилітів (ангін), паратонзилітів, паратонзилярних абсцесів, різних тонзилогенних ускладнень віддалених органів та систем.
Лікування хронічного тонзиліту залежить від його форми. Компенсований тонзиліт підлягає консервативній терапії, при декомпенсованій формі захворювання віддають перевагу оперативним методам лікування.
Ларингіт – це запалення слизової поверхні гортані. Запальний процес може захоплювати або всю слизову оболонку гортані (розлита форма ларингіту) або слизову оболонку надгортанника, голосових складок, стінок підголосової порожнини. До інфекційних причин розвитку ларингіту відносяться: респіраторні віруси, серед яких респіраторно-синтиціальний вірус, метапневмовіруси, парагрип, грип та аденовірус, а також бактерії, наприклад, пневмокок, гемофільна паличка та збудник кашлюку. Перелік неінфекційних причин захворювання включає алергічні захворювання, деформацію голосових зв'язок, вікову атрофію м'язів гортані, порушення носового дихання, травми гортані, переохолодження, перенапруження голосових зв'язок при співі, читанні лекцій і крику, куріння, вдихання парів деяких хімічних речовин, які подразнюють рефлюксну хворобу та ін.
Зустрічаються дві форми ларингіту: гостра та хронічна. Симптомами гострого ларингіту є: сухість у горлі, першіння, біль при ковтанні, кашель (спочатку сухий, потім – вологий), хрипкість голосу, у деяких випадках – відсутність голосу, субфебрильна температура тіла, головний біль, загальна слабкість. Зважаючи на частого одночасного розвитку ларингіту з ГРВІ з'являються характерні симптоми респіраторно-вірусної інфекції. Гострий ларингіт діагностують за допомогою збору скарг, даних анамнезу, огляду хворого, ларингоскопії, бактеріологічного дослідження матеріалу зі зіва тощо. При цьому в місцях запалення слизова оболонка гортані набрякає і набуває яскраво-червоного відтінку (рис. 11). При розвиненому гострому ларингіті слизова оболонка виглядає різко почервоніла; припухання сильніше виражено в області складок присінка. Із запалених, а отже, розширених судин може просочуватися кров, утворюючи на слизовій оболонці багряно-червоні крапки (що частіше зустрічається при ускладненому грипі). При ізольованій формі гострого ларингіту різке почервоніння та інфільтрація слизової оболонки можуть бути виражені лише у надгортаннику. Як правило, гострий ларингіт відбувається протягом 7-10 днів. У деяких випадках гострий ларингіт може призвести до таких ускладнень, як перихондрит гортанних хрящів, сепсис та флегмона шиї.
Хронічний ларингіт виникає в результаті гострого ларингіту, що періодично повторюється. Симптомами хронічного ларингіту є: кашель, першіння у горлі, хрипоту, періодична втрата голосу. Як правило, в іншому самопочуття хворого не погіршується, хоча в деяких випадках спостерігається слабкість та швидка стомлюваність. Хронічний ларингіт діагностується за допомогою анамнезу, ларингоскопії та біопсії (з метою диференціальної діагностики з пухлинами та сифілітичними ураженнями гортані). Розрізняють три форми хронічного ларингіту: катаральний, гіпертрофічний та атрофічний. При катаральному хронічному ларингіті слизова оболонка гортані стає яскраво-червоною, залози збільшуються і виділяють велику кількість секрету, у слизовій трахеї утворюється мокротиння. При гіпертрофічному хронічному ларингіті виявляється гіперплазія підслизової оболонки та епітелію гортані, а на голосових складках (у разі перенапруги голосу) утворюються вузлики. При атрофічному хронічному ларингіті слизова оболонка гортані стоншується і покривається кірками. При своєчасному виявленні та адекватному лікуванні катаральний хронічний ларингіт зазвичай добре виліковується. Гіпертрофічний та атрофічний хронічний ларингіт у більшості випадків незворотні.
Стенозуючий ларингіт часто діагностують у період початкового розвитку ГРВІ, до якої приєднується бактеріальна інфекція. Таке захворювання, як стенозуючий ларингіт у ранньому віці у дітей має особливо тяжкий перебіг. Першими ознаками стенозуючого ларингіту є підвищена температура, поява нав'язливого кашлю, що гавкає, що в результаті може призвести до набряку гортані (хибний круп). Через набряк вхід у горло звужується і у дитини розвивається асфіксія. Дитина неспокійна, голос осипає і навіть може зникнути. Шкірні покриви бліднуть, в акті дихання беруть участь допоміжні м'язи, роздмухуються крила носа, втягуються міжреберні проміжки. При цьому має місце виникнення рефлекторних спазмів, які виникають внаслідок утруднення дихання (через набряклість слизових оболонок та їх запалення).
Ларинготрахеїт – варіант розвитку захворювання, що характеризується запаленням гортані та початкових відділів трахеї. При ларингіті та ларинготрахеїті спостерігається захриплість аж до повної втрати голосу, сухість, першіння в горлі, сухий гавкаючий, кашлюкоподібний, рідше продуктивний кашель. Може спостерігатися скрута дихання, з'явитися синюшний відтінок шкіри, біль при ковтанні. Як ларингіт, так і ларинготрахеїт може бути гострим та хронічним. Останній виникає при не усуненні причин, що призвели до гострого ларингіту (ларинготрахеїту). Ларингіту та трахеїту протягом декількох днів часто передує назофарингіт. До інших симптомів, що супроводжують ларинготрахеїт, можна віднести: 1) хворобливість у м'язах, яка характерна для грипу, особливо на тлі захриплості, болю в горлі, що раптово з'явилися, лихоманки, ознобу, кашлю і головного болю; 2) лихоманку яка може бути присутня, але не є характерною для цього захворювання; 3) втома та нездужання, як прояв ГРЗ; 4) субкон'юнктивальні крововиливи, як наслідок затяжних нападів кашлю; 5) болючість і чутливість ребер як прояв травматичного міозиту, переломів ребер та розривів реберних хрящів у результаті важких нападів кашлю. Особливо небезпечний гострий стенозуючий ларинготрахеїт (хибний круп) у дітей, оскільки внаслідок меншого розміру гортані виникає небезпека сильного звуження голосової щілини та загроза зупинки дихання, що без своєчасної медичної допомоги може призвести до смерті дитини.
Гострий та рецидивуючий бронхіт належить до поширених захворювань, оскільки у світі їм щорічно захворює близько 5% загальної популяції, а щорічна звертання пацієнтів з ГБ за лікарською допомогою перевищує 5 млн. У європейських станах частота амбулаторних візитів з приводу0 на рік. ГБ частіше реєструється у дітей віком до 4 років та осіб старшої вікової групи. Так, поширеність ПРО серед дітей до 4 років становить 55/1000, з 6-річного віку цей показник неухильно зростає з 8/1000 до 41/1000 у популяції осіб, старших 74 років.
Нині немає загальноприйнятого визначення поняття ГБ. Робоча група Європейського респіраторного товариства (ERS, 2005) визначає його як гостре захворювання, що розвивається у пацієнта за відсутності хронічного захворювання легень і характеризується кашлем (продуктивним або непродуктивним), а також іншими скаргами або симптомами, що вказують на інфекцію нижніх відділів дихальних шляхів, задишка, хрипи в легенях, дискомфорт або біль у грудній клітці), і не має іншого пояснення, як, наприклад, синусит або бронхіальна астма.
У вітчизняній пульмонології частіше використовується інше визначення ГБ, згідно з яким він являє собою гостро або підгострий запальний процес в бронхах, що проявляється кашлем (продуктивним або непродуктивним), схильний до самообмеження і триває не більше 1-3 тижнів. Якщо ГБ протікає без клінічно виражених ознак обструкції, він позначається як гострий простий бронхіт, чи ГБ. При гострому обструктивному бронхіті запалення слизової оболонки бронхів супроводжується звуженням та закупоркою дихальних шляхів за рахунок набряку та гіперплазії слизової оболонки, гіперсекреції слизу або розвитку бронхоспазму. При цьому можливий поєднаний характер бронхообструкції. Виділяють також рецидивуючий бронхіт, при якому протягом року відзначається щонайменше 3 епізоди ГБ. В основі рецидивування ГБ лежить зниження мукоциліарного кліренсу внаслідок ураження миготливого епітелію, підвищеної в'язкості слизу, зміни діаметра бронхів, збільшення резистентності респіраторних шляхів, порушення місцевого або загального протиінфекційного захисту. Клінічно він протікає як гострого простого чи обструктивного бронхіту, рідше як епізодів повторного бронхіоліту.
Причиною ГБ найчастіше є інфекційні агенти, рідше – неінфекційні фактори. Значимість того чи іншого патогену залежить від наявності або відсутності епідемії гострих респіраторних захворювань, пори року, вакцинації від грипу, належності хворого до певної популяції. При інфекційній природі захворювання у 90% випадків ПРО викликається вірусами грипу А та В, парагрипу, риновірусами, респіраторними синцитіальними вірусами, корона-, адено-, риновірусами, а у 10% випадків – бактеріальною (типовою або атиповою) мікрофлорою. При цьому роль типової мікрофлори (S. pneumoniae, H. influenzae, S. aureus, M. catarrhalis) у виникненні ГБ має значення переважно у дітей та пацієнтів з імунодефіцитними станами. Значно важливішу роль у розвитку ГБ відіграє атипова (M. pneumoniae, C. pneumoniae) мікрофлора, а також Bordetella pertussis та B. рarapertussis, що підтверджується результатами комплексного мікробіологічного та серологічного досліджень поза сезоном епідемії ГРВІ. Загалом у хворих із ймовірним діагнозом ГБ не рекомендується проводити вірусологічні, серологічні дослідження та культуральний аналіз мокротиння, оскільки в рутинній клінічній практиці ідентифікувати збудників вдається вкрай рідко (16–29% випадків). Однак, навіть у разі ідентифікації патогенів ці дані не мають практичного впливу на характер лікування пацієнта.
У початковій фазі, особливо при вірусної етіології ГБ, захворювання розвивається швидко і може супроводжуватися лихоманкою, м'язовими болями, нездужанням, хоча нерідко ГБ протікає і з мізерною симптоматикою. При вірусних інфекціях інкубаційний період зазвичай становить 2-7 днів, а при захворюваннях, спричинених атиповими бактеріями, він триває довше. Поступовий початок, коли клінічна картина респіраторної інфекції розгортається протягом 2-3 днів або продовжується більше 5-10 днів, характерно для ГБ бактеріальної етіології. Необхідно відзначити, що в перші дні захворювання диференціальна діагностика між ГРВІ та ГБ утруднена. Проте збереження кашлю понад 5 днів свідчить про наявність ГБ. Внаслідок розвитку запального процесу в бронхах може підвищуватись реактивність дихальних шляхів, що зумовлює посилення кашлю, появу задишки, утруднення дихання та хрипів у легенях при аускультації. Наявність гіперреактивності дихальних шляхів підтверджується результатами вивчення функції зовнішнього дихання.
Найбільш важливою клінічною ознакою ПРО є кашель. У типових випадках тривалість його становить до 10–20 днів. У випадках же збереження кашлю у хворого з ПРО більше 3 тижнів слід думати про підгострий постінфекційний кашель після перенесеної вірусної або бактеріальної інфекції (наприклад, викликаної M. pneumoniae або C. pneumoniae), за відсутності змін на рентгенограмі грудної клітки, що дозволяє виключити у пацієнта з пневмонією. За збереження кашлю більше 8 тижнів діагноз постінфекційного кашлю має бути переглянутий на користь інших захворювань. Близько половини пацієнтів відкашлюють гнійне мокротиння, що часто змушує лікаря подумати про наявність у пацієнта пневмонії, але діагностична цінність цієї ознаки невисока і становить близько 10%.
ГБ зазвичай діагностується на підставі перелічених вище клінічних ознак. Принципове значення має розмежування ГБ та позалікарняної пневмонії (ПП). Такі симптоми, як кашель, відходження мокротиння, утруднене дихання, задишка, притаманні обох захворювань. На можливу ПП можуть вказувати такі ознаки: почастішання пульсу понад 100 уд/хв., лихоманка (температура тіла >38°C), задишка понад 24 дих/хв., при аускультації – крепітація або дзвінкі вологі хрипи над обмеженою ділянкою легеневого поля. У таких випадках рекомендується рентгенологічне дослідження органів грудної клітки. Відхаркування мокротиння жовтого або зеленого кольору не завжди свідчить про приєднання бактеріальної інфекції, оскільки може бути обумовлено виділенням відкинутого епітелію. З лабораторних ознак ПП найбільше значення має лейкоцитоз та С-реактивний білок. Так, при збільшенні числа лейкоцитів у периферичній крові (≥10,4 х 109/л) ймовірність ПП зростає в 3,7 раза, тоді як відсутність цієї ознаки вона знижується в 2 рази. Підвищення вмісту С-реактивного білка в крові ≥50 мг/л асоціюється зі збільшенням ймовірності ПП вже в 5 разів.
Проблема лікування пацієнтів, які страждають на часті ЗОД, є дуже актуальною для практикуючих лікарів різних спеціальностей. Як правило, рецидивні та хронічні вірусні та бактеріальні інфекції дихальних шляхів (ДШ) пов'язані з порушенням функціонування ІС та формуванням вторинної імунної недостатності (ВІН). Кожен рецидив інфекцій ДШ збільшує ризик розвитку їх ускладнень та хронізації, а також збільшує прямі та непрямі витрати на відновлення здоров'я. Наслідки рецидивуючих інфекцій верхніх та нижніх ДШ дихальних шляхів різноманітні та досить серйозні. До них можна віднести: відсутність у дитячому садку, школі та на роботі, регулярне вживання антибіотиків, розвиток у зв'язку з цим бактеріальної резистентності, ускладнень антибактеріальної терапії (дисбактеріоз, діарея та ін.), індукція медикаментозної алергії, вживання інших препаратів, підвищення вартості лікування, розвиток ускладнень, формування синдрому ВІН, зниження якості життя та ін. У цій ситуації застосування імуномодуляторів сприяє суттєвому зниженню ризику розвитку інфекцій ДШ, зменшенню частоти їх рецидивів та хронізації, полегшенню клінічного перебігу, корекції ВІН та суттєвому підвищенню ефективності лікування та якості життя пацієнтів.
ВІН, яка особливо характерна для рецидивуючих інфекцій ОД, називається сукупність ознак порушення ІВ, що розвиваються в пізньому постнатальному періоді або у дітей старшого віку та дорослих. Клінічно ВІН проявляється захворюваннями із затяжним, часто рецидивуючим або хронічним перебігом, резистентними до традиційної терапії, приєднанням ускладнень, етіологічною роллю умовно-патогенної мікрофлори та ін.
ВІН може бути:
Виділяють такі форми ВІН:
Оскільки для рецидивуючих інфекцій ОД характерніша інфекційна форма ВІН, то ми приділимо увагу саме їй.
До основних клінічних проявів інфекційного синдрому ВІН відносяться:
Для діагностики ВІН використовуються клінічні (збір імунологічного анамнезу, фізикальне обстеження) та лабораторні імунологічні методи дослідження. Слід підкреслити, що пріоритетом при цьому є саме традиційні клінічні методи діагностики ВІН, які дозволяють не тільки виявити наявність ВІН, а й навіть визначити ту ланку ІС, яка найбільше порушена у пацієнта.
Клінічні орієнтири для уточнення порушень імунітету:
Фізіологічною основою розвитку частих ГРЗ в дітей віком вважають транзиторну недостатність місцевого імунітету слизової оболонки дихальних шляхів. Вторинна недостатність місцевого імунітету призводить до частих ГРЗ, останні – ще більшого зниження місцевого імунітету слизової оболонки дихальних шляхів внаслідок недостатності місцевих чинників захисту. Це посилює недостатність імунного захисту слизової оболонки, ускладнює лікування та призводить до ще більш частих ГРЗ. Недостатність захисту від позаклітинних патогенів призводить до частого приєднання бактеріальної інфекції до вірусної. Хронічні осередки інфекції, хронічні та рецидивні захворювання дихальних шляхів або часті ГРЗ порушують мукоциліарний кліренс, що призводить до зниження елімінації мікроорганізмів з поверхні слизової оболонки. Найчастіше такі діти виявляють зниження рівня секреторного sIgA. Додатковими факторами може бути зниження концентрації лізоциму в секреті слизової оболонки, зниження транзиторного рівня лімфоцитів, зниження інтенсивності фагоцитозу. Особливо це стосується дітей віком 2-6 років. Характерною особливістю цього вікового періоду є висока активність проліферативна лімфоцитів. При цьому фракція недиференційованих лімфоцитів у дітей більша, ніж у дорослих, крім цього спостерігається вищий рівень клітинної цитотоксичності. Саме в цьому віці і відбувається переорієнтація імунної відповіді на інфекційні антигени з переважанням Th2-шляхів відповіді, властивих плодам, новонародженим та дітям перших місяців життя, на Th1-відповідь, типову для інфекційного процесу у дорослих. Якщо такий перехід не відбувається своєчасно, це надалі призводить до підвищеного вироблення IgE з подальшим розвитком атопії.
В результаті низки клінічних досліджень виявлено, що у розпал хвороби у ЧДБ дітей титр циркулюючих антитіл нижчий, ніж у дітей, які рідко хворіють, при цьому відзначається також лімфопенія. У більшості ЧДБ дітей знижується рівень інтерферону в сироватці крові, а у переважної більшості з них виявляють низький рівень термолабільних інгібіторів. Хворі цієї групи мають достовірно нижчі титри лейкоцитарного інтерферону, ніж діти, що епізодично хворіють, що послаблює неспецифічний противірусний захист. Результати цілеспрямованих досліджень останніх років свідчать, що 35% дітей з частими ГРВІ відзначають низьку продукцію ендогенного інтерферону, продукція якого в організмі дитини є важливим компонентом повноцінної імунної відповіді як при вірусних, так і при бактеріальних інфекціях. Зокрема, γ-інтерферон є важливим протизапальним цитокіном, що виробляється активованими Т-лімфоцитами та НК-клітинами, підвищує ефективність презентації антигенів та сприяє їх розпізнаванню Т-лімфоцитами.
Основними клініко-імунологічними критеріями порушень функції ІС у дітей з рецидивними бронхолегеневими захворюваннями є:
Крім вікової фізіологічної незрілості факторів місцевого імунітету, для дітей з рецидивуючими респіраторними інфекціями характерно:
Респіраторні інфекції без адекватного лікування часто приймають затяжний або ускладнений перебіг, а без проведення відповідних профілактичних заходів часто рецидивують, особливо у дітей із ознаками порушення функції ІС. Найбільш фізіологічною та ефективною профілактикою рецидивуючих інфекцій ОД, без сумнівів, є формування власної адекватної імунної відповіді, чому сприяє здоровий спосіб життя, раціональний режим дня, повноцінне харчування, заняття фізичною культурою та спортом, загартовування. Оскільки провідну роль у патогенезі частих і рецидивуючих ЗОД у дітей належить різним дефектам функціонального стану ІС, то крім вищезазначених загальнозміцнювальних заходів слід використовувати можливості сучасних методів специфічної та неспецифічної імунокорекції та імунореабілітації.
Імунореабілітація – це наукове поняття, яке було запроваджено понад 20 років тому і за ці роки пройшло шлях від «східної казки» до всесвітнього визнання. Питання імунореабілітації сьогодні займають значне місце у професійній діяльності фахівців різного профілю. Інтерес лікарів до імунотропної терапії збільшився у зв'язку з підвищенням поширеності хронічної інфекційної патології, що викликається умовно-патогенними (або опортуністичними) мікроорганізмами з атиповими біологічними властивостями та стійкістю до антибіотиків, збільшенням кількості алергічних захворювань, онкопатології. Очевидним є факт зниження імунологічної реактивності у населення та необхідності використання в комплексі лікування методів імунореабілітації. В даний час під імунореабілітацією мається на увазі відновлення здатності ІС здійснювати захисні та регуляторні функції з метою усунення клінічних симптомів імунопатології. Відомо, що імунна відповідь – це єдиний процес клітинної взаємодії, зумовлений синергізмом таких ланок імунітету, як синтез цитокінів, експресія клітинних рецепторів, активація ферментів, розвиток клітинної сенсибілізації, синтез антитіл та нормальний гемостаз. Плануючи комплекс імунореабілітаційних заходів, лікар повинен чітко представляти механізм дисфункції ІС у тому чи іншому випадку імунопатології з метою адекватного призначення імунотропної терапії. До теперішнього часу розроблено багато способів та засобів, спрямованих на покращення функціонування ІВ, та їх популярність велика. Уточнимо термінологію, що визначає способи впливу на ІС пацієнта.
Включення в комплекс лікування препаратів хімічної або біологічної природи, що мають імунотропну активність, з профілактичною або терапевтичною метою називається імунотерапією. Імунокорекція – це виправлення дефектного функціонування ІВ, тобто. активне втручання з метою стимуляції чи супресії всієї системи чи окремих її ланок. Імунопрофілактика - це вплив на ІС з метою попередження первинних проявів клінічних ознак захворювання або початку рецидиву при його рецидивному або хронічному перебігу. Розрізняють специфічну та неспецифічну імунотерапію та імунопрофілактику. Неспецифічна дія на функцію ІС включає фактори, неспецифічні по відношенню до збудника (антигена) патологічного процесу. Специфічна дія обумовлена застосуванням препаратів антигенів (алергенів) або антитіл, специфічних до збудника (антигену, алергену) хвороби. Крім того, розрізняють активну імунотерапію (або імунопрофілактику), коли система імунітету активно відповідає на введений препарат (зазвичай антигени, вакцини), і пасивну, коли в організм вводять готові захисні імуноглобуліни. Залежно від механізму (або характеру) впливу на ІС виділяють два види імунотерапії та імунопрофілактики: стимулюючий та супресуючий. Імуностимуляція – це підвищення імунологічного захисту організму, імуносупресія – ослаблення патологічної імунної відповіді імунодепресантами або іонізуючим опроміненням, імуномодуляція – заходи щодо досягнення збалансованої імунної відповіді шляхом її стимуляції або супресії за допомогою різних впливів на ІС, імунопотенцію. Таким чином, сьогодні існує багато методів, здатних впливати на функцію ІС за допомогою імунотропних препаратів.
Для правильного призначення адекватної імунокоригуючої терапії необхідно мати чітке уявлення про механізм дисфункції ІС системи за різної патології, що не завжди можливе. У зв'язку з цим ставлення практикуючих лікарів до цього виду терапії нерідко діаметрально коливається від беззастережного визнання до небажання використовувати будь-які імунотропні засоби.
В даний час виділяють такі принципи імунокорекції:
В даний час пред'являється ряд основних вимог до імунотропних препаратів, які повинні мати: 1) доведені імуномодулюючі властивості; 2) високою ефективністю; 3) безпекою; 4) відсутністю протипоказань; 5) відсутністю канцерогенних властивостей; 6) відсутністю індукції імунопатологічних реакцій; 7) не викликати виражену сенсибілізацію та не потенціювати її в інших лікарських засобів; 8) легко метаболізуватися та виводитися з організму; 9) не вступати у взаємодію з іншими препаратами і мати високу сумісність з ними; 10) мати не парентеральні шляхи введення; 10) економічно вигідним курсом лікування; 11) мати зручну для застосування лікарську форму.
Існує кілька класифікацій імунотропних препаратів. Найчастіше використовується у клінічній практиці наступна класифікація (Г. Г. Данник, 2010):
Вищевказаним вимогам до імунотропних препаратів повною мірою відповідають пробіотики, вітаміни та мінерали. Як уже зазначалося, ІС є складно організованою багаторівневою структурою, що постійно реагує на численні екзогенні та ендогенні агенти, подразники, сигнали. Мікрофлора кишечника, вітаміни та мінерали є унікальною групою корисних мікроорганізмів та біологічно активних речовин, які значною мірою визначають збалансоване функціонування ІС та загальний стан макроорганізму. Швидкий темп сучасного життя, стреси, надмірне фізичне та психічне навантаження, різні соматичні та інфекційні захворювання, порушення харчування, функції кишечника, дисбаланс складу нормальної мікрофлори, дефіцит вітамінів, макро- та мікронутрієнтів, що особливо часто спостерігаються в дитячому віці, та інші фактори часто наводять до порушення функції ІВ, що потребує проведення відповідної корекції. Саме тому нижче буде розглянуто роль компонентів нормальної мікрофлори, вітамінів та мінералів у функціонуванні ІС, а також проаналізовано можливості використання з профілактичною та терапевтичною метою комплексних препаратів, що містять пробіотичні мікроорганізми, вітаміни, макро- та мікроелементи.
Завдяки дослідженням Луї Пастера та Іллі Мечникова стало зрозуміло, що нормальна мікрофлора травного каналу відіграє важливу роль у підтримці здоров'я організму господаря, беручи участь у різних метаболічних процесах, а також у формуванні та підтримці функціонування ІС, забезпеченні протиінфекційного захисту. В останні роки накопичено велику кількість даних про роль мікрофлори (мікробіоти, мікробіома) шлунково-кишкового тракту (ШКТ) у функціонуванні ІС та підтримці імунного гомеостазу. Проте, як і раніше, питання можливості використання пробіотичних препаратів для модуляції імунної відповіді, зокрема для посилення протиінфекційного імунітету, все ще залишається предметом дискусії, особливо в середовищі практикуючих лікарів. Частково це пов'язано з тим, що пробіотики різного складу та різних виробників відрізняються як за пробіотичними, так і за імунотропними ефектами. По-перше, між здатністю пробіотиків відновлювати розлади мікробіоти та їх імуномодулюючою активністю не завжди існує прямий зв'язок. По-друге, до складу ряду харчових добавок, крім симбіотичних бактерій, можуть входити і додаткові мікронутрієнти, що впливають тією чи іншою мірою на імунну відповідь. По-третє, ефективність пробіотиків багато в чому залежить від форм їх випуску, які в ідеалі повинні забезпечити високу біодоступність та доставку пробіотичних бактерій, що входять до їх складу, живими та у достатній кількості у необхідні відділи кишечника та ін.
Дитина та її довкілля утворюють єдину екологічну систему, що у біологічному рівновазі між макро- і мікроорганізмами. Число мікроорганізмів, що заселяють всі органи людського тіла, становить близько 1014, що приблизно в 10 разів більше за кількість власних клітин організму людини. Найзначніша частина (близько 60%) мікрофлори заселяє різні відділи шлунково-кишкового тракту, причому приблизно 15–16% посідає ротоглотку. Урогенітальний тракт, крім вагінального відділу (9%), заселений досить слабо (2%). Інша частина мікроорганізмів посідає шкірні покриви. У травному каналі знаходяться понад 500 різних видів мікроорганізмів із біомасою 2,5–3,0 кг. Більшість їх є різними штамами бактерій-комменсалів, якими тісно колонізований кишечник. Слизова оболонка кишечника з її криптами та ворсинками є найбільшим за площею бар'єром між зовнішнім і внутрішнім середовищем у людському організмі. Коменсальні мікроорганізми кишечника формують власну екосистему (мікробіому або мікробіоту), значення якої настільки велике, що деякі автори називають її «окремим органом усередині людського тіла». Нещодавно отримані дані щодо визначення бактеріального геному мікробіоти свідчать, що кількість генів нашого мікробіома більш ніж 150 разів перевищує таке в людини.
Разом про те, організм і мікрофлора становлять єдину екологічну систему, що у стані гомеостатичного рівноваги чи эубиоза. Найбільш важливими з представників мікрофлори є лактобактерії (Lactobacillus acidophilus) та біфідумбактерії (Bifidumbaсterium bifidum), що становлять основу облігатної (індигенної) флори (рис. 12 та 13). До цієї ж групи належать бактеріоїди, клостридії, ентерококи та кишкова паличка. Видовий склад цих мікроорганізмів генетично детермінований, а їх вміст у кишечнику є відносно постійним. При народженні у дитини в кишечнику відсутні Lactobacillus acidophilus, але надалі відбувається колонізація та швидке зростання цих мікроорганізмів. Bifidumbaсterium bifidum першими виявляються у новонароджених, які перебувають на природному вигодовуванні, потрапляючи в стерильний кишечник із грудним молоком. Пізніше інші бактерії (L. casei, L. fermentum, L. salivares, L. brevis) починають заселяти кишечник новонароджених в результаті його контакту з навколишнім середовищем. На відміну від облігатної, склад факультативної флори кишечника змінюється залежно від впливу тих чи інших чинників довкілля. Така факультативна флора представлена умовно-патогенними мікроорганізмами стафілококами, стрептококами, клостридіями, протеєм, дріжджоподібними грибами та ін. а також ефективність та адекватність протиінфекційної відповіді.

Слід підкреслити, що склад мікрофлори може бути нормальним лише при фізіологічному стані організму, проте її склад та функції можуть легко порушуватися, особливо в дитячому віці, що призводить до розвитку кількісних та/або якісних змін кишкового мікробіоценозу, а також появи мікроорганізмів у місцях, не властивих їхнього проживання. За даними сучасних епідеміологічних досліджень, від порушень мікробіоценозу кишечника в тій чи іншій мірі страждає 90% населення нашої планети, що пов'язано з нераціональним харчуванням, стресами, зниженням імунологічної реактивності організму, екологічними та фізико-хімічними факторами зовнішнього середовища, невиправданим та безконтрольним вживанням. (зокрема, антибактеріальні), які негативно впливають на мікрофлору організму. Наприклад, встановлено, що після перенесеної гострої кишкової інфекції за відсутності адекватної терапії дисбіотичні зміни у кишечнику зберігаються щонайменше 2-3 років. Особливо часто порушення мікробіоценозу кишечника спостерігаються у дітей першого року життя (70-80%) та новонароджених (80-100%). У віці старше 1 року вони спостерігаються у 60-70% дітей, а також у практично здорових дітей віком від 3 років – у 30-50% випадків.
В даний час встановлено, що до основних функцій кишкової мікрофлори належать:
У зв'язку з таким розмаїттям функцій інтестинального мікробіома (мікробіоти) в даний час одним із важливих підходів у профілактиці та комплексному лікуванні багатьох (особливо інфекційних та алергічних) захворювань вважають застосування пробіотиків – препаратів (продуктів), що містять у адекватній кількості певні види живих мікроорганізмів, які нормалізують склад та функцію мікрофлори (за допомогою імплантації або колонізації) організму, надаючи імунотропний та протиінфекційний ефекти. Надзвичайно важливим механізмом дії пробіотиків (третій рівень: взаємодія мікроб - ІВ) є їхня участь в активації захисних місцевих та загальних імунних реакцій, а також у формуванні імунологічної толерантності макроорганізму. Відомо, що слизова оболонка ШКТ має власну лімфоїдну тканину і відноситься до одного з незалежних компонентів ІВ, відомої як асоційована зі шлунково-кишковим трактом лімфоїдна тканина (gut associated lymphoid tissue - GALT). При нормальному її функціонуванні розчинні бактеріальні субстрати та частинки, розміром до 150 мкм, а також бактерії проникають у GALT двома шляхами: в результаті персорбції та за рахунок їх транспортування спеціальними М-клітинами, розташованими у слизовій оболонці кишки у зоні лімфоїдних фоліків. Надалі вони вступають у контакт з образ-розпізнаючими рецепторами епітеліальних та імунокомпетентних клітин, головним чином, з Toll-подібними рецепторами (TLR - Toll-like receptors), що розпізнають екзогенні та ендогенні чужорідні субстанції. В результаті цього за допомогою ланцюга послідовних біологічних сигналів включається продукція широкого спектру медіаторів прозапальних і протизапальних цитокінів, інтерферонів, регуляторних пептидів процесів регенерації та апоптозу та ін. Останні одночасно з антигенами активують незрілі В-лімфоцити з подальшим дозріванням та міграцією їх зі стінки кишки в лімфу, лімфатичні вузли, селезінку, в яких відбувається їхня активна проліферація, дозрівання та трансформація в плазматичні клітини, які синтезують секреторний IgA (sI). Надалі зрілі лімфоцити та плазматичні клітини з лімфоїдної тканини надходять у кров і розселяються у всіх слизових оболонках організму, при цьому до 80% їх кількості повертається в ШКТ (homing-effect), де вони забезпечують адекватний синтез sIgA і підвищують колонізаційну резистентність. . Аналогічні ефекти мають антигени нормальної мікрофлори, у тому числі й ті, що входять до складу пробіотиків.
Якщо захисна роль кишкової мікробіоти безпосередньо в травному каналі пов'язана з продукцією бактеріоцинів, підкисленням навколишнього середовища, утворенням біоплівки, конкуренцією з патогенами за поживні та ростові фактори, тобто колонізаційна резистентність, давно вже добре вивчені, то регуляція імунних реакцій поза ШКТ, зокрема ротової порожнини, респіраторному та урогенітальному трактах, доведені порівняно недавно. Так, в останні роки показано важливу роль кишкових бактерій-комменсалів у реалізації імунної відповіді проти вірусу грипу, у тому числі у дозріванні вірус-специфічних CD4+ та СD8+Т-лімфоцитів. Крім того, в експериментальних умовах виснаження мікробіоти внаслідок прийому внутрішньо антибіотиків суттєво знижувало стійкість до інтраназального інфікування вірусом грипу А та збільшувало летальність серед заражених тварин, що було пов'язано зі зниженням вираженості Т- та В-клітинних імунних реакцій, а також пригніченням функції та міграції денд клітин у респіраторному тракті. Отримані в експерименті дані збігалися з результатами клінічних спостережень, що свідчать про тяжіння перебігу грипу та інших ГРЗ/ГРВІ при невиправданому прийомі антибактеріальних засобів, що призводило до пригнічення стану мікробіоти.
Молекулярні механізми, за рахунок яких кишкові бактерії посилюють противірусну відповідь, різноманітні та пов'язані, по-перше, зі стимуляцією розпізнаючих Toll-подібних рецепторів (TLR), що мають різні функції. Так, TLR-2 розпізнають ліпотейхоєві кислоти та ліпопротеїни бактеріальних клітинних стінок. TLR-4/MD-2 є сенсорами ліпополісахаридів грамнегативних бактерій, TLR-9 розпізнають неметильовані СpG послідовності бактеріальної ДНК. При цьому ректальне введення лігандів TLR мишам відновлювало пригнічену антибіотиками противірусну імунну відповідь і стійкість до інтраназального зараження вірусом грипу А. Все це свідчить на користь того, що стимулюючі протиінфекційний імунітет сигнали, отримані в нижніх відділах шлунково-кишкового тракту, передаються на слиз. респіраторний тракт. По-друге, встановлена роль NOD-подібних рецепторів (NLR) і інфламасом, що вміщають їх, як сенсорів бактеріальних компонентів, що активують противірусну відповідь з боку ІС. Продукти деградації клітинних стінок бактерій-комменсалів, зокрема мурамілпептидів, як ліганди цих рецепторів, суттєво посилюють противірусний захист організму, зокрема від вірусів грипу. Доведені останніми роками основні механізми імунотропної дії пробіотиків наведені в таблиці 1.
|
Біологічна дія |
Механізми дії |
|---|---|
|
Антимікробна активність |
|
|
Покращення бар’єрної функції |
|
|
Імуномодуляція |
Дія на:
|
Таким чином, питання про можливість використання пробіотиків як імунотропних засобів можна вважати доведеним, оскільки отримані переконливі докази еволюційно закріпленої ролі мікробіоти ШКТ у регуляції імунного гомеостазу, а також можливість кількісно та якісно коригувати мікробіологічні та імунні показники при введенні симбіонтної бактерії. Відповідні дані представлені у таблиці 2.
Також останнім часом у клінічних умовах доведено можливості застосування пробіотиків для:
|
Позитивний ефект |
Механізми реалізації |
|---|---|
|
Стійкість до кишкових інфекцій |
|
|
Модулюючий вплив на місцевий (секреторний) імунітет |
|
|
Модулюючий вплив на загальний імунітет |
|
|
Зменшення алергічних реакцій |
|
|
Стійкість до урогенітальних інфекцій |
|
|
Ефект при захворюваннях, спричинених Helicobacter pylori |
|
|
Поліпшення засвоюваності лактози |
|
|
Ефект при печінковій енцефалопатії |
|
|
Антиканцерогенний вплив на товстий кишечник |
|
|
Вплив на рівень ліпідів крові, серцево-судинні захворювання |
|
Примітка: * PPAR (peroxisome proliferator-activated receptor) - рецептори, що активуються пероксисомними проліфераторами. Група ядерних рецепторів, які контролюють процес синтезу матричної РНК (фактор транскрипції).
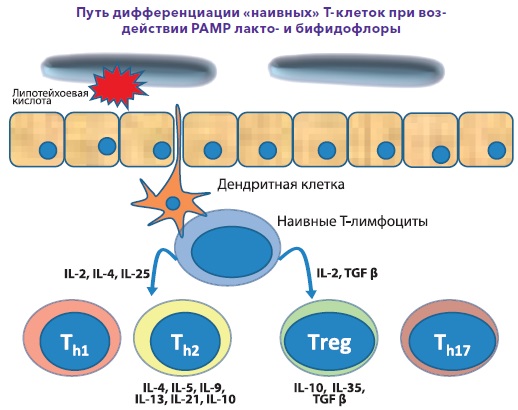
Таким чином, підсумовуючи вищевказані дані можна вважати, що імунотропна дія пробіотиків пов'язана з їх впливом на: 1) антимікробну активність (зниження рН навколишнього середовища, секреція протимікробних пептидів, пригнічення бактеріальної інвазії, запобігання адгезії патогенних мікроорганізмів); 2) поліпшення бар'єрної функції (збільшення продукції слизу, посилення цілісності епітеліального бар'єру) 3) власне імуномодуляція (дія на епітеліальні та дендритні клітини, моноцити/макрофаги, В-лімфоцити, NK-клітини, Т-клітини, що регулюють мукозальний та системний /Th1/Th17, міграцію та перерозподіл Т-лімфоцитів), що схематично відображено на рис. 14 та 15.
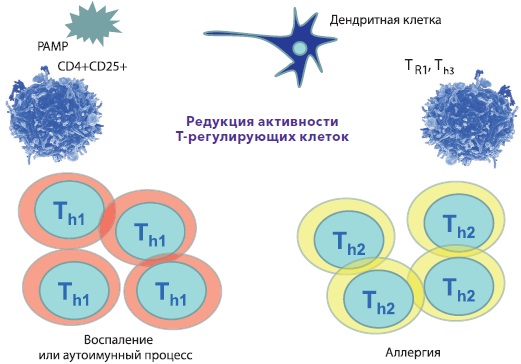
В останні роки увага дослідників у галузі імунології зосереджена на вивченні ролі у функціонуванні ІС дендритних клітин (DC), яке також залежить від стану мікрофлори кишечника. Так, дефект збудження дендритних клітин (зокрема, DC-specific intercellular adhesion molecule 3-grabbing nonintegrin) шлунково-асоційованої лімфоїдної тканини непатогенною флорою кишечника призводить до порушення активації IL-10-продукуючих TR1, що обумовлює переважання 2 алергічного процесу. Дефіцит індуктивної дії непатогенної флори кишечника обумовлює зниження активності CD4+CD25+Treg, що призводить у свою чергу до вираженої Th1 реакції, яка є основою розвитку хронічних запальних та аутоімунних захворювань. Тому вплив лакто- та біфідофлори на проліферацію Т-регулюючих клітин сприяє відновленню балансу Тh1/Th2 клітин, зумовлюючи становлення адекватної імунної відповіді та попереджаючи розвиток хронічних та рецидивуючих інфекційно-запальних, аутоімунних та алергічних захворювань. Лакто- та біфідофлора також індукує продукцію sCD83, який інгібує активність генів IL-13, тим самим попереджаючи IL-13-асоційовані реакції, що супроводжуються індукцією синтезу IgE, еотаксину, що активує хемотаксис еозинофілів, рекрутуванням Т-лістів.
Таким чином, взаємодія фізіологічної мікрофлори та ІС відбувається в основному в наступних напрямках:
Загалом сьогодні з упевненістю можна констатувати, що питання про можливість використання пробіотиків як засобів модуляції імунної відповіді вже трансформується з дискусійної в риторичну. Однозначність позитивної відповіді на це питання базується на переконливих доказах, по-перше, еволюційно закріпленої ролі мікробіоти ШКТ у регуляції імунного гомеостазу, по-друге, можливості кількісно та якісно коригувати мікробіологічні та імунні показники при введенні симбіонтних бактерій per os.
Розглядаючи сучасні пробіотики як імунотропні засоби, слід виділити низку феноменів, які характеризують цю групу препаратів та відрізняють їх від інших імунотропних препаратів. По-перше, це стійкість імунотропності дії, зумовлена власне пробіотичним ефектом. Нормалізація та стабілізація кількісних та якісних показників мікробіоти ШКТ, досягнуті в результаті курсового застосування пробіотиків, є фундаментом їх тривалого впливу на імунний гомеостаз. Інші імунотропні препарати, наприклад, рекомендовані для лікування та профілактики респіраторних інфекцій синтетичні імуномодулятори залишають лише короткочасний ефект після завершення їх застосування. По-друге, симбіонтні бактерії, що входять до складу комплексних пробіотиків, передають не лише сигнали, що активують протиінфекційний захист, а й сигнали толерантності до власних та чужорідних антигенів, що знижує ймовірність розвитку алергічних та аутоімунних захворювань. Завдяки таким толерогенним властивостям пробіотичних засобів при їх застосуванні мінімізовано ризик гіперстимуляції імунітету. По-третє, слід зазначити еволюційно закріплений механізм передачі сигналів стимуляції протиінфекційного захисту та толерантності до власних та чужорідних антигенів із ШКТ в інші біотопи організму, зокрема у слизові оболонки респіраторного тракту та сечостатевої системи. Цей феномен отримав назву "імунної солідарності слизових". Застосовуючи пробіотичні препарати, ми імітуємо природний шлях регуляції системних імунних реакцій, який обумовлений циркуляцією бактеріальних компонентів та продуктів, а також імунних медіаторів та клітин із ШКТ в інші органи та тканини нашого організму. Важливо те, що основні молекулярні механізми цього феномену, зокрема ліганд-рецепторні взаємодії, що зумовлюють міграцію імунокомпетентних клітин та дистанційну передачу сигналів, наразі вже розкрито.
В останні роки отримано цікаві дані про ефективність використання пробіотиків у профілактиці та лікуванні гострих та рецидивуючих респіраторних захворювань (ГРЗ та РРЗ). Так було в дослідженні M. de Vrese et al. (2005) при використанні комплексу пробіотичних бактерій (Lactobacillus gasseri PA 16/8, Bifidobacterium longum SP 07/3, B. bifidum MF 20/5) відмічено суттєве зниження виразності основних симптомів ГРЗ, зокрема, лихоманки, та середньої тривалості. При цьому провідним механізмом одержаних позитивних ефектів виявилася біоценоз-опосередкована активація клітинного імунітету, яка пов'язана з підвищенням рівня цитотоксичних T-лімфоцитів (CD8+) та T-хелперів (CD4+). В ході іншого дослідження (De Vrese M. et al., 2005) прийом мультипробіотичного комплексу (Lactobacillus GG, Streptococcus thermophilus, Lactobacillus acidophilus і Bifidobacterium) супроводжувався зниженням кількості потенційно патогенних бактерій на слизових оболонках верхніх дихачів. Дані досліджень С.А. Шишловой (2006) також свідчать про те, що нормалізація складу облігатної мікрофлори запускає комплекс імуно-опосередкованих реакцій, спрямованих на забезпечення повноцінного функціонування ІВ та формування адекватної імунної відповіді проти бактеріальних та вірусних патогенів. Крім того, позитивний вплив лакто- та біфідофлори на проліферацію Т-регулюючих клітин сприяє відновленню балансу Тh1/Th2 клітин, зумовлюючи становлення адекватної імунної відповіді та запобігаючи розвитку хронічних, рецидивуючих інфекційно-запальних, аутоімунних та алергічних захворювань.
Рецензенти Кокрановського співробітництва (Hattori M., Taylor T.D., 2009) проаналізували результати 10 рандомізованих плацебо-контрольованих клінічних досліджень за участю 3451 особи, у тому числі дітей різного віку та дорослих віком до 40 років. При цьому було встановлено, що пробіотики мають перевагу перед плацебо за такими критеріями: кількість учасників, які перенесли хоча б один епізод гострої респіраторної інфекції (ГРІ), у групі осіб, які отримували пробіотики, була меншою на 42%; перенесли ≥3 епізоди – менше на 47% порівняно з контрольною групою. Також особам, які приймали пробіотики, значно рідше (на 33%) доводилося вдаватися до антибіотикотерапії при лікуванні ГРЗ, і вони загалом на 12% рідше спостерігалися епізоди ГРЗ. Автори дійшли висновку, що застосування пробіотиків профілактує розвиток ГРІ.
Питання застосування пробіотичних культур в дітей віком, які відвідують дитячі дошкільні установи, на думку О.Н. Мисливцевої (2012), заслуговує на окрему увагу, оскільки останнім часом отримані докази того, що пробіотики також надають у цих випадках позитивний профілактичний ефект. Так, у 2010 році були опубліковані результати пацієнт-орієнтованого подвійного сліпого кластер-рандомізованого плацебо-контрольованого дослідження DRINK (Decrease the Rate of Illness in Kids), згідно з даними якого тривале (протягом 90 днів) вживання пробіотиків дітьми віком 3-6 років , які відвідували школу або дитячий садок (n=638), призвело до зниження захворюваності на їх інфекційну патологію на 19% порівняно з групою дітей, яка приймала плацебо (Merenstein D. et al., 2010). Цікаві результати щодо використання пробіотиків у лікуванні дітей з ГРВІ отримали також G.J. Leyer та ін. (2009). Так, 248 із 326 включених дітей завершили дане 6-місячне подвійне сліпе плацебо-контрольоване інтервенційне дослідження. Жодних значних побічних ефектів внаслідок прийому пробіотичних штамів немає. Вживання пробіотиків призводило до зниження частоти та тривалості лихоманки, ринореї, кашлю, а також кількості випадків призначення антибіотиків. У порівнянні з плацебо прийом одного штаму пробіотика знижував частоту лихоманки та кашлю, а комбінації двох штамів пробіотиків – частоту лихоманки, кашлю, ринореї та такого показника як «будь-який симптом». Важливо, що у групах дітей, яким призначалися пробіотики, відмічено достовірне зниження тривалості симптомів та кількості випадків застосування антибіотиків. З іншого боку, G.J. Meyer та ін. Вивчили питання про те, чи вплив одного пробіотичного штаму відрізнятиметься від комбінованої дії двох штамів. Згідно з отриманими ними результатами прийом одного штаму пробіотиків був ефективним, однак комбінація двох штамів мала більш виражений вплив, особливо на ринорею. Таким чином, було виявлено позитивний ефект профілактичного прийому L. acidophilus та B. lactis з метою зменшення частоти симптомів застуди та грипу. Застосування цих пробіотичних засобів може зменшити необхідність призначення медикаментозних препаратів для ослаблення симптомів ГРЗ. Особливої вагомості ці результати набувають у світлі останніх документів FDA (Агентства з контролю за лікарськими засобами та харчовими продуктами США), у яких рекомендовано не використовувати безрецептурні препарати проти кашлю та застуди у дітей віком до 2-4 років. Вплив пробіотиків на здоров'я за різних респіраторних захворювань широко досліджували й інші автори. У низці досліджень показано, що профілактичний прийом пробіотиків сприяє зниженню частоти чи тривалості захворювань у здорових осіб. K. Hatakka та ін. (2001) вивчали вплив Lactobacillus GG на здоров'я дітей, які відвідували дитячий садок. Після проведення корекції результатів віком не виявлено ефективності цього штаму. Z. Weizman та ін. (2005) оцінили вплив двох різних пробіотиків - Lactobacillus reuteri (ATCC 55730) і B. animalis subsp. lactis Bb-12 – при їхньому роздільному застосуванні у 4-10-місячних немовлят і зазначили, що в групі плацебо частота лихоманки була вищою. Крім того, у групі дітей, які приймали L. Reuteri, показано зниження частоти призначення антибіотиків. Однак не виявлено різниці у частоті респіраторних симптомів, чому суперечать дані, отримані GJ Leyer et al. (2009).
У дослідженнях Vrese M. de та ін. (2005, 2006) було показано, що застосування комбінації 3 пробіотичних штамів (Lactobacillus gasseri PA 16/8, Bifidobacterium longum SP 07/3 і Bifidobacterium bifidum MF 20/5) разом з вітамінами і мінералами у здорових, але її частоту. Пробіотики також знижували частоту діареї у дітей (Weizman Z. et al., 2005; Pedone C.A. et al., 2000). У дослідженні GJ. Leyer та ін. (2009) частота діареї була низькою, тому виявити вплив пробіотиків на неї було неможливо. Це дослідження є першим, в якому було описано, що вживання пробіотиків (L. acidophilus NCFM або комбінація L. acidophilus NCFM з B. animalis subsp. Lactis Bi-07) знижує як частоту, так і тривалість таких симптомів, як лихоманка, кашель, ринорея у дітей Також у цій роботі підтверджено опубліковані раніше дані про те, що пробіотики знижують частоту застосування антибіотиків за всіма показаннями (Weizman Z. et al., 2005). З іншого боку, G.J. Leyer та ін. (2009) вперше показали тенденцію до більш високої ефективності комбінації штамів ніж одного штаму. Зниження потреби у прийомі антибіотиків у ранньому дитинстві має потенційну клінічну користь, наприклад, зниження частоти побічних реакцій, витрат сім'ї та суспільства, ризику розвитку антибіотикорезистентності. Розглядаючи механізми, за допомогою яких відбувається зниження частоти респіраторних симптомів та використання антибіотиків, ймовірним поясненням може бути насамперед імуностимулююча дія пробіотиків. Підтвердженням цього є результати великої кількості досліджень, у яких було показано, що пробіотичні штами бактерій модулюють імунну відповідь через толл-подібні рецептори. P. Winkler та ін. (2005) показали, що пробіотики у поєднанні з вітамінами та мінералами знижували тривалість та тяжкість симптомів застуди, а також посилювали клітинний імунітет. Слід зазначити, що GJ. Leyer та ін. (2009), вибираючи штами пробіотиків для дослідження, врахували властивість L. acidophilus та B. lactis стимулювати регуляторні функції дендритних клітин. У таблиці 3 наведено результати досліджень з достатньою доказовою базою, переважна більшість з яких продемонструвала ефективність та безпеку використання пробіотиків при респіраторних інфекціях у пацієнтів дитячого та дорослого віку. Хоча слід зазначити, що дослідження у цьому напрямі необхідно продовжувати.
|
Автори дослідження |
Учасники |
Тип(и) пробіотиків |
Тривалість (тип) дослідження |
Результати дослідження |
|---|---|---|---|---|
|
Захворювання респірвторного тракту |
||||
|
De Vrese et al., 2005 |
479 дорослих |
Суміш L. gasseri, B. longum, B. bifidum |
3-5,5 міс. (Р, ДС, ПК) |
|
|
Winkler et al., 2005 |
477 |
Смесь L. gasseri, B. longum, B. bifidum |
3-5,5 міс. (Р, ДС, ПК) |
|
|
Cox et al., 2008 |
20 |
L. fermentum |
30 днів (ДС, ПК, перехресне) |
|
|
Weizman et al., 2005 |
201 |
B. animalis або L. reuteri |
12 тижнів (Р, ДС, ПК) |
|
|
Marseglia et al., 2007 |
80 дітей |
B. clausii |
90 днів (Р, ПС, ПК) |
|
|
De Araujo et al., 2015 |
2741 дитина до 10 років |
Гетерогенні лакто- та біфідобактерії |
Метааналіз 11 РКІ |
|
|
Lenoir-Wijnkoop et al., 2015 |
Дорослі і діти |
Гетерогенні лакто- та біфідобактерії |
Математичне моделювання |
|
|
ЛОР-інфекції |
||||
|
Hatakka et al., 2007 |
309 дітей, схильних до отиту |
Суміш L. rhamnosus GG, L. rhamnosus LC705, B. breve 99, P. freudenreichii ssp. shermanii JS |
6 міс. |
|
|
Roos et al., 2001 |
108 дітей, схильних до отиту |
Суміш Streptococcus mitis, Streptococcus sanguis, Streptococcus oralis (назальний спрей) |
10 днів |
|
|
Roos et al., 1993 |
36 |
Суміш S. sanguis та S. mitis (оральний спрей) |
10 днів (Р, ДС, ПК) |
|
|
Roos et al., 1996 |
112 |
Суміш S. sanguis та S. mitis (оральний спрей) |
10 днів (Р, ДС, ПК) |
|
|
Falck et al., 1999 |
342 |
Суміш S. sanguis та S. mitis (оральний спрей) |
10 днів (Р, ДС, ПК) |
|
|
Quick, 2015 |
3720 дітей та дорослих |
Гетерогенні лакто- та біфідобактерії |
Метааналіз 13 РКІ |
|
|
Bernal- Orozco et al., 2015 |
59 дорослих з рецидивуючими ГРЗ |
Пробіотики, вітаміни, мікроелементи |
Р |
|
Примітка: ПС – напівсліпе дослідження; ПК - плацебо-контрольоване дослідження; ДС – подвійне сліпе дослідження; Р – рандомізоване дослідження; РКД – рандомізоване клінічне дослідження.
Особливо слід зазначити результати останніх досліджень щодо вивчення можливостей застосування пробіотиків, а також їх комбінацій з вітамінами та мінералами у профілактиці гострих інфекцій ОД. Так, 2 нещодавні метааналізи Йоркського консорціуму економіки охорони здоров'я та Кокранівської співпраці продемонстрували ефективність застосування пробіотиків у зниженні тривалості та кількості епізодів інфекцій респіраторного тракту та пов'язаних з ними призначень антибіотиків (I. Lenoir-Wijnkoop et al., 2015). Огляд результатів 11 рандомізованих контрольованих досліджень серед 2417 дітей віком до 10 років показав зниження кількості нових епізодів респіраторних інфекцій на фоні прийому пробіотиків (G.V. de Araujo et al., 2015). Ще в одному Кокранівському огляді (М. Quick, 2015) пробіотики продемонстрували ефективність порівняно з плацебо у зниженні числа та середньої тривалості епізодів респіраторних інфекцій, частоти прийому антибіотиків, а також кількості днів відсутності дітей у школі через застуду. Результати радомізованого подвійного сліпого паралельного контрольованого плацебо клінічного дослідження дозволили стверджувати, що застосування комплексу пробіотиків, вітамінів та мінералів знизили захворюваність на ГРЗ у сприйнятливих до них дорослих пацієнтів (M. F. Bernal-Orozco et al., 2015).
Питання про те, чи всі пробіотичні бактерії і наскільки мають імунотропну активність, все ще перебуває в стадії вивчення. Так, виявлено суттєві міжродові, міжвидові та міжштамові відмінності в імуномодулюючій активності симбіонтних бактерій. У цьому виявлені відмінності стосувалися як вираженості, а й характеру імунотропних ефектів. Показовим прикладом цього стало дослідження імуномодулюючої активності 21 штаму 4 видів біфідобактерій (Lopez P. et al., 2011). Так, частина з них у культурі мононуклеарних клітин людини in vitro індукувала продукцію цитокінів Th1-профілю: інтерферону-γ (ІФН-γ) та фактора некрозу пухлини (TNF)-альфа. Друга група штамів в основному викликала вироблення інтерлейкіну-17 (IL-17) при відносно низькій продукції ІФН-γ і TNF (Th17-профіль). Третя група переважно стимулювала вироблення IL-10 за низького рівня продукції Th1- та Th17-цитокінів (Treg-профіль). Таким чином, різні штами біфідобактерій індукували або прозапальні, або протизапальні цитокіни. При цьому обробка різними бактеріальними штамами дендритних клітин змінювала їх здатність поляризувати диференціювання незрілих T-клітин, визначаючи баланс субпопуляцій CD4+Т-клітин: Th1/h17/Treg, що мало важливе значення, оскільки Th1-клітини беруть участь у імунній відповіді проти респіратор внутрішньоклітинних бактерій (мікоплазми, хламідії, легіонели, уреаплазми та ін.), а Th17 – проти позаклітинних бактерій та грибів, тоді як Treg забезпечують імунну толерантність і запобігають надлишковій імунній реакції щодо власних та чужорідних субстанцій.
Відмінності імуномодулюючих ефектів 4 штамів лакто- та 2 штамів біфідобактерій (Bifidobacterium longum SP 07/3 та Bifidobacterium bifidum MF 20/5) були продемонстровані в іншому дослідженні (Dong H. et al., 2012). Усі бактерії збільшували експресію активаційних маркерів на Т-клітинах та природних кілерів (NK), а також посилювали цитотоксичну активність останніх. Проте лактобацили стимулювали переважно продукцію цитокінів Th1-профілю, а досліджувані штами біфідобактерій – протизапальних медіаторів. При цьому Bifidobacterium longum SP 07/3 та Bifidobacterium bifidum MF 20/5 здатні одночасно посилювати активність основних клітинних ланок ІВ, що беруть участь у противірусній відповіді, та індукувати толерогенні сигнали.
Отже, для використання як імуномодулятори можуть бути рекомендовані тільки ті пробіотики, які включають штами з експериментально і клінічно доведеною імунотропною активністю. На жаль, імуномодулююча активність багатьох пробіотичних штамів, які дозволені до застосування, досліджена недостатньо або не вивчена взагалі, що може призвести до негативних наслідків при їх клінічному застосуванні. Не є винятком і застосування комплексів пробіотичних штамів, оскільки необхідно враховувати можливість синергізму у реалізації одних біологічних ефектів та антагонізму – інших, що потребує додаткових спеціальних досліджень.
Оскільки в останні роки було доведено, що біологічні властивості та функції пробіотичних бактерій істотно різняться, то з їх загальної маси були виділені штами, що мають досить суттєві відмінності в механізмах дії та мають ряд спрямованих функцій. Все це дозволило підійти до розробки, створення та впровадження у практику нових пробіотичних препаратів для диференційованої терапії різних захворювань. В даний час для лікування захворювань, у патогенезі яких провідна роль відводиться порушенню функції ІС, використовуються пробіотичні штами, що діють на третьому рівні та здатні модулювати як локальні, так і системні імунні реакції. Саме до них і належать передусім певні штами лакто- та біфідобактерій.
На сьогоднішній день експертами FAO (Food and Agriculture Organizaton of the United Nations) та WHO (Всесвітня організація охорони здоров'я) чітко сформульовані сучасні вимоги до пробіотиків, що дозволяють достовірно визначати їхню ефективність та безпеку:
У світлі цього шлях пробіотика до пацієнта цілком виправдано стає досить довгим, оскільки він складається з ідентифікації штаму шляхом фено- і генотипування, визначення функціональної характеристики штаму за допомогою тестів in vivo і на тварин, оцінки його безпеки за допомогою тестів in vitro на тварин і на здорових добровольцях (1-й ступінь), двох повторних подвійних сліпих рандомізованих плацебо-контрольованих досліджень (2-й ступінь), порівняльних клінічних досліджень (3-й ступінь). Тільки після успішного завершення всіх цих етапів дослідження штам може вважатися пробіотичним та отримати відповідне визнання компетентних органів.
Необхідно відзначити, що однією з умов реалізації ефективної імунної відповіді щодо різних патогенів є надходження в організм достатньої кількості життєво важливих вітамінів та мінералів. Тому включення до складу пробіотичних препаратів вітамінів (А, С, Е та ін) та мінералів (цинк, селен, залізо та ін) забезпечує необхідний фундамент для адекватного протиінфекційного захисту, у тому числі для реалізації імунотропних ефектів симбіонтних бактерій. З іншого боку, нормалізація кількісних та якісних показників мікробіоти збільшує біодоступність мінералів та вітамінів. Отже, у функціонуванні та підтримці нормального стану ІС важливу роль відіграють певні вітаміни, макро- та мікроелементи.
Вітаміни є незамінними факторами харчування органічного походження, що регулюють біохімічні та фізіологічні процеси в організмі шляхом активації ферментативних реакцій та виявляють біологічну активність у малих кількостях. Результати численних досліджень довели, що вітаміни абсолютно необхідні нормальної життєдіяльності людини, оскільки є біологічними каталізаторами, які впливають обмін речовин і забезпечують захист від несприятливих чинників довкілля, зокрема й від інфекційних агентів. Основними причинами нестачі в дитячому організмі вітамінів є нераціональне вигодовування дітей 1-го року життя, порушення у харчуванні вагітних та годуючих грудьми, широке використання у харчуванні дітей рафінованих продуктів, позбавлених вітамінів у процесі їх виготовлення, втрати вітамінів внаслідок направильного зберігання та кулінарної обробки продуктів, гіподинамія, пов'язана зі значним зменшенням потреби дітей в енергії, стреси, захворювання органів травної системи та ін.
Виділяють кілька основних механізмів дії вітамінів:
Не менш важлива і роль мінералів у підтримці нормальної функції ІС, оскільки вони також мають як імунотропну, так і антиоксидантну активність. На жаль, встановлено, що у 80% населення наголошується на дисбалансі мікроелементів, що не може не відбиватися на протиінфекційному захисті організму. Макро- та мікроелементи впливають на обмін речовин, регулюючи понад 50 тис. біохімічних процесів в організмі. Без них неможлива нормальна робота нервової, серцево-судинної, травної, кровотворної та імунної систем. Так, для забезпечення імуномодулюючих ефектів організму життєво необхідні такі основні з них: залізо, йод, мідь, цинк, кобальт, хром, молібден, селен, марганець, оскільки їх імунотропна дія пов'язана з такими властивостями мікроелементів:
При цьому слід зазначити, що задовольнити добову потребу організму в мінералах за допомогою харчового раціону та ліків значно складніше, ніж у вітамінах. Це пов'язано, передусім, про те, що слід розраховувати як кількість відповідних компонентів, а й характер їх взаємодії організмі. Так, встановлено, що:
Слід зазначити, що крім раціонального підбору складових для комплексного препарату, який складався б з пробіотичних штамів мікроорганізмів, вітамінів і мікроелементів, слід забезпечити максимальну біодоступність його компонентів та захист симбіонтних бактерій для їх доставки живими в необхідні відділи ШКТ. Питання життєздатності пробіотичних штамів зачіпає не лише аспекти їх захисту при проходженні шлунка та верхніх відділів тонкої кишки, а й аспекти, пов'язані з особливостями виробництва та зберігання готових лікарських форм препарату.
Раніше вказувалося, що можливості проведення специфічної профілактики інфекцій ОД багато в чому обмежені рядом факторів: чисельність респіраторних патогенів, їх генетичною мінливістю, нестійкістю формування імунітету проти них та ін. ніж застосування низки імунотропних засобів має жорсткі вікові обмеження. Саме тому важливого значення набуває неспецифічної профілактики респіраторних інфекцій, спрямованої на підвищення власних природних механізмів протиінфекційного захисту шляхом комплексного використання пробіотиків, вітамінів та мінералів. Прикладом успішної роботи зі створення такого комплексного засобу, що складається з пробіотичних штамів мікроорганізмів, вітамінів і мінералів, в якому враховані всі перераховані вище аспекти, є розробка компанією Merck KGaA (Німеччина) комплексів Біон®3 і Біон<®3 Кід, які на фармацевтичному ринку України відома компанія Dr. Reddy's Laboratories.
Біон®3 і Біон®3 Кід включають ексклюзивну комбінацію (Tribion Harmonis™) трьох ретельно підібраних штамів симбіонтних бактерій людського походження: Lactobacillus gasseri PA 16/8, Bifidobacterium bifidum MF 20/5 та Bifidobacte. Важливо, що всі ці пробіотичні штами включені до міжнародного класифікатора мікробіологічних культур, визнані безпечними FS FDA та мають статус GRAS (Generally recognized as safe) статус, а характеристики штамів описані у керівництві Європейської організації з контролю за харчовими продуктами. До складу Біон®3 входять 12 вітамінів та 10 мікроелементів, необхідних для повноцінного функціонування ІВ, про що вказувалося вище. При цьому дозування кожного з компонентів наближене до європейських рекомендацій і становить близько 50-80% добової норми, що унеможливлює передозування активних речовин при застосуванні даного засобу. Таким чином, крім комбінації 3 скрупульозно селекціонованих симбіонтних штамів мікроорганізмів, вітамінів і мінералів, важливою перевагою на користь ефективності Біон®3 є запатентована технологія таблетування, оскільки оригінальна тришарова таблетка, в якій всі активні компоненти містяться в різних шарах, покрита захисною оболонкою, яка гарантує доставку пробіотичних культур у нижні відділи ШКТ живими, а також і високу біодоступність інших компонентів, що входять до його складу (рис. 16-18). Завдяки вказаним властивостям Біон®3 добре зарекомендував себе не лише як засіб для підтримки здорового балансу мікробіоти ШКТ, а й як імуномодулятор із клінічно та лабораторно доведеною ефективністю. Необхідно відзначити також зручність застосування препарату Біон 3 по 1 таблетці на день, а також форму його випуску (30 таблеток) – розраховану на проведення курсової терапії.

Вплив Біон®3 на імунологічні показники крові, мікробіоценоз кишечника, частоту та вираженість ГРІ був доведений у кількох клінічних дослідженнях із сучасною доказовою базою. Так, у рандомізованому подвійному сліпому плацебо-контрольованому дослідженні, проведеному в Німеччині на 477 здорових добровольцях (De Vrese M., 2005), було показано, що у пацієнтів, які приймали щодня по 1 таблетці Біон®3 у зимовий або зимово-весняний період , порівняно з особами, які отримували плацебо, суттєво знижувалися кількість випадків простудних захворювань, загальна кількість днів із лихоманкою, тяжкість простудних захворювань, у тому числі зменшувалась кількість проявів міалгії, головного болю, проявів кон'юнктивіту та випадків втрати апетиту. Крім того, дослідниками була виявлена виражена тенденція до скорочення тривалості епізодів простудних захворювань, зменшення кількості випадків грипу та числа назальних, фарингеальних та бронхолегеневих симптомів. Не менш важливими для підтвердження імунотропної активності комплексу в цьому дослідженні було також продемонстровано позитивні зміни лабораторних імунологічних показників крові, спричинені прийомом Біона®3. Так, у крові добровольців, які отримували Біон®3, на відміну від осіб, які приймали плацебо, вже через 2 тижні збільшилася кількість лейкоцитів, гранулоцитів, моноцитів, лімфоцитів, в основному за рахунок Т-клітин (CD3+), у тому числі цитотоксичних Т- лімфоцитів (CD8+) та Т-хелперів/індукторів (CD4+), що свідчить про одночасну системну активацію вродженого та адаптивного, насамперед клітинного імунітету.
Рис. 17 и 18. Переваги складу компонентів таблетки Біон®3
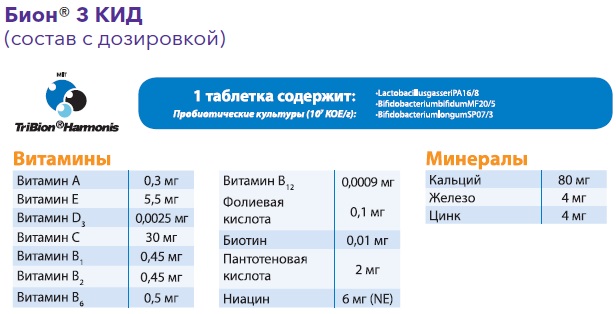
Допоміжні речовини: сорбіт (Е 420), порошок з червоної буряки, рослинні твердий жир, яблучна кислота (Е 296), магнію стеарат (Е 470b), ароматизатор натурально-ідентичний малиновий, калію ацесульфам (Е 950), сахарин натрію).
В іншому рандомізованому подвійному сліпому контрольованому дослідженні, виконаному в Німеччині на 479 здорових добровольцях (Gruenwald J. et al., 2002), була підтверджена здатність Біон®3 при використанні його в зимово-весняний період року більш ефективно коригувати імунологічні показники крові, скорочувати 2 дні тривалість епізодів простудних захворювань та знижувати тяжкість їх симптомів порівняно з контрольною групою, яка приймала аналогічний вітамінно-мінеральний комплекс, але без пробіотичних бактерій. Дане дослідження доводить, що найважливішу роль у досягненні позитивного впливу на ІС при прийомі Біон®3 грають пробіотичні штами мікроорганізмів, що входять до його складу. Таким чином, у двох великих рандомізованих подвійних сліпих дослідженнях переконливо доведено ефективність Біона® 3 як надійний засіб для профілактики респіраторних інфекцій.
Біон®3 Кід у формі жувальних таблеток призначений для підтримки добової необхідності організму дитини у вітамінах та мікроелементах, а лакто- та біфідобактерії, які входять до його складу допомагають підтримувати та відновлювати баланс кишкової мікрофлори, а також мають доведені імунотропні властивості. Так, завдяки вдало сформованому складу пробіотиків, вітамінів та мінералів Біон®3 Кід добре зарекомендував себе не лише як засіб для підтримки здорового балансу мікробіоти ШКТ, але й як імуномодулятор із клінічно та лабораторно доведеною ефективністю. Слід наголосити, що в Україні даний препарат рекомендований для дітей спеціалістами ДУ «Інститут педіатрії, акушерства та гінекології НАМН України». Склад комплексу пробіотиків, вітамінів та мінералів Біон®3 Кід представлений на рис. 19.
Необхідно відзначити також і зручність застосування препарату Біон®3 Кід по 1 жувальній таблетці на день дітям віком 4-12 років, а також форму його випуску (30 таблеток), розраховану на проведення курсової терапії. Біон®3 Кід призначений дітям для:
Феклісовою Л.В. (2013) було вивчено ефективність та безпеку дитячої форми даного препарату - Біон®3 Кід. У відкритому проспективному рандомізованому дослідженні ефективності та безпеки комплексу Біон®3 Кід як імунокоригувальний засіб для профілактики респіраторних інфекцій брало участь 70 дітей, що часто хворіють, у віці 7-8 років, у яких на момент включення в дослідження були відсутні ознаки ГРВІ. У всіх дітей, які брали участь у цьому дослідженні, при імунологічному лабораторному дослідженні крові реєструвалися значні порушення всіх етапів процесу фагоцитозу – важливої ланки вродженого імунітету – та низькі резервні можливості фагоцитів поглинати та перетравлювати чужорідні агенти (зниження фагоцитарної активності або фагоцитарний індекс) фагоцитуючих нейтрофілів, що супроводжувалося суттєвим дефіцитом їх поглинаючої та перетравлюючої здатності. Крім того, за даними імунограми крові, у дітей спостерігалося зниження вмісту Т-хелперів (CD4+) та підвищення Т-цитотоксичних клітин (CD8+), що свідчило про функціональний дисбаланс імунного реагування. Імунорегуляторний індекс (співвідношення CD4 + Т-хелперів та CD8 + Т-цитотоксичних лімфоцитів) знаходився на нижній межі референсного інтервалу. Таким чином, порушення імунітету у обстежених підтверджували наявність дисбалансу імунних реакцій, їх напруженість з активацією В-клітинної ланки та природних кілерів у відповідь на часті вірусні інфекції. При цьому суттєві порушення імунітету у цієї категорії дітей зберігалися навіть поза періодом хвороби. Важливим моментом було виявлення автором дослідження в обстежених дітей істотних порушень мукозального імунітету слизової оболонки ротоглотки. Так, підвищений вміст IgG виявлено у 98%, дефіцит секреторного імуноглобуліну А (sIgA) – більш ніж у половини дітей. Синтез секреторного компонента в середньому було підвищено, проте у 13,1% учасників виявлено повну його відсутність. Виявлені порушення вказували на те, що у цієї категорії пацієнтів в умовах дефіциту місцевого секреторного імунітету мала місце наявність персистенції вірусних та/або бактеріальних патогенів на слизовій оболонці ротоглотки.
Слід зазначити, що на фоні застосування вітамінно-мінерального комплексу з пробіотиками для дітей – Біон®3 Кід, автор дослідження спостерігала позитивну динаміку низки симптомів, асоційованих з наявністю супутньої патології, які були діагностовані при включенні дітей до дослідження. При цьому клінічне поліпшення на фоні застосування комплексу Біон®3 Кід супроводжувалося поліпшенням лабораторних показників ІС. Так, їх позитивна динаміка була виявлена у всіх обстежених та у всіх ланках імунного захисту, а саме: фагоцитарної активності нейтрофілів, Т-клітинної ланки та мукозального імунітету. У динаміці спостерігалося збільшення числа нейтрофілів, які вступили у фагоцитоз, хоча абсолютна їх кількість суттєво не змінилася. Достовірне підвищення здатності фагоцитів поглинати та перетравлювати бактерії, яке було виявлено в основній групі, свідчило про більш високу їх функціональну активність. На момент закінчення дослідження у групі дітей, які отримували Біон®3 Кід, вдалося досягти стійкого покращення показників фагоцитозу, хоча повного відновлення його функції не відбулося, оскільки референсні значення показників не досягнуто. При аналізі показників клітинного імунітету було виявлено наростання відносного та абсолютного вмісту Т-хелперів, NK-клітин та NK-Т-лімфоцитів, а також відбулася нормалізація числа цитотоксичних Т-лімфоцитів (CD3+, CD8+), проте їх вміст все одно перевищував референсні значення. При цьому в групі дітей, які приймали Біон®3 Кід, відбувалося зменшення підвищеного числа клітин, тоді як у контрольній групі воно зросло. Це могло свідчити про те, що при вживанні комплексу Біон®3 Кід не відбувалося подальшої стимуляції утворення В-лімфоцитів у відповідь на вірусну інфекцію, та корелювало з меншою частою реєстрацією у них випадків ГРВІ. Імунорегуляторний індекс залишався в межах референсних значень, але зріс, що також свідчило про тенденцію до нормалізації функції ІС. Також спостерігалося достовірне збільшення концентрації sIgA на слизовій оболонці ротоглотки у дітей, які отримували вітамінно-мінеральний комплекс із пробіотиками. При катамнестичному спостереженні за дітьми, які отримували комплекс Біон®3 Кід в рамках даного дослідження, протягом 3 місяців після його закінчення була достовірно зниженою частота ГРЗ, кратність та тяжкість перебігу захворювання, частота ускладнень та потреба у застосуванні антибактеріальних препаратів. Це свідчило про ефективність Біона®3 Кід у профілактиці ГРЗ завдяки значному покращенню стану системного та місцевого імунітету дітей.
Отже, можна стверджувати, що вітамінно-мінеральний комплекс з пробіотиками Біон®3 і Біон®3 Кід мають подвійний (імуномодулюючий та протизапальний) механізми дії, що дозволяє рекомендувати їх для лікування та профілактики ГРВІ та нормалізації імунологічної реактивності організму. При цьому унікальна технологія виробництва забезпечує бездоганну якість та доставку компонентів препарату у необхідні для їх всмоктування та засвоєння місця організму та їх оптимальну взаємодію між собою. Також наявність 2-х форм випуску препарату (жувальні таблетки Біон® 3 Кід для дітей та унікальна тришарова таблетка Біон®3) дозволяє застосовувати його у пацієнтів різних (від 4 років і до дорослого віку) вікових категорій, забезпечуючи широке охоплення різних категорій пацієнтів, потребують проведення подібної імунореабілітації. Для зручності ми звели в таблицю 4 найчастіші показання та режими використання в клініці комплексів Біон®3 і Біон®3 Кід. Пробіотично-вітамінно-мінеральні комплекси Біон®3 та Біон®3 Кід можуть бути рекомендовані для широкого застосування дітьми та дорослими, не тільки як профілактичний засіб, але й для включення в режим лікування, особливо при таких ситуаціях:
|
Нозологія/стан |
Механізм дії/тривалість терапії |
Очікувані результати |
|
Грип та інші ГРІ |
|
|
|
Часті рецидивні ГРІ |
|
|
|
Інфекції ШКТ, діарея |
|
|
|
Прийом антибіотиків |
|
|
|
Контакт з хворим ГРІ |
|
|
|
Наявність ознак вторинної імунної недостатності |
|
|

Академік міжнародної академії оториноларингології – хірургії голови та шиї, заслужений діяч науки та техніки України, доктор медичних наук, професор, завідувач кафедри оториноларингології ВДУЗУ «Українська медична стоматологічна академія». Автор понад 400 наукових друкованих праць, 50 раціоналізаторських пропозицій та 4 авторських свідоцтв на винаходи, присвячених питанням ендоскопічної ринохірургії та ринопластики.

Доктор медичних наук, професор кафедри фтизіатрії та пульмонології Національної медичної академії післядипломної освіти ім. П.Л. Шупика. Автор 525 наукових праць у галузі алергології, клінічної імунології, пульмонології, співавтор 3 монографій, 1 підручника, 7 посібників, 10 патентів на винаходи. Сфера наукових інтересів – діагностика та лікування хвороб органів дихання, алергічних захворювань, імунодефіцитних станів.

Доцент кафедри
Народився 17.02.1959 р. в Полтаві. 1982 року закінчив лікувальний факультет Полтавського медичного стоматологічного інституту. Протягом 1,5 років служив у лавах Радянської Армії. У 1990 році, після закінчення аспірантури, захистив кандидатську дисертацію «Особливості клініки, діагностики та лікування носоочних травм». З 1995 року виконує обов'язки доцента кафедри оториноларингології.
Запрошуємо переглянути запис прямого ефіру на тему "Запалення як мета комплексної терапії хронічних захворювань верхніх дихальних шляхів"
Науково-практичний кейс-марафон SHDM.SCHOOL
SHDM.FORUM'24: головна подія року!
Інформація, опублікована на даному сайті, орієнтована на загальне ознайомлення та жодним чином не може бути використана в якості медичних, практичних або комерційних рекомендацій. У зв’язку з цим, Сайт «Школи доказової медицини» не несе жодної відповідальності за негативні наслідки, отримані через використання матеріалів, викладених на даному сайті. Документація з фармацевтичних продуктів не є рекламою та не призначена для того, щоб використовувати її замість консультації з кваліфікованими фахівцями в галузі медицини та інших галузях. Документація з фармацевтичних продуктів надається за вашою згодою відповідно до вимог ч.ч. 1, 2 ст. 15 Закону України «Про захист прав споживачів» від 12.05.1991 р. № 1023-XII. Якщо вам потрібна консультація з конкретного питання, пов’язаного зі здоров’ям, необхідно звернутися до фахівців- професіоналів.
Продовжуючи своє перебування на сайті, ви підтверджуєте свою згоду на дистанційне отримання інформації про лікарські та косметичні засоби (включаючи інформацію про рецептурні лікарські засоби) на підставі вимог ч.ч. 1, 2 ст. 15 Закону України «Про захист прав споживачів» від 12.05.1991 р. № 1023-XII.
Уся інформація, яка міститься на даному сайті, подана з освітньою метою виключно для медичних та фармацевтичних працівників і не замінює консультації лікаря.
