Поширеність алергійного риніту зростає в усьому світі, зокрема його часто виявляють у дитячій популяції. Без лікування це хронічне захворювання триває протягом усього життя і може призвести не тільки до пропусків дитиною днів шкільних занять, а й до зниження продуктивності праці батьків через пропуски роботи. Лікування маленьких пацієнтів має бути ефективним, без негативного впливу на їхню активність і здатність до навчання.
Досліджень із оцінки ефективності нових антигістамінних препаратів у дітей небагато. В одному з них, проведеному в 2009 р. тайванськими науковцями на базі медичного університету м. Тайчжун, порівнювали ефективність і безпеку цетиризину й левоцетиризину при лікуванні дітей віком 6-12 років із цілорічним алергійним ринітом (ЦАР).
Цетиризин – потужний і тривало діючий антагоніст гістамінових H1-рецепторів другого покоління, він є рацемічною сумішшю з рівних частин лево- й декстроцетиризину. Цетиризин показаний для лікування таких алергійних захворювань, як алергійний риніт і хронічна ідіопатична кропив'янка в дорослих і дітей. Левоцетиризин – селективний Н1-антигістамінний препарат нового покоління, схвалений для лікування алергійного риніту і хронічної ідіопатичної кропив'янки. Його ефективність, безпечність та протизапальні властивості при лікуванні ЦАР у дорослих підтверджено в дослідженнях; продемонстровано також, що антигістамінергічна активність рацемічної суміші зумовлена насамперед левоцетиризином. Проте даних щодо порівняння ефективності цетиризину й левоцетиризину у дітей із алергічним ринітом замало.
Метою проведеного дослідження було порівняння ефективності й безпеки цетиризину й левоцетиризину при лікуванні дітей із ЦАР.
Загалом було залучено вісімдесят дітей віком 6-12 років, що відповідали критеріям дослідження:
Серед критеріїв виключення були:
Учасників виключали за наявності інфекції дихальних шляхів або у разі вживання зазначених препаратів протягом періоду дослідження. Пацієнтам, що приймали антагоніст лейкотрієну, необхідно було витримати 7-денний період «вимивання». Перед початком дослідження отримували інформовану згоду батьків.
Під час початкового скринінгового візиту було отримано комплексні медичні й алергійні анамнези та проведено шкірні тести у всіх дітей. Учасникам роздали щоденники повсякденної діяльності та проінструктували, що необхідно робити записи про всі симптоми кожного дня, починаючи з 7 днів до початку лікування. Було розглянуто історії призначення препаратів, щоб виключити прийом дітьми H1-антагоністів, протинабрякових засобів або будь-яких форм стероїдів протягом семи днів, що передували дослідженню.
У пацієнтів на першому візиті досліджували максимальну об'ємну швидкість видиху через ніс (nasal peak expiratory flow rate – nPEFR) і мазок із носа, а також просили заповнити дитячий опитувальник про якість життя при ринокон'юнктивіті (Pediatric Rhinoconjunctivitis Quality of Life Questionnaires – PRQLQ). У пацієнтів визначали концентрацію сироваткового еозинофільного катіонного білка (eosinophil cationic protein – ECP), рівень загального IgE й загальну кількість еозинофілів. Також ознайомлювалися із записами в щоденниках пацієнтів за попередні 7 днів. За дизайном дослідження було рандомізованим подвійним сліпим плацебо-контрольованим. Учасники були розподілені на три групи лікування:
Призначений препарат приймали один раз на день перед сном протягом 12 тижнів після початкового візиту. Всі пацієнти проходили спостереження кожні 4 тижні протягом цього періоду. Медичний огляд і визначення nPEFR проводили при кожному відвідуванні, а також збирали всі дані зі щоденників.
На останньому візиті аналізували дані щоденників, пацієнтам знову пропонували заповнити PRQLQ. Також повторно проводили визначення nPEFR і лабораторні аналізи, зокрема дослідження носового мазка, визначення рівня ECP, загальної кількості еозинофілів і загального рівня IgE.
Симптоми риніту оцінювали за допомогою 4-бальної шкали:
Пацієнти щодня робили записи про чотири назальні симптоми (ринорея, закладеність, свербіж у носі й чхання) і чотири симптоми, що не стосуються носа (свербіж/печіння в очах, сльозотеча, почервоніння очей, свербіж у вухах/піднебінні); деяким молодшим пацієнтам (6-7-річним) робити записи допомагали батьки. Загальний бал з оцінки симптомів (Total Symptom Score – TSS) – це сума балів щодо восьми оцінюваних симптомів. Початковий TSS і бал для кожного симптому розраховували як середнє значення щоденних оцінок протягом початкового 7-денного періоду. Пацієнтів обстежували через 4, 8 і 12 тижнів після курсу лікування.
PRQLQ містив 23 пункти щодо назальних, очних симптомів, практичних задач, інших симптомів і обмеження діяльності. Кожен пункт оцінювався за 7-бальною шкалою (від 0 до 6). Структура опитувальників давала змогу дітям заповнювати їх за 5 хв, молодшим дітям могли допомагати батьки.
Визначення nPEFR проводили за допомогою пікфлоуметра «Mini-Wright», оснащеного спеціальною маскою. Пацієнтів інструктували, як правильно робити форсований видих через ніс після глибокого вдиху, із щільно закритим ротом. Вимірювання проводили три рази, фіксуючи максимальне значення.
Ватною паличкою проводили по дну нижньої носової раковини пацієнта, а потім матеріал наносили на предметне скло. Мазки забарвлювали за Leu і досліджували під оптичним мікроскопом. Досвідчений цитолог аналізував препарати за «сліпим» принципом (без відомостей щодо клінічного стану пацієнтів). На кожному мазку аналізували мінімум 100 лейкоцитів, виражаючи кількість еозинофілів як частку від загального їх числа.
При кожному відвідуванні пацієнти усіх груп проходили фізикальний огляд із оцінкою безпеки й переносимості. Фіксувалися всі побічні реакції, а також будь-які зміни життєво важливих функцій.
Аналізи проводили за допомогою програмного забезпечення SPSS/PC 12.0 («SPSS, Inc.», Чикаго, Іллінойс, США). Усі зібрані дані були виражені як середнє±стандартне відхилення (M±SD). Для порівняння демографічних даних та вихідних характеристик між трьома групами використовували однофакторний дисперсійний аналіз. Різниця вважалася статистично значущою при р<0,05.
Дослідження завершили 74 з 80 пацієнтів (6 були виключені через те, що їхні дані про TSS були неповними). Отже, до остаточного аналізу включено 26 пацієнтів із групи цетиризину (10 мг на день), 24 – із групи левоцетиризину (5 мг на день) і 24 – із групи плацебо. Пацієнти трьох груп істотно не відрізнялися за вихідними демографічними даними та показниками стану здоров'я (вік, стать, зріст, маса тіла, рівні ECP і загального IgE, загальна кількість еозинофілів, частка еозинофілів у матеріалі зі слизової носа, nPEFR і загальний бал щодо симптомів) (табл. 1).
|
Характеристики |
Група |
Група |
Група |
|
п = 26 |
n = 24 |
n = 24 |
|
|
Чоловіки/жінки, абс. кільк. (%) |
15/11 (58%) |
15/9 (62,5%) |
13/11 (54%) |
|
Вік, роки |
8,19±2,15 |
8,79+1,61 |
8,12+1,68 |
|
Маса тіла, кг |
29,04+7,25 |
30,23+6,59 |
29,79+6,18 |
|
Зріст, см |
128,35±9,69 |
131,89+8,09 |
129,25+8,23 |
|
TSS |
8,78+2,01 |
7,73+2,94 |
8,49+2,02 |
|
Бали за PRQLQ |
48,65+17,71 |
52,09+16,57 |
41,54+8,83 |
|
Сироватковий ІдЕ, МО/мл |
502,81+334,35 |
557,50+539,84 |
452,66+277,28 |
|
Рівень ECP, нг/л |
10,55+5,05 |
17,85+12,44 |
9,64+4,86 |
|
Кількість еозинофілів у 1 мкл крові |
502,81+334,35 |
557,50+539,84 |
452,66+277,28 |
|
nPEFR |
74,00+42,60 |
95,50+39,61 |
78,25+19,82 |
|
Частка еозинофілів у матеріалі зі слизової носа |
44,80+21,08 |
39,71+10,37 |
37,22+18,55 |
Примітки: Дані представлені як M±SD, якщо не зазначено інше. TSS – загальний бал із оцінки симптомів; PRQLQ – дитячий опитувальник про якість життя; ECP – еозинофільний катіонний білок; nPEFR – максимальна об'ємна швидкість видиху через ніс.
Середню зміну TSS (за даними щоденників) у порівнянні з вихідним наведено на рисунку 1 і в таблиці 2.
У групах цетиризину й левоцетиризину TSS значуще зменшився в порівнянні з групою плацебо на 4, 8, 12-му тижні (р ≤ 0,005). Цетиризин виявився ефективнішим за левоцетиризин на 8-му (р = 0,039) і 12-му тижнях (р = 0,015) (див. табл. 2, рис. 1).
|
Часові періоди, |
Група |
Група |
Група |
|
TSS |
|||
|
0-4 |
-3,34±1,57* |
-2,33±2,41* |
0,91±3,37 |
|
р<0,001 |
р<0,001 |
||
|
0-8 |
-4,40±2,46*,** *р<0,001, **р = 0,039 |
-2,59±3,93* р = 0,005 |
-0,09±1,03 |
|
0-12 |
-5,54±2,58*,** *р<0,001, **р = 0,015 |
-3,30±3,90* р = 0,001 |
-0,18±1,77 |
|
Бали за PRQLQ |
|||
|
0-12 |
-19,73±11,04* |
-24,09±16,82* |
1,63±5,13 |
|
nPEFR |
|||
|
0-4 |
13,20±7,85* |
6,54±30,98 |
-1,00±6,61 |
|
0-8 |
33,90±20,42*,** |
16,92±22,96* |
-1,8±8,33 |
|
0-12 |
59,35±32,92*,** |
21,67±46,38* |
-2,5±5,74 |
|
Сироватковий IgE |
|||
|
0-12 |
-33,56±204,23 |
7,72±339,52 |
71,00±211,68 |
|
Рівень ЕСР |
|||
|
0-12 |
-2,68±7,02** |
-13,56±21,56* |
1,11 ±3,09 |
|
Кількість еозинофілів у 1 мкл крові |
|||
|
0-12 |
-118,15±272,44* |
-45,38±241,41 |
56,50±214,14 |
|
Частка еозинофілів у матеріалі зі слизової носа, % |
|||
|
0-12 |
-23,47±19,83*,** |
-6,50±17,81 |
-2,85±11,95 |
Примітки: Дані представлені як M±SD.
TSS – загальний бал із оцінки симптомів; PRQLQ – дитячий опитувальник про якість життя; ECP – еозинофільний катіонний білок;
nPEFR – максимальна об'ємна швидкість видиху через ніс.
* р<0,05 у порівнянні з плацебо; ** р<0,05 у порівнянні з групою левоцетиризину.
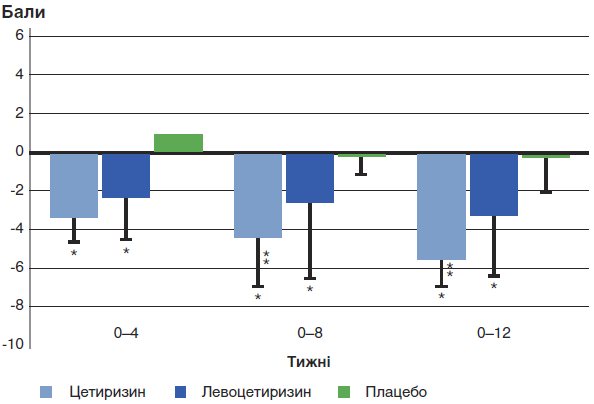
* р<0,05 у порівнянні з плацебо; **p<0,05 у порівнянні з групою левоцетиризину.
У групах цетиризину й левоцетиризину відбувалося значуще зниження TSS на 4, 8 і 12-му тижні в порівнянні з групою плацебо (р≤0,005).
Цетиризин був ефективнішим за левоцетиризин на 8-му (р=0,039) і 12-му тижні (р=0,015).
Рис. 1. Зміна у порівнянні з вихідним загального балу щодо оцінки симптомів
Зміни індивідуальних симптомів у порівнянні з початковим рівнем (за даними щоденників) наведено в таблиці 3.
|
Часові періоди, |
Цетиризин |
Левоцетиризин |
Плацебо |
|---|---|---|---|
|
Ринорея |
|||
|
0-4 |
-0,47±0,53 |
-0,37±0,58 |
-0,08±0,73 |
|
0-8 |
-0,74±0,51 |
-0,45±0,87 |
-0,11 ±0,46 |
|
0-12 |
-0,92±0,54 |
-0,62±0,95 |
-0,14±0,28 |
|
Закладеність носа |
|||
|
0-4 |
-0,71±0,43 |
-0,39±0,60 |
-0,22±0,61 |
|
0-8 |
-0,91±0,62 |
-0,36±0,81 |
-0,05±0,44 |
|
0-12 |
-1,00±0,39 |
-0,50±0,65 |
-0,05±0,32 |
|
Свербіж у носі |
|||
|
0-4 |
-0,43±0,58 |
-0,37±0,70 |
-0,02±0,86 |
|
0-8 |
-0,56±0,68 |
-0,49±0,92 |
-0,01 ±0,58 |
|
0-12 |
-0,73±0,81 |
-0,60±0,95 |
0,11 ±0,47 |
|
Чхання |
|||
|
0-4 |
-0,60±0,35 |
-0,49±0,59 |
-0,03±0,69 |
|
0-8 |
-0,52±0,55 |
-0,60±1,05 |
-0,04±0,29 |
|
0-12 |
-0,71±0,53 |
-0,49±0,74 |
-0,12±0,28 |
|
Свербіж у горлі |
|||
|
0-4 |
-0,07±0,15 |
0,02±0,24 |
0,16±0,48 |
|
0-8 |
-0,05±0,21 |
0,08±0,39 |
-0,05±0,12 |
|
0-12 |
-0,10±0,35 |
0,08±0,40 |
-0,06±0,25 |
|
Свербіж у кон'юнктиві |
|||
|
0-4 |
-0,48±0,54 |
-0,43±0,71 |
0,26±1,10 |
|
0-8 |
-0,78±0,75 |
-0,61±0,94 |
0,04±0,48 |
|
0-12 |
-1,06±0,95 |
-0,82±1,13 |
0,01 ±0,34 |
|
Сльозотеча |
|||
|
0-4 |
-0,14±0,28 |
-0,06±0,13 |
0,29±0,68 |
|
0-8 |
-0,22±0,34 |
-0,04±0,20 |
0,08±0,19 |
|
0-12 |
-0,22±0,42 |
0,01±0,33 |
0,00±0,28 |
|
Гіперемія кон'юнктиви |
|||
|
0-4 |
-0,40±0,39 |
-0,21 ±0,35 |
0,07±0,70 |
|
0-8 |
-0,56±0,49 |
-0,31 ±0,53 |
-0,02±0,29 |
|
0-12 |
-0,79±0,51 |
-0,42±0,53 |
0,02±0,13 |
Примітки: Дані представлені як M ± SD.
* у порівнянні з плацебо; ** у порівнянні з групою левоцетиризину.
Терапія цетиризином значуще зменшувала вираженість симптомів ринореї, закладеності носа, свербежу в носі, чхання, свербежу в очах, сльозотечі й гіперемії кон'юнктиви. Лікування левоцетиризином значуще зменшувало вираженість симптомів закладеності носа.
Лікування цетиризином значуще поліпшувало показник nPEFR у порівнянні з групою плацебо на 4, 8 і 12-му тижнях (р<0,001). Прийом левоцетиризину значуще поліпшував показник nPEFR у порівнянні з групою плацебо на 8 і 12-му тижнях (р < 0,05). Цетиризин виявився ефективнішим за левоцетиризин на 8 і 12-му тижнях (р<0,05) (див. табл. 2, рис. 2).
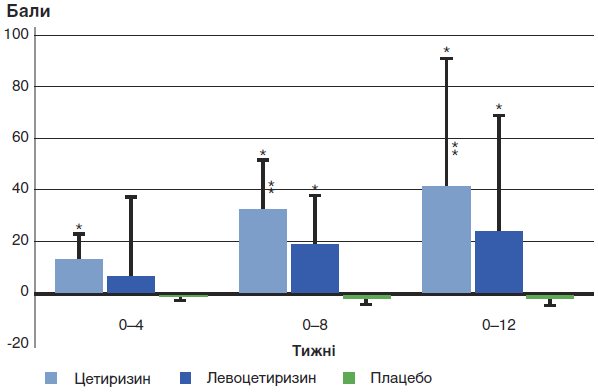
* р<0,05 у порівнянні з плацебо;
** p<0,05 у порівнянні з групою левоцетиризину.
Значення nPEFR значуще поліпшилися: у групі цетиризину в порівнянні з групою плацебо на 4, 8 і 12-му тижнях (р<0,001), у групі левоцетиризину в порівнянні з групою плацебо на 8 і 12-му тижнях (р<0,05). Цетиризин виявився ефективнішим за левоцетиризин на 8 і 12-му тижнях (р<0,05)
Рис. 2. Зміни nPEFR у порівнянні з вихідним рівнем
Обидва препарати сприяли значущому зниженню середніх значень балів за PRQLQ у порівнянні з групою плацебо після 3-місячного курсу лікування (р<0,05). Статистично значущої різниці при порівнянні ефективності обох препаратів не було (р = 0,095) (див. табл. 2, рис. 3).
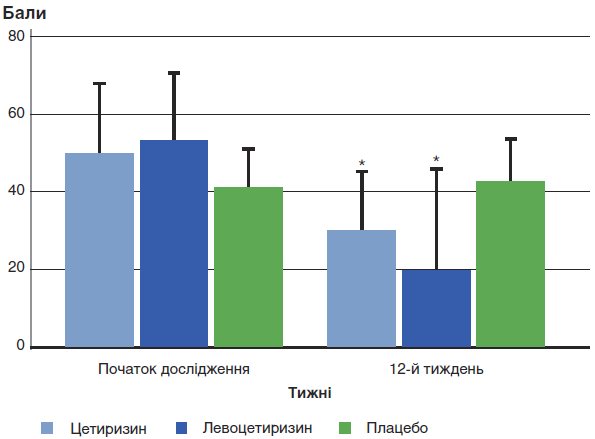
* р<0,05 у порівнянні з плацебо. Після тримісячного курсу лікування у групах цетиризину й левоцетиризину значуще знизилися середні значення балів за PRQLQ у порівнянні з групою плацебо (р<0,05).
Значущої різниці при порівнянні ефективності двох препаратів не виявлено (р = 0,095).
Рис. 3. Середнє значення балів за PRQLQ на початку дослідження й на 12-му тижні
Лікування цетиризином сприяло значущому зменшенню частки еозинофілів у матеріалі зі слизової носа в порівнянні з цим показником до початку лікування (р<0,001). У групі цетиризину показник різниці між початком і завершенням терапії достовірно був більшим, ніж у групі плацебо. Водночас такого ефекту не виявлено щодо левоцитиризину, показник різниці в цій групі не відрізнявся від плацебо. Цей результат дає змогу припустити, що оновлення пулу еозинофілів у слизовій оболонці носа інгібується під впливом цетиризину (див. табл. 2).
У лабораторних дослідженнях цетиризин сприяв достовірному зменшенню загальної кількості еозинофілів у периферичній крові після 12-тижневого періоду лікування (р<0,05), але левоцетиризин не мав такого ефекту. Прийом левоцетиризину (але не цетиризину) сприяв достовірному зниженню рівня ECP після 12-тижневого курсу лікування (р<0,001). Істотних змін у концентрації IgE після лікування не було в жодній із трьох груп.
Під час лікування було зафіксовано м'яку седативну дію у одного пацієнта з групи цетиризину, незначну втомлюваність у пацієнтів групи левоцетиризину; серйозних побічних реакцій не відзначалося.
Пероральні антигістамінні препарати є основними для лікування дорослих і дітей із алергією. Діти, особливо в шкільному віці, потребують меншого седативного потенціалу для послаблення негативного впливу симптомів на денну активність та навчання. Антигістамінним засобам першого покоління притаманні такі побічні реакції, як седатива дія, сухість у роті, порушення психомоторної активності. Нові антигістамінні препарати другого покоління, такі як цетиризин, лоратадин, фексофенадин і левоцетиризин, діють швидко й чинять менші седативні і антихолінергічні ефекти.
У попередніх дослідженнях цієї самої групи тайванських авторів, у яких порівнювали ефективність цетиризину, оксатоміду, кетотифену й плацебо у дітей віком 6-12 років із ЦАР, було показано вищу ефективність цетиризину в зменшенні вираженості симптомів цього захворювання. При порівнянні ефективності й безпеки цетиризину та монтелукасту у дітей віком від 2 до 12 років із ЦАР також виявлено вищу ефективність цетиризину.
Більшість клінічних досліджень показали, що цетиризин і левоцетиризин є потужними антигістамінними засобами, які можуть полегшити симптоми алергійних розладів. Однак клінічних досліджень, присвячених порівнянню ефективності цетиризину й левоцетиризину у дітей із ЦАР, замало.
У 2005 році було опубліковано результати 4-тижневого клінічного дослідження ефективності й безпеки левоцетиризину і якості життя, пов'язаної зі здоров'ям, у дітей віком 6-12 років із ЦАР (P.C. Potter, 2005). Вони показали, що терапія левоцетиризином достовірно поліпшує показник загального балу для чотирьох симптомів через 2 і 4 тижні в порівнянні з плацебо. Однак щодо балів за PRQLQ не було виявлено значущої різниці між групами левоцетиризину й плацебо на 4-му тижні.
Оскільки цетиризин містить однакові кількості лево- й декстроцетиризину, було б корисно знати відносні переваги цих двох елементів. Кілька клінічних випробувань показали, що антигістамінні властивості цетиризину, ймовірно, пов'язані з левоцетиризином. Якщо ефективність левоцетиризину може бути такою самою, як у цетиризину, пацієнт може обійтися без прийому «непотрібного» препарату. Однак у тайванському дослідженні з 12-тижневим періодом лікування показано, що цетиризин був ефективнішим за левоцетиризин у поліпшенні таких показників: загальний бал із оцінки симптомів, бал за PRQLQ і показник nPEFR.
На всмоктування, розподіл і метаболізм препаратів впливають різні індивідуальні чинники. Приналежність до певної раси, генетичні фактори або вік можуть вплинути на експресію, дозрівання й кількість рецепторів гістаміну в організмі людини. Особам різного віку можуть бути притаманні різні фармакокінетичні та фармакодинамічні профілі. У канадському 18-місячному дослідженні (F.E. Simons від імені дослідницької групи ETAC [Early Treatment of the Atopic Child], 2005) з участю дуже маленьких дітей (14-46 місяців) було показано, що левоцетиризин добре всмоктується після прийому всередину; виводиться так само швидко (або швидше), як у дорослих; кінцевий період його напіввиведення такий самий, як у дорослих (або коротший). Дослідники рекомендують визначати дозування левоцетиризину в дуже маленьких дітей на основі маси тіла й віку, припускаючи, що може бути необхідним дворазовий прийом на день або відносно вищі дози. Результати цього дослідження і дані тайванських учених показують, що необхідні популяційні фармакокінетичні дослідження застосування левоцетиризину у дітей для визначення оптимального дозування. Австралійське дослідження (N. Cranswick et al., 2005), присвячене вивченню фармакокінетики левоцетиризину, показало, що прийом левоцетиризину двічі на день у дозі 0,125 мг/кг відповідав його фармакокінетиці й фармакодинаміці та забезпечував добрий профіль безпеки у дітей віком 1-2 років. Постає питання: чи буде дворазовий прийом на день левоцетиризину ефективнішим при лікуванні дітей 6-12 років із ЦАР? Потрібні більш масштабні й тривалі дослідження, щоб відповісти на нього.
F.E. Simons і K.J. Simons від імені дослідницької групи ETAC нещодавно представили дані фармакокінетики та фармакодинаміки левоцетиризину в дітей віком 6-11 років (2005). Вони показали, що левоцетиризин високоселективно взаємодіє з людським гістаміновим H1-рецептором (із вдвічі більшою спорідненістю, ніж цетиризин). Автори зробили висновок, що прийом препарату 1 раз на добу може бути оптимальним у дітей цієї вікової групи. Однак у дослідженні використовували шкірну пробу з появою гіперемії та пухиря, індукованих гістаміном, для оцінки початку, ступеня й тривалості дії Н1-антигістамінних препаратів. Залишається спірним питанням, чи корелюють дані шкірного тесту із процесами в дихальних шляхах.
Для забору носових мазків зазвичай використовували ватні тампони. Це простий і недорогий метод, але він часто призводить до хибнопозитивних і хибнонегативних результатів. Можливо, результати, отримані тайванськими дослідниками, були б точнішими при використанні назальних зондів.
Жодних серйозних побічних реакцій не було виявлено ні на цетиризин, ні на левоцетиризин. Основним фармакологічним ефектом цетиризину є опосередковане селективне інгібування периферичних гістамінових Н1-рецепторів. Використання цетиризину пов'язується з низькою частотою антихолінергічних ефектів, таких як сухість у роті. Він спричинює незначну седацію і не має несприятливого впливу на серце, на відміну від високоліпофільних антигістамінних засобів.
Таким чином, 12-тижневий курс лікування показав, що цетиризин був ефективнішим за левоцетиризин. Пероральний прийом левоцетиризину двічі на день може бути альтернативним способом ефективного контролю симптомів цілорічного алергійного риніту у дітей віком від 6 до 12 років. Серйозних побічних реакцій під час терапії цетиризином або левоцетиризином не виявлено.
Реферативний огляд підготувала Наталія Купко за матеріалами: Lee C.-F., Sun H.-L., Lu K.-H., Ku M.-S., Lue K.-H. (Pediatr Allergy Immunol. 2009; 20: 493-499)
Цитується за джерелом: Клінічна імунологія. Алергологія. Інфектологія. Спецвипуск № 3 2014
ЦЕСОЗ1-06/07/2017-ОТС
Запрошуємо переглянути запис прямого ефіру на тему "Запалення як мета комплексної терапії хронічних захворювань верхніх дихальних шляхів"
Науково-практичний кейс-марафон SHDM.SCHOOL
SHDM.FORUM'24: головна подія року!
Інформація, опублікована на даному сайті, орієнтована на загальне ознайомлення та жодним чином не може бути використана в якості медичних, практичних або комерційних рекомендацій. У зв’язку з цим, Сайт «Школи доказової медицини» не несе жодної відповідальності за негативні наслідки, отримані через використання матеріалів, викладених на даному сайті. Документація з фармацевтичних продуктів не є рекламою та не призначена для того, щоб використовувати її замість консультації з кваліфікованими фахівцями в галузі медицини та інших галузях. Документація з фармацевтичних продуктів надається за вашою згодою відповідно до вимог ч.ч. 1, 2 ст. 15 Закону України «Про захист прав споживачів» від 12.05.1991 р. № 1023-XII. Якщо вам потрібна консультація з конкретного питання, пов’язаного зі здоров’ям, необхідно звернутися до фахівців- професіоналів.
Продовжуючи своє перебування на сайті, ви підтверджуєте свою згоду на дистанційне отримання інформації про лікарські та косметичні засоби (включаючи інформацію про рецептурні лікарські засоби) на підставі вимог ч.ч. 1, 2 ст. 15 Закону України «Про захист прав споживачів» від 12.05.1991 р. № 1023-XII.
Уся інформація, яка міститься на даному сайті, подана з освітньою метою виключно для медичних та фармацевтичних працівників і не замінює консультації лікаря.
