Алергічний риніт (АР) є поширеним хронічним розладом назального дихання з такими характерними симптомами, як ринорея, закладеність носа і свербіж. Часто наявні також очні симптоми – свербіж/почервоніння і/або сльозотеча у 60–70% хворих. Симптоми АР, хоч і не є небезпекою для життя, зазвичай є дошкульними, що негативно позначається на роботі і якості життя хворих, а також можуть призводити до фізичних, розумових і емоційних ускладнень у дітей та підлітків. Поширеність АР невпинно зростає протягом кількох останніх десятиліть і значно варіює в різних регіонах і країнах, особливо серед країн, що розвиваються. Наприклад, проведене в Китаї поперечне (cross-sectional) телефонне опитування популяційного рівня (38 203 осіб у 11 великих містах) показало, що поширеність АР, за власною оцінкою опитуваних, коливається від 8,7% у Пекіні (Північний Китай) до 24,1% в Урумчі (північний захід Китаю), а в Шанхаї (схід), у Гуанчжоу (центральна частина) і в Ухані (південь) має проміжні значення – 13,6, 14,1 і 19,3% відповідно.
Крім того, доведено, що збільшення статків, яке супроводжується поліпшенням у сфері освіти та зростанням рівня життя, особливо в деяких африканських країнах, Китаї, Гонконгу, Тайвані й декількох країнах Близького Сходу, збіглося зі значним збільшенням поширеності АР в цих країнах. Все більше експертів схиляються до того, що прояви алергії стають все стійкішими й складнішими, ймовірно, внаслідок постійного впливу побутових алергенів і зростання впливу багатьох перехреснореагуючих традиційних та нетрадиційних сенсибілізуючих агентів, зумовленого змінами внутрішньожитлового середовища / способу життя / статків.
Нині у дорослих та дітей із АР і кон'юнктивітом рекомендовано застосовувати терапію пероральними H1-антигістамінними препаратами II покоління (АГП II) та інтраназальними стероїдами. АГП II є препаратами першого ряду для пацієнтів із захворюванням легкої та середньої тяжкості. Окрім того, в оновленому на основі даних доказової медицини керівництві ARIA (Allergic Rhinitis and Its Impact on Asthma – алергічний риніт та його вплив на астму) зазначено, що з усіх препаратів, які використовуються для лікування персистуючого АР (ПАР), рівень доказовості найбільш переконливий для пероральних АГП II. Це підтверджує пріоритетність їх вибору для лікування пацієнтів із АР.
Історія розвитку АГП після відкриття гістаміну, а також їхня роль у лікуванні алергії і анафілаксії добре задокументовані. Хоча АГП I покоління (АГП I) були розроблені і широко використовувалися в клінічній практиці з середини 1940-х до кінця 1970-х років, відносно низька ефективність та побічні ефекти, особливо седативні й антихолінергічні, обмежили їх застосування і згодом привели до розробки більш ефективних і безпечних АГП II. Доведено, що АГП I можуть призводити до збудження в центральній нервовій системі, занепокоєння, безсоння або судомних нападів у деяких пацієнтів. Тож нині рекомендовано, щоб АГП I не були доступними як безрецептурні препарати для самолікування при алергічних або інших захворюваннях і не використовувалися для лікування АР. Крім того, клінічний досвід застосування астемізолу й терфенадину, одних із перших АГП II, розроблених для забезпечення селективного інгібування H1-рецепторів без пригнічення центральної нервової системи, показав, що дія цих речовин пов'язана з потенційним ризиком кардіотоксичності, і тому їх було вилучено з деяких ринків. На відміну від них, цетиризин, який також був одним із перших АГП II, доступних для пацієнтів, продовжує широко використовуватися у всьому світі для лікування АР та кропив'янки.
Є безліч даних щодо фармакологічно активного карбоксильованого метаболіту гідроксизину – цетиризину. Результатом пошуку від 26 лютого 2013 р. за ключовим словом «цетиризин» в інформаційно-пошуковій системі медичної літератури PubMed стало близько 1 200 публікацій, більше ніж 400 з яких базуються на даних клінічних випробувань, а ще більше ніж 200 – на результатах порівняльних досліджень. Метою огляду, підготованого фахівцями трьох китайських університетів, було підсумувати величезну кількість даних, зібраних протягом 25 років клінічного застосування цетиризину і порівняти з доступними даними щодо інших АГП II.
Цетиризину гідрохлорід (хімічна назва: (+/-)-(2-[4- ([4-хлорфеніл] фенілметіл)-1-піперазиніл]етокси)оцтової кислоти дигідрохлорид]) – рацемічна суміш, що містить рівні кількості двох енантіомерів, R-левоцетиризину і S-декстроцетиризину, які не піддаються взаємоперетворенню і, отже, зберігають стабільність конфігурації в організмі. Показано, що цетиризин має вельми сприятливі фармакологічні властивості. Зокрема, він є цвіттер-іоном, активно зв'язується здебільшого з сироватковим альбуміном, має незначний уявний об'єм розподілу, а також незначною мірою накопичується в мозку, має низьку афінність до м'язової тканини, включаючи міокард (і, таким чином, низьку кардіотоксичність), та незначну седативну дію або ж її відсутність. Цетиризину притаманний найнижчий уявний об'єм розподілу серед більшості АГП II, який забезпечує взаємодію з цільовими рецепторами в ефективних концентраціях із терапевтичною метою; при цьому препарат оминає органи, де він є неефективним або токсичним (рис. 1).
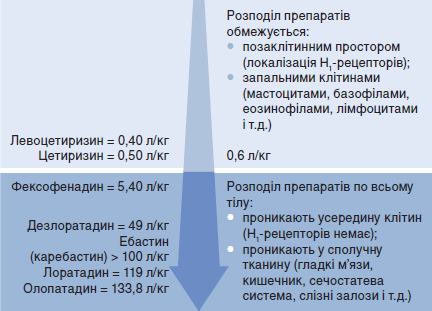
Рис. 1. Зв'язок між потенційним місцем дії і об'ємом розподілу часто вживаних H1-антагоністів
(адаптовано за J.P. Tillement, 2000. Значення розподілу взято з S. Gillman et al., 2009, та N.N. Chu et al., 2009)
Також було показано, що цетиризин інтенсивно й швидко поглинається в кишечнику, що зумовлює високу біодоступність і швидкий початок дії препарату. Цетиризин, на відміну від багатьох інших АГП II, не зазнає значущого метаболізму в печінці, а виводиться переважно в незміненому вигляді з сечею, однаковою мірою як у здорових добровольців, так і у осіб із хронічними захворюваннями печінки. Відсутність метаболізму в печінці свідчить про низький потенціал для лікарських взаємодій. Це дає змогу уникнути будь-яких надмірних фармакологічних або токсикологічних ефектів препаратів, що підлягають метаболізму ферментами системи цитохрому P450 і трансмембранному транспорту. Час напіввиведення цетиризину – близько 10,5 год у здорових добровольців – дає змогу використовувати його для лікування симптомів АР у разовій добовій дозі. Окрім того, дослідження, у яких вивчали зв'язування з Н1-рецептором, показали, що в порівнянні з багатьма іншими широко вживаними АГП II цетиризин має вищу й переважаючу афінність і селективність до цих рецепторів (табл. 1, рис. 2). Це зумовлює потужніший і швидший початок дії та її більшу тривалість. Дослідження протизапальних/протиалергічних ефектів цетиризину показали також, що він може чинити протизапальну дію незалежно від впливу на H1-рецептори.
|
АГП |
Співвідношення селективності зв'язування з гістаміновими (Н1-) і мускариновими (M1-M5-) рецепторами |
||||
|
H1/M1 |
H1/M2 |
H1/M3 |
H1/M4 |
H1/M5 |
|
|
Цетиризин |
> 25 000 |
~ 100 000 |
~ 50 000 |
~ 20 000 |
> 75 000 |
|
Дезлоратадин |
~ 50 |
> 50 |
~ 100 |
~ 50 |
~ 125 |
|
Фексофенадин |
> 10 000 |
> 10 000 |
> 10 000 |
> 10 000 |
> 10 000 |
|
Левоцетиризин |
> 25 000 |
> 75 000 |
~ 50 000 |
> 25 000 |
~ 100 000 |
|
Лоратадин |
~ 100 |
> 350 |
~ 100 |
~ 100 |
> 500 |
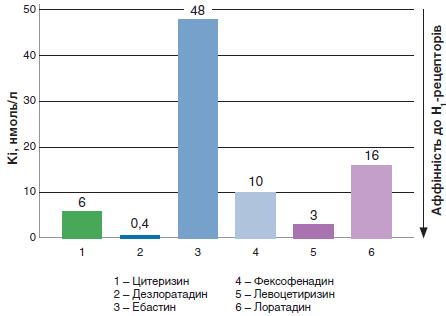
Рис. 2. Спорідненість (афінність) зв'язування антагоністів гістаміну з людськими H1-рецепторами
(адаптовано за M. Gillard et al., 2003)
Фармакологічні ефекти цетиризину у пацієнтів із АР вивчали в кількох дослідженнях. У ранній роботі W.T. Watson et al. (1989) за допомогою рандомізованого подвійного сліпого дослідження в паралельних групах оцінили фармакокінетичні й фармакодинамічні властивості цетиризину у дітей із сезонним АР (САР). Препарат приймали щодня в дозі 5 або 10 мг протягом 5 тижнів. Автори показали, що незалежно від дози цетиризин швидко всмоктувався і сприяв достовірно ефективному пригніченню гістамін-індукованої шкірної реакції з яскраво вираженими проявами пухирів та запалення (за типом кропив'янки й ангіоневротичного набряку) протягом 1-24 год після прийому першої дози; ефект зберігався протягом всього періоду дослідження. Окрім того, протягом усього дослідження були пригнічені прояви АР, причому пацієнти не скаржилися на седативний ефект, сухість у роті чи будь-яку іншу побічну реакцію на цетиризин при застосуванні в обох вказаних дозах.
У кількох дослідженнях оцінювали протизапальні властивості цетиризину у дітей і дорослих із САР або цілорічним АР (ЦАР). У одному з них G. Ciprandi et al. (1997) показали, що у дітей, які одержували цетиризин 4 тижні у дозі 5 мг на день, в порівнянні з групою плацебо достовірно зменшилися клінічні прояви АР протягом сезону пилкування (р < 0,01). Окрім того, в порівнянні з групою плацебо зменшилася інфільтрація запальних клітин (р < 0,03), експресія молекул міжклітинної адгезії 1 (intercellular adhesion molecule 1, ICAM-1) на епітеліальних клітинах (р < 0,05); вміст розчинних ICAM-1 (р < 0,05) і еозинофільних катіонних білків (р < 0,05) у носових змивах. Було також виявлено вірогідну кореляцію між поліпшенням симптомів, клітинною інфільтрацією та експресією ICAM-1, причому зв'язок між поліпшенням симптомів і експресією ICAM-1 був особливо вираженим.
Дослідження ефекту терапії цетиризином у дозі 5 мг на день протягом 2 тижнів на запалення слизової оболонки носа у дітей, які страждають на ЦАР, показали, що цетиризин значно ефективніше, ніж плацебо, знижує вміст інтерлейкіну 4 (р < 0,01), інтерлейкіну 8 (р = 0,01), кількість нейтрофілів і еозинофілів (р < 0,01), зменшує експресію ICAM-1 на епітеліальних клітинах (р < 0,02). Доведено також, що безперервне лікування цетиризином дає змогу досягти достовірно ефективнішого, ніж лікування за необхідності, протизапального і клінічного контролю в пацієнтів із АР.
Нещодавнє дослідження з оцінки впливу 2-річного курсу специфічної підшкірної імунотерапії і безперервного лікування пероральним цетиризином у дозі 10 мг на день на назальне запалення у хворих із тяжким хронічним АР, викликаним кліщами домашнього пилу, показало, що обидві схеми лікування сприяють значному зниженню еозинофільної інфільтрації і експресії ICAM-1 на епітеліальних клітинах від початкового рівня протягом усього курсу лікування. Але цетиризин ефективніше зменшував запалення, а імунотерапія виявилася більш ефективною в боротьбі з епітеліальними розладами.
Інше дослідження показало, що лікування цетиризином протягом одного тижня приводило до зниження вмісту антиген-індукованої субстанції P, але не рівня гістаміну у хворих із ЦАР. Це дає змогу припустити, що цетиризин може зменшувати назальне нейрогенне запалення через модуляцію вивільнення субстанції Р при АР.
Фармакологічні ефекти більшості АГП II і цетиризину всебічно досліджено в декількох порівняльних подвійних сліпих перехресних дослідженнях з участю як здорових добровольців, так і хворих на АР, із використанням як одно-, так і кількаразового дозування на день. Особливий акцент у дослідженнях робився на інгібуванні викликаної гістаміном шкірної реакції з проявами пухирів та запалення.
В одному з ранніх досліджень було оцінено ефект 2-тижневого лікування цетиризином (у дозі 10 мг), ебастином (у дозі 10 мг), епінастином (у дозі 20 мг), фексофенадином (у дозі 60 мг), лоратадином (у дозі 10 мг), терфенадином (у дозі 60 мг) або плацебо на викликану гістаміном шкірну реакцію з проявами пухирів та запалення у здорових чоловіків-добровольців (протягом 24 год після її виникнення). Хоча епінастин починав діяти найшвидше (папули й запалення зникали через 30 хв), загалом пригнічення реакції (як пухирів, так і гіперемії) в групі цетиризину було достовірно значнішим, ніж у групах інших препаратів (рис. 3). За показником площі під кривою (0–24 год) препарати утворили ряд: цетиризин > епінастин > терфенадин >ебастин > фексофенадин > лоратадин > плацебо.
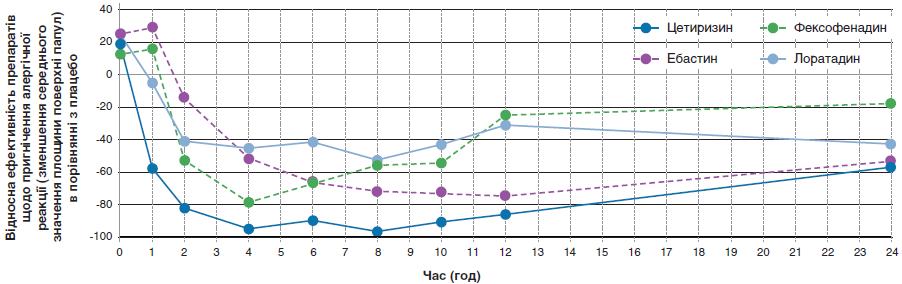
Рис. 3. Пригнічення утворення шкірних папул (як відповіді на внутрішньошкірну ін'єкцію гістаміну) у здорових добровольців, які перед тим отримували терапію різними пероральними АГП (адаптовано за J.A. Grant et al., 1999)
Перевагу цетиризину в дозі 10 мг (при одно- або кількаразовому прийомі) над акривастином, астемізоломом, хлорфенаміном (хлорфеніраміном), ебастином, епінастином, фексофенадином, лоратадином, мізоластином, оксатомідом і терфенадином в пригніченні гістамін-індукованої шкірної реакції з проявами пухирів та запалення у осіб з/без атопії було підтверджено в декількох дослідженнях. Окрім того, пізніші дослідження пригнічення гістамін-індукованої шкірної реакції нещодавно розробленими препаратами цього класу показали, що ефективність цетиризину в дозі 10 мг є вищою або дорівнює ефективності бепостатину, біластину, дезлоратадину, левоцетиризину й олопатадину.
Ефективність цетиризину в порівнянні з плацебо та/або іншими АГП у дорослих і дітей із САР і ЦАР/ПАР вивчено в низці контрольованих належним чином досліджень. Більшість із них були подвійними сліпими рандомізованими плацебо-контрольованими, проведеними у великих паралельних групах пацієнтів із одного або декількох центрів. Основоположним критерієм включення для всіх досліджень була наявність у пацієнтів із САР або ЦАР/ПАР задокументованих історій алергії до сезонних (пилок трав/дерев) або цілорічних (кліщі домашнього пилу, таргани, лупа тварин або цвіль) алергенів, підтверджених позитивними результатами шкірних та/або радіоалергосорбентних тестів на конкретні сенсибілізуючі алергени. Додатковим критерієм була наявність принаймні мінімального загального балу тяжкості симптомів (вираженого як сукупність окремих конкретних симптомів), який оцінюється суб'єктивно за допомогою визначення тяжкості симптомів з боку носа й очей за шкалою з підвищення тяжкості від 0 (симптоми відсутні) до 10 балів (тяжкі / дуже тяжкі симптоми).
Хоча більшість досліджень у хворих на САР, як правило, проводилася протягом певних сезонів пилкування, у рамках деяких досліджень вивчали вплив терапії із застосуванням спеціально обладнаних камер, що дало змогу дослідити контрольовані симптоми, викликані алергенами пилку, за відсутності впливу таких супутніх природних факторів, як різний вміст пилку в повітрі, наявність у повітрі кількох пилкових / непилкових алергенів, забруднювачі повітря, різні географічні / кліматичні умови.
У низці досліджень, присвячених порівнянню ефективності цетиризину і плацебо у дорослих пацієнтів із САР або ЦАР/ПАР, переважно оцінювали ефективність лікування цетиризином у дозі 10 мг один раз на день. Основним критерієм ефективності було зменшення загальної бальної оцінки симптомів до кінця лікування. Ці дослідження показали, що терапія цетиризином сприяє достовірному зниженню тяжкості загальних та індивідуальних симптомів у порівнянні з плацебо.
У масштабному багатоцентровому дослідженні з участю 415 пацієнтів із симптомами САР, у яких загальну тяжкість симптомів (чихання, ринорея, свербіж в очах, носі й піднебінні, сльозотеча й почервоніння очей) було попередньо оцінено як ≥ 6, досліджували ефективність цетиризину залежно від дози (5, 10 або 20 мг один раз на день) протягом 1 тижня, в кінці літа і на початку осені. Було показано, що цетиризин у всіх дозах значно ефективніше, ніж плацебо, знижував загальний бал оцінки симптомів протягом 7-денного курсу лікування (до 5,6 у дозі 5 мг, до 5,4 у дозі 10 мг і до 4,6 у дозі 20 мг проти 7,7 у групі плацебо; р < 0,05 для всіх груп у порівнянні з плацебо). Тяжкість симптомів при дозі цетиризину 20 мг знизилася значно більше у порівнянні з дозою 5 мг (р < 0,05). Загальна оцінка стану пацієнтів у кінці періоду лікування показала також, що кількість ефективно пролікованих пацієнтів була значно більшою (в порівнянні з плацебо) при застосуванні цетиризину у всіх дозах (72,7% пацієнтів при дозі 5 мг, 79,3% – при дозі 10 мг і 76,5% – при дозі 20 мг цетиризину проти 52,9% у групі плацебо; р < 0,05 для всіх доз у порівнянні з плацебо).
У двох дослідженнях, присвячених вивченню впливу цетиризину в дозі 10 мг на пов'язану зі здоров'ям якість життя хворих на САР, використовували опитувальник про якість життя пацієнтів із ринокон'юнктивітом (Rhinoconjunctivitis Quality of Life Questionnaire, RQLQ). J.J. Murray et al. (2002) досліджували когорту з 862 пацієнтів із симптомами алергії під час осіннього сезону і продемонстрували, що внаслідок 2-тижневої терапії цетиризином у дозі 10 мг значно поліпшилися як середній загальний бал за RQLQ, так і бали за окремими доменами опитувальника в порівнянні з групою плацебо (загальний бал зменшився на 1,3 у пацієнтів, що приймали цетиризин в дозі 10 мг, а в групі плацебо – на 0,9; р < 0,001). Крім того, поліпшення бальних оцінок загальної активності, сну, вирішення практичних задач і проблем з очами було клінічно значущим (при застосуванні зниження на ≥ 0,5 пункту від вихідного рівня як критерію мінімально значущої відмінності), а поліпшення, в порівнянні з вихідним, загального балу за RQLQ і комплексного показника TSSC (total symptom severity complex), що відображає загальну тяжкість 6 окремих ринокон'юнктивальних симптомів (чхання, ринореї, свербежу в носі, в очах, сльозотечі та постназального затікання) наприкінці лікування достовірно корелювали (r = 0,73; р < 0,001 для загального балу RQLQ і показника TSSC).
Оцінка впливу лікування на показники порушення працездатності / продуктивності навчання та повсякденної активності (work/school productivity and activity impairment, WPAI) із використанням спеціального опитувальника WPAI для пацієнтів із алергією (WPAI-AS) показала, що лікування цетиризином у дозі 10 мг в порівнянні з плацебо сприяло достовірному поліпшенню бальних показників за всіма доменами (окрім присвячених пропущеним робочим і аудиторним годинам). Особливо це стосувалося доменів загального погіршення працездатності та успішності, показники за якими поліпшилися (знизилися) в порівнянні з вихідними значеннями на 13,5 і 19,4% відповідно у пацієнтів, що отримували цетиризин в дозі 10 мг, і на 5,9 і 4,9% відповідно в осіб, які отримували плацебо (р < 0,001 для обох доменів).
У проведеному пізніше дослідженні з участю 400 пацієнтів із симптомами САР M.J. Noonan et al. (2003) підтвердили ці висновки, продемонструвавши, що лікування цетиризином у дозі 10 мг протягом 2 тижнів сприяло достовірно ефективнішому поліпшенню середніх значень загальних балів за TSSC (-3,85) і RQLQ (-1,42), ніж у групі плацебо (-2,56, р < 0,01 і -0,88, р < 0,001 відповідно). Бальні оцінки за всіма доменами RQLQ також поліпшилися достовірно більшою мірою в групі цетиризину (10 мг), а ступені вірогідних кореляцій між полегшенням симптомів і поліпшенням загального балу за RQLQ в групі цетиризину в кінці лікування були від помірного до сильного (r = 0,49-0,68; р < 0,01).
Вплив лікування цетиризином на пов'язану зі здоров'ям якість життя дітей було оцінено у відкритому непорівняльному дослідженні з участю 572 дітей за допомогою педіатричного опитувальника RQLQ (PRQLQ). Результати показали, що лікування цетиризином у дозі 10 мг один раз на день протягом 4 тижнів сприяло достовірному поступовому поліпшенню загального балу за PRQLQ і балів за всіма 5 доменами, а також балів за TSSC (для чихання, ринореї, свербежу в носі, свербежу в очах, сльозотечі і постназального затікання). Крім того, було виявлено сильну й достовірну кореляцію між поліпшенням загального балу за PRQLQ і балів за TSSC після двох (r = 0,39; р < 0,001) і чотирьох тижнів лікування (r = 0,48; р < 0,001).
Хоча було проведено відносно менше досліджень, присвячених прямому порівнянню ефектів цетиризину і плацебо у пацієнтів, які страждають на ЦАР/ПАР, у них, як правило, досліджували вплив лікування на тяжкість симптомів та якість життя. В одному з досліджень із участю дорослих пацієнтів вивчали вплив цетиризину в дозах 10 і 20 мг один раз на день протягом 4 тижнів, і було показано, що, за оцінкою лікаря, тяжкість симптомів достовірно зменшилася майже вдвічі в обох групах лікування (на 43 і 42% відповідно) в порівнянні з групою плацебо (зниження на 23%; р < 0,001 проти груп активного лікування).
Оцінка кількості пацієнтів, у яких тяжкість симптомів зменшилася більше ніж на 50%, показала, що цього рівня поліпшення досягла достовірно більша кількість пацієнтів, які отримували цетиризин в дозі 10 мг (62%), ніж пацієнтів групи плацебо (34% хворих). Хоча серед пацієнтів, які отримували цетиризин в дозі 20 мг, у 49% тяжкість симптомів теж зменшилася більше ніж на 50%, різниця з групою плацебо не була достовірною.
Дозозалежний ефект цетиризину вивчали в масштабному дослідженні з участю 328 дітей віком 6–12 років. Препарат приймали в дозі 2,5, 5,0 або 10,0 мг один раз на день протягом 2 тижнів. Хоча оцінка частки днів без будь-яких симптомів або тільки з легкими проявами симптомів показала, що в цьому відношенні цетиризин був достовірно ефективнішим, ніж плацебо, лише в дозі 10 мг (14,4% для групи цетиризину в дозі 10 мг проти 7,1% для групі плацебо; р = 0,008), оцінка частки днів без тяжких проявів симптомів показала достовірно вищу, ніж у плацебо, ефективність цетиризину у всіх дозах (80,7, 79,3 і 84,5% для цетиризину у дозах 2,5, 5,0 і 10,0 мг відповідно в порівнянні з 70,0% для групи плацебо; достовірно для всіх порівнянь).
В іншому дослідженні також було показано, що у дорослих пацієнтів із ЦАР лікування цетиризином у дозі 10 мг один раз на день протягом 6 тижнів у порівнянні з прийомом плацебо достовірно збільшило кількість днів без будь-яких або тільки з легкими проявами симптомів (42% у групі цетиризину проти 2,6% у групі плацебо; р = 0,0001) і сприяло достовірно більш значному поліпшенню якості життя, починаючи з 1-го тижня лікування й надалі. Масштаби поліпшення, виражені в частці днів без проявів симптомів або тільки з легкими проявами симптомів, свідчить про те, що цетиризин може бути навіть більш ефективним протягом більш тривалих періодів лікування.
У кількох дослідженнях порівнювали ефективність цетиризину й інших зазвичай вживаних і нових АГП II у терапевтичних дозах при лікуванні підлітків/дорослих пацієнтів із САР, а також підлітків/дорослих та педіатричних пацієнтів із ЦАР/ПАР. У більшості з цих досліджень порівнювали безпосередньо ефекти різних антигістамінних препаратів і цетиризину та/або плацебо на зниження показників тяжкості симптомів, використовуючи різні комбінації оцінок окремих симптомів як основну міру ефективності.
Низку ранніх досліджень було присвячено порівнянню ефективності астемізолу, терфенадину або ебастину з ефективністю цетиризину при амбулаторному лікуванні підлітків/дорослих із симптомами САР під час сезону пилкування. Зіставлення ефективності 2-тижневого лікування з одноразовим на день прийомом астемізолу (10 мг) або цетиризину (5/10 мг) продемонструвало, що, хоча в пацієнтів усіх груп достовірно зменшилася загальна тяжкість симптомів у порівнянні з вихідною, достовірної відмінності за ефективністю між різними схемами лікування не було. Незважаючи на відсутність різниці за тяжкістю симптомів у кінці лікування, задоволення його результатом висловили значно більше пацієнтів групи цетиризину (65%), ніж групи астемізолу (51%, р < 0,05).
Дослідження, присвячене порівнянню ефективності терфенадину (у дозі 60 мг два рази на день) або ебастину (в дозі 10 мг один раз на день) з ефективністю цетиризину (в дозі 10 мг один раз на день) при курсі лікування 2 тижні, показало, що цетиризин настільки ж ефективно, як терфенадин і ебастин, поліпшував симптоми риніту за оцінками як пацієнтів, так і дослідників. В одному рандомізованому подвійному сліпому з подвійним маскуванням дослідженні порівняли ефект лікування лоратадином (10 мг один раз на день), цетиризином (10 мг один раз на день) або плацебо у 279 хворих на САР підлітків і дорослих протягом 2 днів поспіль на тлі природного впливу пилку в парку під час сезону пилкування.
Насамперед автори оцінювали вплив лікування на зміни в порівнянні з вихідним рівнем бальних оцінок комплексу основних симптомів (major symptom complex, MSC – сукупності окремих показників для основних симптомів ринореї, закладеності, свербежу в носі, сякання, чхання і сльозотечі) і загального симптомокомплексу (total symptom complex, TSC – поєднання MSC і балів за симптомами свербежу в очах або вухах, свербежу в горлі, кашлю й постназального затікання). Було показано, що терапія цетиризином сприяє достовірно більшому зниженню середніх загальних значень цих показників, ніж лікування лоратадином або плацебо: MSC зменшився на 4,1 балу в групі цетиризину проти 2,3 балу в групі лоратадину після перших 24 годин лікування (р < 0,01) і на 7,5 балу проти 6,2 балу – в кінці дослідження (р < 0,05); TSC зменшився на 6,3 балу в групі цетиризину проти 3,8 балу в групі лоратадину після перших 24 годин лікування (р < 0,01), і на 11,9 балу проти 10,1 балу – в кінці дослідження (р < 0,05). Крім того, цетиризин продемонстрував достовірно швидший початок дії (< 2 год) і більш значне зниження симптомів протягом 24 год, а також, за оцінками пацієнтів, достовірно краще поліпшував загальний стан, ніж лоратадин (у 73,6% пацієнтів в групі цетиризину проти 56,5% пацієнтів у групі лоратадину; р < 0,05). Терапія лоратадином суттєво не змінила значення показників MSC і TSC в порівнянні з плацебо.
У двох дослідженнях, присвячених вивченню ефекту лоратадину на алерген-індуковані симптоми АР в осіб, «оброблених» пилком в умовах відтворення впливу навколишнього середовища, було підтверджено загальний висновок щодо відсутності істотної різниці між ефективністю лоратадину (одноразового прийому в дозі 10 мг) і плацебо для полегшення як клінічно значущих, так і остаточних симптомів, а також для значущого зменшення середніх значень показників TSC і MSC у кінці дослідження в порівнянні з початковими значеннями.
У подальшому дослідженні, проведеному в умовах відтворення впливу навколишнього середовища, вдалося продемонструвати значущі відмінності у зменшенні середніх значень TSC і MSC в порівнянні з вихідними між групами лоратадину (10 мг) і плацебо. Проте порівняння з цетиризином у всіх цих дослідженнях показало, що при одноразовому прийомі 10 мг він достовірно ефективніше, ніж лоратадин (10 мг) і плацебо, забезпечував як полегшення симптомів, так і зниження загального балу тяжкості симптомів, і що ці ефекти спостерігалися протягом усього 28,5-годинного періоду дослідження після введення першої дози препарату.
Порівняння ефективності фексофенадину (180 мг) і цетиризину (10 мг) у пацієнтів із САР, «оброблених» пилком в умовах відтворення впливу навколишнього середовища, також показало, що цетиризин достовірно перевершує фексофенадин і плацебо в зменшенні симптомів АР протягом усього періоду дослідження після введення першої дози.
Однак в інших дослідженнях не було продемонстровано жодних істотних відмінностей між фексофенадином (120/180 мг) і цетиризином (10 мг) при лікуванні симптомів АР у пацієнтів, що зазнали впливу пилку в експериментальних або природних сезонних умовах, хоча всі активні методи лікування були значно ефективнішими, ніж плацебо.
У декількох дослідженнях з використанням менш широко застосовуваних або нових АГП для лікування симптомів у сенсибілізованих і симптоматичних пацієнтів із САР під час сезону пилкування трав/дерев також не було показано істотних відмінностей між дією цетиризину і мізоластину, емедастину, рупатадину, біластину або азеластину у терапевтичних дозах, хоча всі активні методи лікування були значно ефективнішими у зниженні показників загальної тяжкості характерних симптомів у порівнянні з вихідним рівнем або в порівнянні з плацебо.
Для азеластину, який застосовували у вигляді назального спрею, було отримано суперечливі дані у двох масштабних багатоцентрових порівняльних випробуваннях у США. В одному з них, в якому брали участь 354 пацієнти, не вдалося продемонструвати будь-яких істотних відмінностей між ефективністю цетиризину (по 10 мг 4 рази на день) і азеластину (по 2 впорскування в ніздрі 2 рази на день) у зменшенні загального показника назальних симптомів (поєднання окремих показників для основних симптомів: ринореї, чхання, свербежу в носі, закладеності носа) в кінці 2-тижневого періоду лікування в порівнянні з вихідним (19,6 проти 23,9% для цетиризину і азеластину відповідно; р < 0,0001 для обох активних речовин проти вихідних значень). Проте інше дослідження аналогічного дизайну з участю 307 пацієнтів показало, що азеластин був значно ефективнішим у цьому відношенні, ніж цетиризин (показники змінилися в порівнянні з вихідними на 23 проти 29,3% в групах цетиризину і азеластину відповідно; р < 0,001 для обох активних речовин проти вихідних значень і р = 0,015 для азеластину проти цетиризину). Хоча обидва дослідження показали, що цетиризин і азеластин достовірно поліпшують якість життя пацієнтів в порівнянні з початковим рівнем, таке поліпшення було більш значущим для групи лікування азеластином (загальний бал RQLQ / вихідне значення становили 1,11/1,13 для цетиризину і 1,35/1,41 для азеластину; р < 0,001 для обох активних речовин проти вихідного рівня та р < 0,01/0,05 для азеластину/цетиризину).
Порівняно меншу кількість досліджень було присвячено вивченню ефективності АГП II у пацієнтів, які страждають на ЦАР/ПАР. На відміну від досліджень з участю хворих на САР, у них часто оцінювали вплив препаратів протягом 4 тижнів або довше – через більш хронічний характер симптомів. У двох дослідженнях вивчали вплив лоратадину, кетотифену і оксатоміду у педіатричних хворих, і було показано, що всі препарати сприяють значущому зменшенню симптомів АР у порівнянні з вихідними і в порівнянні з плацебо.
Порівняння ефектів цетиризину, кетотифену й оксатоміду додатково показали, що цетиризин забезпечує достовірно більше зниження середніх бальних оцінок загальних симптомів до кінця лікування у порівнянні з вихідним рівнем у (зниження на 63,7% у групі цетиризину, на 48,6% у групі кетотифену і на 48,1% у групі оксатоміду; р < 0,05 для цетиризину проти кетотифену/оксатоміду). Хоча всі активні препарати також поліпшували якість життя дітей, пов'язану зі здоров'ям (про що свідчило зменшення середніх загальних оцінок за PRQLQ після 12 тижнів лікування), тільки ефекти цетиризину і оксатоміду були достовірними в порівнянні з плацебо (середній бал за PRQLQ = 46,9 для групи плацебо проти 26,9 для групи цетиризину і 26,2 для групи оксатоміду; р < 0,05 для порівняння групи плацебо з групами цетиризину/оксатоміду).
Оцінка впливу на еозинофілію показала, що цетиризин достовірно зменшував вміст еозинофілів у назальному секреті в порівнянні з вихідним рівнем. Дослідження впливу на цей показник терфенадину, ебастину, лоратадину, рупатадину і біластину також показали, що лікування цими препаратами приводить до достовірно більш значного зменшення симптомів і їхньої тяжкості в порівнянні з початковим рівнем або в порівнянні з групою плацебо у підлітків / дорослих пацієнтів із ЦАР/ПАР.
Окрім того, що цетиризин сприяв достовірному зменшенню симптомів і їх тяжкості в порівнянні з вихідним рівнем або з групою плацебо, було також виявлено значущі відмінності на користь лікування цетиризином між групами пацієнтів, які отримували цетиризин і ебастин: за середніми значеннями показників загальної тяжкості симптомів після 1-го тижня лікування і за часткою пацієнтів, повністю вільних від симптомів, після 4-го тижня лікування. Крім поліпшення симптомів АР, лікування цетиризином у дозі 10 мг настільки ж ефективно, як і терапія лоратадином у дозі 10 мг, знижувало більш ніж на 20% вміст еозинофілів у назальному секреті у достовірно більшої кількості пацієнтів, як порівняти з плацебо, і так само ефективно, як лікування рупатадином у дозі 10 мг, достовірно поліпшувало загальний бал за RQLQ у порівнянні з плацебо через 4 і 12 тижнів лікування.
Варто зазначити, що цетиризин був також використаний як активний препарат порівняння для кількох схем лікування, які не передбачали застосування антигістамінних засобів і ефективність яких для пацієнтів із АР вивчалася в дослідженнях. В одному з них порівнювали ефект рандомізованого подвійного сліпого лікування протягом 1 року інтраназальним будесонідом у дозі 400 мкг і пероральним цетиризином у дозі 10 мг на частоту рецидивів у пацієнтів із ЦАР після припинення лікування. Результати показали, що рецидив протягом першого місяця значно рідше траплявся у пацієнтів, які отримували будесонід (у 38%), ніж у тих, хто отримував цетиризин (у 56%, р < 0,05); різниця за медіаною часу до першого рецидиву була статистично недостовірною (62 проти 20 днів відповідно).
У двох дослідженнях порівнювали також ефект монтелукаста, антагоніста лейкотрієнових рецепторів, і цетиризину. Результати одного плацебо-контрольованого дослідження з участю дітей із ЦАР показали, що лікування монтелукастом у дозі 4 мг один раз на день або цетиризином у дозі 5 мг один раз на день протягом 12 тижнів привело до достовірно значнішого зменшення в кінці періоду лікування (в порівнянні з вихідним рівнем) середніх значень сумарних оцінок симптомів, загальних балів за PRQLQ, опору носових дихальних шляхів і частки еозинофілів у носових мазках, ніж у групі плацебо.
Крім того, цетиризин значно перевершував монтелукаст за ефективністю зменшення бальних оцінок загальних симптомів в кінці лікування. В іншому дослідженні у дорослих пацієнтів із ЦАР, які отримували монтелукаст (10 мг) або цетиризин (10 мг) протягом 6 тижнів, достовірно (в порівнянні з вихідним рівнем) знизилися середні показники вираженості назальних симптомів у денний час після 4 тижнів, але не після 6 тижнів лікування (в порівнянні обох активних методів лікування з плацебо).
Було також досліджено ефект 2-річного курсу специфічної імунотерапії у порівнянні з лікуванням цетиризином у дозі 10 мг один раз на день, яке проводилося хворим із тяжким ПАР безперервно або за необхідності. Результати показали, що імунотерапія і безперервне лікування цетиризином були достовірно ефективнішими, ніж лікування цетиризином за необхідності, і сприяли достовірному зниженню вмісту ICAM-1 і еозинофільного катіонного протеїну до порівнянних значень у кінці лікування (в порівнянні з вихідним рівнем). Крім того, наприкінці терапії 75% пацієнтів у групі імунотерапії і 78% пацієнтів у групі безперервного лікування цетиризином звільнилися від проявів ринореї, закладеності носа, чхання, гіпосмії, відчуття чужорідного тіла в оці та сльозотечі, в порівнянні з 24% пацієнтів у групі лікування цетиризином за необхідності.
Нещодавно було висловлено припущення, що антагонізм до Н3-гістамінових рецепторів може доповнювати добре підтверджені переваги антагонізму до Н1-рецепторів при АР. Проведено попереднє дослідження, присвячене порівнянню ефективності двох нових подвійних антагоністів H1/H3-рецепторів (інтраназальної суспензії GSK1004723 та перорального препарату GSK835726) і цетиризину в дозі 10 мг у пацієнтів із САР, «оброблених» алергеном в умовах відтворення впливу навколишнього середовища. Дослідження показало, що пероральний препарат GSK835726 у дозах 10, 50 і 100 мг одноразово на день і в дозі 10 мг 3 рази на день сприяє клінічно достовірному послабленню симптомів, порівнянному з дією цетиризину в дозі 10 мг. Хоча застосування інтраназальної суспензії GSK10047233 в дозі 1 мг 3 рази на день (але не в дозах 0,22 або 1 мг 1 раз на день) значно послаблювало симптоми (в порівнянні з рівнем до лікування), ефект не був настільки помітним, як при застосуванні перорального препарату GSK835726 або цетиризину в дозі 10 мг.
Хоча дизайн кожного клінічного дослідження, як правило, передбачає можливість повідомляти про побічні реакції на препарати, зростає кількість досліджень, спрямованих на вивчення конкретних параметрів безпеки. Добре відомо, що при використанні цетиризину немає кардіотоксичного потенціалу, який був предметом заклопотаності під час застосування деяких перших АГП II. Не було також зареєстровано згубного впливу цетиризину на вагітних або жінок-годувальниць. Управління з контролю за харчовими продуктами й лікарськими препаратами (FDA, США) зараховує цетиризин до категорії B безпеки застосування у вагітних, тобто до таких, які не шкодять тваринним і людським плодам. Слід зазначити, що деякі інші широко використовувані АГП II, наприклад дезлоратадин і фексофенадин, належать до категорії С (є відомості про шкоду для тваринних плодів, про вплив на людський плід невідомо).
Хоча дослідження з суб'єктивним оцінюванням впливу цетиризину на центральну нервову систему дають суперечливі дані, дослідження з використанням об'єктивних оцінок, наприклад тестів на водіння автомобіля і психомоторну працездатність, однозначно показали, що цетиризин у терапевтичних дозах, як правило, викликає психомоторні розлади не частіше, ніж плацебо. Було також показано, що профілі небажаних ефектів цетиризину й астемізолу, ебастину, фексофенадину, лоратадину, мізоластину або терфенадину є порівнянними; побічні реакції на цетиризин зазвичай незначно або помірно виражені. Важливо зазначити, що в найтривалішому з клінічних випробувань антигістамінних препаратів, розпочатому ще в XX столітті, дослідженні ЕТАС, з участю дітей віком 18–24 місяців за принципом рандомізації, показано, що безперервне лікування цетиризином протягом 18 місяців не супроводжувалося ні побічними реакціями у вигляді неврологічних і поведінкових подій, ні впливом на такі показники розвитку, як зріст, маса тіла, дрібна й велика моторика, мова й мовні навички, результати гематологічних та біохімічних тестів. Частка несприятливих подій під час лікування цетиризином в рамках дослідження ETAC, за свідченнями дослідників, подібна до такої в групі плацебо.
Велика кількість доказів демонструє, що цетиризин є досить ефективним, швидкодіючим препаратом, який добре переноситься і поліпшує якість життя. Його можна використовувати при лікуванні дітей, підлітків і дорослих пацієнтів, які страждають на АР від помірного до тяжкого ступеня. У нещодавньому огляді, присвяченому АГП II, було показано, що цетиризин є найбільш вивченим і одним із найпотужніших серед доступних антигістамінних препаратів. Його можна застосовувати у пацієнтів, у яких лікування іншими антигістамінними препаратами було неефективним, і в осіб із тяжкими симптомами, які можуть отримати вигоду від лікування антигістамінним препаратом високої потенції, дозу якого можна підвищувати до досягнення максимальної ефективності.
Докази, представлені в цьому огляді, ще раз демонструють таке: незважаючи на те, що цетиризин був одним із перших АГП II, розроблених більше двох десятиліть тому, він є одним із найбільш широко використовуваних у всьому світі антигістамінних препаратів. Його використання нині рекомендовано практично всіма міжнародними керівництвами для лікування АР, що базуються на даних доказової медицини. Порівняння цетиризину з іншими АГП II, старими й новими, як правило, демонструє його більш сприятливий фармакологічний профіль і принаймні таку саму або вищу ефективність у зменшенні симптомів АР і поліпшенні якості життя, пов'язаного зі здоров'ям, у пацієнтів із САР і ЦАР/ПАР. Крім даних щодо фармакологічних і клінічних профілів ефективності різних АГП II, цікавим спостереженням є те, що в більшості ранніх досліджень і в багатьох нещодавно проведених дослідженнях з участю пацієнтів із САР і ЦАР/ПАР цетиризин використовується як основний активний препарат порівняння для інших АГП II, незалежно від використання плацебо.
На підставі результатів досліджень, у яких вивчали клінічну ефективність засобів традиційної і нетрадиційної фармакотерапії при АР, і даних про те, що цетиризин широко використовується як активний препарат порівняння з іншими АГП II, заманливо припустити, що цетиризин може слугувати належним еталоном / золотим стандартом для оцінки безпеки й ефективності нових засобів медикаментозної терапії АР.
Реферативний огляд підготувала Наталія Купко за матеріалами Zhang L., Cheng L., Hong J. . Pharmacology. 2013; 92: 14-25 (doi: 10.1159/000351843)
Інформаційний матеріал підготовлений за підтримки компанії «Др. Редді'с Лабораторіс Лімітед»
Цитується за джерелом: Клінічна імунологія. Алергологія. Інфектологія. № 3–4 (82–83) 2015
ЦЕСОЗ1-06/07/2017-ОТС
Запрошуємо переглянути запис прямого ефіру на тему "Запалення як мета комплексної терапії хронічних захворювань верхніх дихальних шляхів"
Науково-практичний кейс-марафон SHDM.SCHOOL
SHDM.FORUM'24: головна подія року!
Інформація, опублікована на даному сайті, орієнтована на загальне ознайомлення та жодним чином не може бути використана в якості медичних, практичних або комерційних рекомендацій. У зв’язку з цим, Сайт «Школи доказової медицини» не несе жодної відповідальності за негативні наслідки, отримані через використання матеріалів, викладених на даному сайті. Документація з фармацевтичних продуктів не є рекламою та не призначена для того, щоб використовувати її замість консультації з кваліфікованими фахівцями в галузі медицини та інших галузях. Документація з фармацевтичних продуктів надається за вашою згодою відповідно до вимог ч.ч. 1, 2 ст. 15 Закону України «Про захист прав споживачів» від 12.05.1991 р. № 1023-XII. Якщо вам потрібна консультація з конкретного питання, пов’язаного зі здоров’ям, необхідно звернутися до фахівців- професіоналів.
Продовжуючи своє перебування на сайті, ви підтверджуєте свою згоду на дистанційне отримання інформації про лікарські та косметичні засоби (включаючи інформацію про рецептурні лікарські засоби) на підставі вимог ч.ч. 1, 2 ст. 15 Закону України «Про захист прав споживачів» від 12.05.1991 р. № 1023-XII.
Уся інформація, яка міститься на даному сайті, подана з освітньою метою виключно для медичних та фармацевтичних працівників і не замінює консультації лікаря.
