Флоріан М. Вагенленер1, Дмитро Абрамов-Соммаріва2, Мартіна Геллер2, Губерт Штайндль2, Курт Г. Набер3
1Клініка урології, дитячої урології та андрології, Університет ім. Юстуса Лібіха, м. Гісен, Німеччина
2Компанія «Біонорика РЄ» (Bionorica SE), м. Ноймаркт, Німеччина
3Мюнхенський технічний університет, м. Штраубінг, Німеччина
Вступ. Мета даного рандомізованого контрольованого клінічного дослідження неменшої ефективності III фази полягає в тому, щоб підтвердити неменшу ефективність рослинного лікарського препарату Канефрон Н (BNO 1045) у порівнянні з фосфоміцину трометамолом (ФТ) для лікування гострих неускладнених інфекцій нижніх сечовивідних.
Матеріали та методи. Жінки 18-70 років, у яких була вперше діагностована гостра нІНМП з типовими симптомами, були рандомізовані для прийому BN0 1045 (n=325) або ФТ (n=334) та відповідного плацебо. Первинною кінцевою точкою була відсоткова частка пацієнток, які додатково отримували антибіотики (АБ) для лікування НІМП у період між Днем 1 і Днем 38±3.
Результати. У період між Днем 1 та Днем 38 238 пацієнток (83,5%) у групі застосування BN0 1045 та 272 (89,8%) пацієнтки у групі застосування ФТ не приймали додаткових АБ. При межі неменшої ефективності, що становить 15%, BN0 1045 продемонстрував неменшу ефективність порівняно з ФТ при лікуванні нІНМП (різниця в показнику незастосування АБ склала -6,26%; 95% довірчий інтервал [ДІ] - від -11,99% до - 0,53%;р - значення при застосуванні двостороннього критерію = 0,0014). Частота виникнення небажаних явищ була однаковою в обох групах, хоча в групі застосування ФТ відзначалася більш висока частота порушень з боку шлунково-кишкового тракту, а в групі BN0 1045 – вища частота пієлонефриту. Протягом дослідження не було випадків смерті пацієнток або припинення лікування через небажане явище, спричинене застосуванням препарату.
Висновки. Препарат BNO 1045 має потенціал знизити споживання АБ при лікуванні нІНМП і, отже, може суттєво вплинути на стратегію раціонального застосування протимікробної терапії. Реєстраційний номер дослідження: NCT02639520; номер у Європейському реєстрі клінічних досліджень (EudraCT): 2013-004529-99.
Ключові слова: інфекція сечових шляхів, симптоматичне лікування, рослинні лікарські препарати, антибіотики.
Інфекції сечовивідних шляхів (ІМП) належать до найпоширеніших інфекційних захворювань у загальній медичній практиці [1, 2]. У 80% випадків ці інфекції класифікуються як неускладнені ІМП (НІМП) [3]. У сучасних протоколах лікування гострих НІМП рекомендується як терапія першої лінії застосовувати антибіотики (АБ) [4].
Однак часте застосування АБ може призвести до порушення мікробіома [5] та збільшити ризик антибіотикорезистентності [6].
Приблизно в 80% випадків німп у жінок, в іншому здорових, викликає бактерія Escherichia coli (Е. coli) [2]. Міжнародні дані свідчать, що у час стійкість Е. coli до більшості загальновживаних АБ перевищує 25%. Зокрема, при внутрішньолікарняних ІМП стійкість до ципрофлоксацину становить близько 45,5%, триметоприму/сульфаметоксазолу – близько 48,2%, амінопеніциліну – близько 50,4% [7].
Щоб запобігти надмірному споживанню АБ і, отже, посиленню стійкості до протимікробних препаратів, необхідно знайти ефективні замінники АБ для лікування НІМП. У попередніх дослідженнях порівнювалася ефективність АБ та альтернативних препаратів, таких як нестероїдні протизапальні препарати (НПЗП) ібупрофен [8, 9] та диклофенак [10], при цьому були отримані перспективні результати з точки зору ефективності. Проте не меншу ефективність таких препаратів ще потрібно підтвердити.
Лікарські препарати на рослинній основі є ще однією потенційною альтернативою антибіотикам для лікування НІМП. Стейндж (Stange) та співавт. [11] опублікували результати клінічного дослідження, у ході якого порівнювали фітокомбінацію кореня хрону звичайного та настурції з антибіотиком (ко-тримоксазолом) для лікування гострих НІМП у чоловіків та жінок. Хоча при порівнянні цих двох препаратів не менша ефективність не була доведена, результати продемонстрували потенціал рослинних препаратів як альтернативу антибіотикам.
Канефрон® Н (далі – BNO 1045) зареєстрований як рослинний лікарський препарат у 28 країнах, включаючи Німеччину, Росію та Україну. Препарат BNO 1045 являє собою покриті оболонкою таблетки, що містять подрібнений золототисячник (Centaurii herba), подрібнений корінь любистку (Levistici radix) та подрібнене листя розмарину (Rosmarini folium). Фармакологічні дані щодо BNO 1045, документально підтверджені в ряді експериментальних моделей in vivo та in vitro, свідчать про те, що препарат має протизапальну [12, 13], спазмолітичну [14], антиадгезивну [12] та антиноцицептивну дію [15], а також має діуретичні властивості [16]. На відміну від АБ, подібних до фосфоміцину, які істотно змінюють склад мікробіома, BNO 1045 значною мірою зберігає мікробіоту кишечника [17]. Це має особливе значення у зв'язку з результатами недавніх досліджень мікробіоти сечовивідних шляхів, згідно з якими асимптоматична бактеріурія відіграє важливу захисну роль при ІМП, що можна було б використовувати при розробці стратегії профілактичного лікування рецидивуючих інфекцій [18].
Безпека та ефективність BNO 1045 були продемонстровані в раніше нерандомізованому багатоцентровому відкритому пілотному дослідженні за участю пацієнтів з гострими неускладненими інфекціями нижніх сечі вивідних шляхів [19]. У цьому дослідженні у 71,2% пацієнтів відзначалася клінічна відповідь на застосування BNO 1045 як монотерапія, при цьому препарат загалом добре переносився.
Мета цього клінічного дослідження полягала в тому, щоб продемонструвати неменипу ефективність BNO 1045 у порівнянні з АБ-терапією, що визначається за відсотковою часткою пацієнток, які в ході дослідження додатково отримували АБ для лікування НІНМП, а також оцінити безпеку та переносимість BNO 1045 у пацієнток з гострими. НІНМП. Антибіотик фосфоміцин (у вигляді фосфоміцину трометамолу [ФТ]) був обраний як препарат порівняння, оскільки в сучасних клінічних керівництвах Європейської асоціації урологів (ЕАУ) він рекомендується як препарат першої лінії (в одноразовій пероральній дозі 3 г) [4].
Дизайн дослідження
Дане дослідження було подвійним сліпим з подвійною імітацією (маскуванням; double-dummy) контрольованим рандомізованим багатоцентровим міжнародним дослідженням не меншої ефективності в паралельних групах, проводилося в 51 європейському дослідницькому центрі: у 16 центрах у Німеччині, 23 центрах в Україні та 22 центрах на Україні (номер EudraCT – 2013-004529-99, реєстраційний номер на сайті clinicaltrials.gov – NCT02639520). Дослідження було затверджено всіма відповідними інстанціями та комітетами з питань етики.
Пацієнти
Пацієнтами, які відповідають критеріям для участі в дослідженні, були жінки 18–70 років, у яких сумарний показник «Шкали оцінки типових симптомів гострого циститу» (англ. ACSS: Acute Cystitis Symptom Score) за 3 основними симптомами ніІМП (дизурія, полла до сечовипускання) станом на День 1 становив >6 балів, а також було отримано позитивний результат аналізу на лейкоцитарну естеразу, що свідчить про лейкоцитурію. Пацієнтки мали мати виражені симптоми не довше 6 днів до Дня 1, бути готовими відмовитися від прийому лікарських препаратів та продуктів, заборонених протоколом дослідження. До участі в дослідженні допускалися жінки, які перенесли хірургічну стерилізацію, які перебувають у періоді постменопаузи або готові користуватися високоефективними методами контрацепції протягом клінічного дослідження. Пацієнтки не включалися до дослідження, якщо ознаки або симптоми, що є у них станом на День 1, вказували на ускладнену ІМП, пієлонефрит та (або) вульвовагініт; якщо вони мали захворювання, здатні призвести до ускладнення інфекції, або в анамнезі була рецидивна інфекція сечовивідних шляхів. Усі пацієнтки підписали форму поінформованої згоди на участь у дослідженні. Головними критеріями включення/невключення 1 дослідження були такі.
1 Повний перелік критеріїв включення та невключення міститься у додаткових матеріалах на сайті, на сторінках 5 та 6 (додаткові матеріали знаходяться на сайті ).
Критерії включення:
Критерії невключення:
Методом випадкового вибору пацієнтки розподілялися в пропорції 1:1 до групи застосування BNO 1045 та плацебо, що імітує ФТ, або до групи застосування ФТ та плацебо, що імітує BNO 1045. Рандомізаційна послідовність формувалася з блоків, визначених комп'ютером; номери учасниць об'єднувалися в блоки, розмір блоку дослідникам не повідомлявся. Завдання підготовки та перевірки рандомізаційного списку виконувалось за допомогою валідованої комп'ютеризованої системи. Результати розподілу до терапевтичних груп не були відомі ні пацієнткам, ні дослідникам.
|
Вид процедури |
Лікування |
Спостереження |
|||
|
Візит 1 |
Візит 21 |
Візит 3 |
Візит 42 |
НВ |
|
|
День 1 |
День 4±1 |
День 8±1 |
День 38±3 |
||
|
Поінформована згода |
X |
||||
|
Оцінка критеріїв включення/невключення |
X |
||||
|
Демографія |
X |
||||
|
Медичний анамнез |
X |
||||
|
Попередні/супутні препарати |
X |
X |
X |
X |
X |
|
Фізикальний огляд3 |
X |
X1 |
X |
X |
(X) |
|
Життєві показники |
X |
X4 |
X |
X |
(X) |
|
Заповнення опитувальника ШСОЦ |
X |
X5 |
X |
X |
X |
|
Тест на вагітність (сеча) |
X |
X |
(X) |
||
|
Статус сексуальної активності |
X |
||||
|
Аналіз сечі (тест-смужки та посів з антибіотикограмою) |
X |
X |
X |
X |
|
|
Цитокіни, простагландини та креатинін сечі (тільки в заздалегідь відібраних центрах) |
X |
X |
|||
|
Лабораторні дослідження безпеки (кров) |
X |
X |
X |
(X) |
|
|
Рандомізація |
X |
||||
|
Видача ІМП* |
X |
||||
|
Небажані явища |
X |
X |
X |
X |
X |
|
Використання додаткових антибіотиків |
X |
X |
X |
X |
|
|
Дотримання режиму прийому (підрахунок комплаєнсу) |
X4 |
X |
X7 |
X6 |
|
|
Загальна оцінка ефективності лікування лікарем та пацієнтом |
X |
X |
|||
|
Загальна оцінка переносимості лікування лікарем та пацієнтом |
X |
X |
|||
|
Повернення невикористаного ІМП/порожніх упаковок |
X |
X7 |
(X) |
||
ШСОЦ - "Шкала оцінки симптомів гострого циститу"; ІМП - досліджуваний медичний препарат; НВ – незапланований візит.
* Дата та час попереднього прийому їжі фіксувалася в карті пацієнта (фосфоміцин трометамол приймався за 2 години до або після прийому їжі).
1 – Візит міг бути проведений у центрі або по телефону.
2 - НВ міг бути виконаний у будь-який час між Візитом 1 і Візитом 4, якщо дослідник вважав його проведення необхідним.
3 – Стандартний фізикальний огляд проводився на Візит 1 та Візит 4; інших візитах міг бути проведено фізикальний огляд, спрямований виявлення урологічної симптоматики.
4 – Контроль за дотриманням режиму прийому (підрахунок комплаєнсу) проводився, тільки якщо Візит 2 проходив у центрі.
5 – У разі телефонного візиту опитувальник ШСОЦ заповнювався пацієнтом удома і відразу ж надсилався досліднику поштою.
6 – Підрахунок комплаєнсу проводився, тільки якщо НВ проходив між Візитом 1 та Візитом 3.
7 – Тільки якщо весь виданий ІМП, включаючи упаковки, вже не повернуто на Візит 3.
За загальне управління дослідженням відповідала контрактна дослідницька організація; головний дослідник у кожному дослідному центрі відповідав за набір пацієнток. У процесі отримання поінформованої згоди пацієнткам давали рекомендації щодо застосування препаратів.
Пацієнтки у групі застосування ФТ отримували 5,631 г ФТ (еквівалентно 3 г фосфоміцину) у вигляді гранул, які потрібно було розчинити у 100–200 мл води та відразу ж прийняти внутрішньо. Препарат застосовувався у День 1 дослідження, одноразово, під безпосереднім наглядом лікаря. Пацієнтки в групі застосування BNO 1045 отримували покриті оболонкою таблетки, що містять 18 мг подрібненого золототисячника (Centaurii herba), 18 мг кореня любистку (Levistici radix) та 18 мг листя розмарину (Rosmarini folium). Пацієнтки приймали по 2 таблетки BNO 1045 перорально 3 рази на день протягом 7 днів до або після їди. Подрібнений рослинний матеріал, використаний у досліджуваному лікарському засобі (ІЛС), був виготовлений в рамках однієї виробничої серії та отриманий з рослин, що вирощуються та культивуються у певних контрольованих умовах, з дотриманням жорстких стандартів якості.
Лікування розпочиналося у День 1 та тривало протягом 7 днів до Дня 8 (додаткові матеріали представлені на сайті, сторінка 2). Період наступного спостереження становив 30 днів після останньої дози препарату (до Дня 38); його метою було визначити, чи виник рецидив НІМП. Дослідники заповнювали відповідні бланки для збирання даних.
Єдиним дозволеним супутнім препаратом для симптоматичного лікування був парацетамол.
Графік обстеження кожного пацієнта наведено у таблиці 1.
Основною метою клінічного дослідження було продемонструвати неменшу ефективність препарату BNO 1045 при застосуванні протягом 7 днів у порівнянні з одноразовою дозою ФТ у жінок з гострою нІНМП, що визначається за процентною часткою пацієнток, які в ході дослідження додатково отримували АБ для лікування гострої нІНМП.
Первинною кінцевою точкою ефективності був показник застосування АБ, що визначається як процентна частка пацієнток, які додатково отримували АБ для лікування гострої інфекції нижніх сечовивідних шляхів у період між Днями 1 та 38±3. Вторинні кінцеві точки ефективності включали показник шкали ACSS станом на Дні 4, 8 і 38, а також наявність бактеріурії і лейкоцитурії, що визначається шляхом аналізу посіву сечі (середня порція сечі) при кожному візиті в дослідний центр 2.
2 Повний перелік вторинних кінцевих точок наведено у додаткових матеріалах на сайті, сторінка 4 (додаткові матеріали знаходяться на сайті
Опитувальник ACSS є простою, стандартизованою, заповнюваною пацієнткою анкету для діагностики гострого неускладненого циститу, в якій оцінюються типові та диференціальні симптоми, якість життя (КЖ; англ. QoL – Quality of Life) та зміни після лікування [20, 21]. У цьому клінічному дослідженні використовувалися дві версії анкети: у День 1 заповнювалась частина А для оцінки стану на початковому рівні, а на наступних візитах (Дні 4, 8 та 38) заповнювалась частина В.
Частина А включала 18 питань, у тому числі 6 питань, що стосуються типових симптомів нІНМП (шкала ACSS-typical), 4 питання щодо симптомів для диференціального діагнозу (ACSS-dilferential), 3 питання з приводу якості життя (ACSS-QoL) і 5 питань про будь-які додаткові умови, які можуть вплинути на лікування (ACSS-additional). Відповіді на запитання оцінювалися за 4-бальною шкалою Лайкерта (де 0 = симптоми відсутні, 1 = легкі симптоми, 2 = помірні симптоми, 3 = тяжкі симптоми), крім розділу ACSS-additional, де даються відповіді «так/ні».
Частина В включала всі розділи частини А, а також додатковий розділ для оцінки змін симптомів ІМП на наступних візитах щодо Дня 1 за 5-бальною шкалою, де 0 = всі симптоми зникли, 1 = більшість симптомів зникли, 2 = деякі симптоми залишилися, 3 = всі симптоми залишилися, 4 = мій стан погіршується.
Усі пацієнтки користувалися затвердженою версією ACSS рідною мовою (німецька, польська, українська чи російська; www.acss.world).
Кінцеві точки безпеки, що оцінюються в даному дослідженні, включали небажані явища, що виникли в ході лікування (НЯ), лабораторні показники для оцінки безпеки (аналіз крові та сечі) у Дні 8 і 38, загальну переносимість (за оцінкою дослідників та пацієнток) по станом на Дні 8 та 38, фізикальне обстеження та визначення основних фізіологічних показників у Дні 1, 4, 8 та 38.
Кількість та процентна частка пацієнток, які приймали парацетамол протягом 24 годин до візиту, реєструвалися та аналізувалися з розбивкою за візитами та терапевтичними групами.
У вибірку пацієнток без порушень протоколу (англ. PPS – Per Protocol Set) включалися всі пацієнтки з вибірки для повного аналізу (англ. FAS – Full Analysis Set), які не мали серйозних відхилень від протоколу. Первинний аналіз проводився у вибірці PPS. Обсяг вибірки та статистична потужність визначалися з урахуванням наступних припущень та параметрів дизайну дослідження:
У вибірку для аналізу безпеки включалися всі пацієнтки, які прийняли ІЛС хоча б один раз. У вибірку FAS входили ті ж пацієнтки, що і вибірку для аналізу безпеки, але виключалися пацієнтки, дані яких могли бути демасковані. За клінічної необхідності лікар міг будь-коли запитати звіт про мікробіологічному аналізі; у таких випадках ці пацієнтки демаскувалися.
Запланований обсяг вибірки становив 322 рандомізовані пацієнтки у кожній терапевтичній групі (258 пацієнток у вибірці PPS), що забезпечувало статистичну потужність щонайменше 90% для демонстрації неменшої ефективності BNO 1045 у порівнянні з ФТ при можливому додатковому застосуванні АБ. Різницю визначали за допомогою критерію Феррінгтона та Маннінга.
Основною метою дослідження було вивчити варіанти, альтернативні антибіотикотерапії, для лікування гострих НІНМП. У дослідженні порівнювалися два різні механізми дії: симптоматична дія препарату BNO 1045 на організм та знищення бактерій за допомогою ФТ. Таким чином, було доцільно встановити межу неменшої ефективності, що становить 15%, замість звичайно застосовуваної межі 10%. Згідно з керівництвом Європейської асоціації урології (ЕАУ) [4], нІНМП вважається безпечною інфекцією, отже, у пацієнток, які не застосовували АБ, ризик не збільшувався.
Критерій Феррінгтона та Маннінга застосовувався для розрахунку різниці у відсоткових частках та для оцінки первинної кінцевої точки ефективності. Для визначення неменшої ефективності із застосуванням 1-стороннього критерію було встановлено рівень значущості а = 0,025. Розраховувався 95% ДІ із застосуванням 2-стороннього критерію. Цей критерій застосовувався також у вибірці FAS з метою оцінки робастності результатів у вибірці PPS.
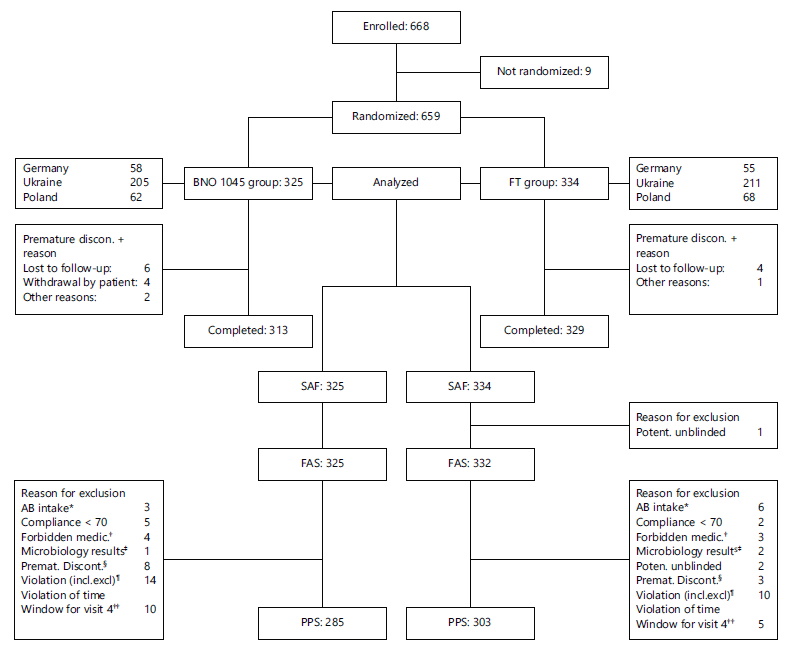
Рис. 1. Розподіл пацієнток
|
* Додатковий прийом АБ з можливим впливом протягом НІМП. |
FT group – група застосування ФТ |
|
Enrolled – включені у дослідження |
Різниця між групами в показниках шкали ACSS оцінювалася за допомогою критерію Вілкоксона - Манна - Уітні (для розподілу зразків, що тестуються) і із застосуванням ДІ за методом Ходжеса - Лемана (для медіанно-незміщеної оцінки медіанного значення у вибірці). Кількість бактерій визначали категорично (кількість колонієутворюючих одиниць [КОЕ] на 1 мл сечі <103, 103, 104, 105, 106 або >106), порівняння між терапевтичними групами проводили за допомогою критерію хі-квадрат. Порівняння між групами щодо процентної частки пацієнток, які застосовували парацетамол, також проводилося за допомогою критерію хі-квадрат.
Статистичний аналіз у цьому дослідженні не передбачав множинних перевірок, оскільки всі вторинні кінцеві точки аналізувалися з огляду на те, що вони мають пошуковий характер.
У період між 10 лютого 2016 року та 5 травня 2017 року до дослідження було включено 668 пацієнток. З них 659 пацієнток були рандомізовані: 325 - для застосування ВNО 1045 і плацебо, що імітує ФТ, 334 - для застосування ФТ і плацебо, що імітує ВNО 1045 (рис. 1). Дев'ять пацієнток не задовольняли всім критеріям включення або мали хоча б один критерій виключення, тому вони не були рандомізовані та не отримували досліджуваного препарату.
У таблиці 1 наведено характеристики пацієнток у вибірці PPS станом на День 1. Більшість пацієнток належали до європеоїдної раси (98,6%) і некурили (82,3%). Середній вік становив 44,3 роки, середня маса тіла – 68,6 кг, середній зріст – 165,0 см. Більшість пацієнток перебували у періоді пременопаузи (65,1%), мали репродуктивний потенціал (60,0%) та були сексуально активні (65,5%). Приблизно у 25% пацієнток відзначалися типові симптоми гострої нІНМП та піурія (див. критерії включення), але в посівах сечі на День 1 містилося менше 103 КУО/мл.
|
Характеристика |
Категорія |
BNO 1045 |
Візит 3 |
Візит 4 |
|
Вік, роки |
Середнє значення (стандартне відхилення – СО) |
43,7 (15,57) |
45,0 (16,41) |
44,3 (16,00) |
|
Медіанне значення (діапазон) |
42,0 (18-70) |
46,0 (18-74) |
44,0 (18-74) |
|
|
Раса, n (%) |
Європоїдна |
281 (98,6) |
299 (98,7) |
580 (98,6) |
|
Інша |
4 (1,4) |
4(1,3) |
8 (1,4) |
|
|
Маса тіла (кг) |
n |
285 |
303 |
588 |
|
Середнє значення СО |
68,9 (15,27) |
68,3 (14,45) |
68,6 (14,85) |
|
|
Медіанне значення (діапазон) |
67,4 (41-147) |
65,0 (43-126) |
66,0 (41-147) |
|
|
Ріст (см) |
n |
285 |
303 |
588 |
|
Середнє значення СО |
165,2 (6,87) |
164,7 (6,11) |
165,0 (6,49) |
|
|
Медіанне значення (діапазон) |
165,0 (142-184) |
165,0 (149-187) |
165,0 (142-187) |
|
|
Статус куріння, n (%) |
Курці |
28 (9,8) |
38 (12-5) |
66 (11-2) |
|
Некурці |
238 (83,5) |
246 (81-2) |
484 (82,3) |
|
|
Колишні курці |
19 (6,7) |
19 (6,3) |
38 (6,5) |
|
|
Аналіз посіву сечі, КУО/мл, % |
<103 |
63 (20,9) |
78 (27,3) |
141 (24,0) |
|
103 |
92 (30,5) |
86 (30,2) |
178(30-3) |
|
|
104 |
35 (11-6) |
29 (10-2) |
64 (10-9) |
|
|
105 |
37 (12-2) |
30 (10-5) |
67 (11-4) |
|
|
106 |
54 (17-9) |
47 (16-5) |
101 (17,2) |
|
|
>106 |
21 (7,0) |
15 (5-3) |
36 (6,1) |
|
|
Менопаузальний статус, n(%) |
Період пременопаузи |
191 (67,0) |
192 (63,4) |
383 (65,1) |
|
Період постменопаузи |
94 (33-0) |
111 (36,6) |
205 (34,9) |
|
|
Статева активність, n (%) |
Не активні |
95 (33,3) |
107 (35-3) |
202 (34,4) |
|
Активні |
190(66-7) |
195 (64,4) |
385 (65,5) |
|
|
Дані відсутні |
0 |
1 (0,3) |
1 (0,2) |
|
|
Репродуктивний потенціал |
Так |
173 (60,7) |
180 (59,4) |
353 (60,0) |
|
Ні |
112 (39-3) |
123 (40-6) |
235 (40,0) |
* (n=302) для результатів аналізу посіву сечі.
† Згруповані в одну категорію з метою захисту даних.
ФТ – фосфоміцин трометамол; N – кількість пацієнток у терапевтичній групі; n – кількість пацієнток, дані яких підлягали аналізу;
% – Відсоткова частка щодо N; PPS – вибірка пацієнток без порушень протоколу.
Більшість пацієнток не приймали додатково АБ у період між Днями 1 та 38 (у групі BNO 1045: n=238; 83,5%; у групі ФТ: n=272; 89,8%; рис. 2). Розрахована різниця між терапевтичними групами у вибірці PPS не перевищувала межу неменшої ефективності, що становить 15% (різниця в показнику незастосування АБ становила -6,26%; 95% ДІ - від -11,99 до -0,53%; p-значення при застосування 2-стороннього критерію – 0,0014). Робастність результатів підтверджувалася при аналізі неменшої ефективності BNO 1045 у порівнянні з ФТ у вибірці FAS (різниця в показнику незастосування АБ становила -8,25%; 95% ДІ - від -13,82 до -2,68%; p-значення при застосуванні 2-стороннього критерію – 0,0088). При аналізі чутливості у вибірці FAS не відзначалося істотного впливу відсутніх даних у вибірці PPS і підтверджувалася статистична значущість первинної кінцевої точки.
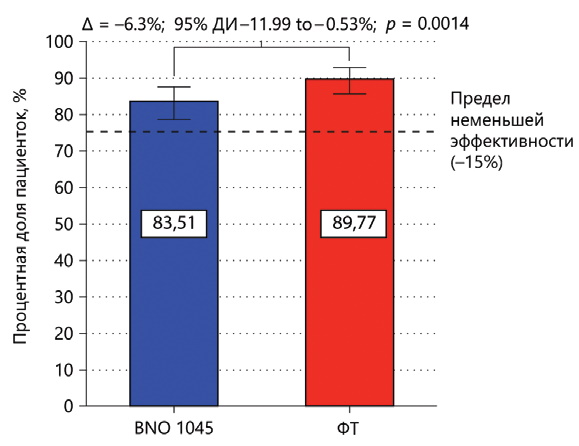
Рис. 2. Неменша ефективність BNO 1045 у порівнянні з ФТ (показник незастосування АБ) у вибірці PPS
Відсоткові значення означають відсоткову частку пацієнток у відповідній терапевтичній групі, які не приймали АБ у період між Днями 1 та 38±3. Планки похибок відповідають 95% ДІ. Порівняння показників незастосування АБ в терапевтичних групах проводилося із застосуванням статистичного критерію Феррінгтона і Маннінга, з 95% довірчими інтервалами та значеннями при застосуванні 2-стороннього критерію для визначення різниці в показниках незастосування АБ
ФТ - фосфоміща трометамол.
Точками введення даних вважаються середні сумарні показники шкали ACSS-typical кожної терапевтичної групи у кожний контрольний час. Планки похибок відповідають довірчим інтервалам по Ходжесу та Лиману. Цифри у дужках означають стандартні відхилення (а) сумарних показників при застосуванні BNO 1045 та ФТ відповідно.
ACSS – Шкала оцінки симптомів гострого циститу; FAS - вибірка для повного аналізу даних; ФТ – фоефоміцин трометамол.
При подальшому аналізі чутливості у вибірці PPS застосовувалась регресійна логістична модель, де за залежну змінну приймали прийом пацієнтками антибіотиків (так/ні), за коваріату – вік, за фактори – препарат, статеву активність та прийом гормональних препаратів. Аналіз не виявив впливу зазначених факторів на первинну кінцеву точку (р>0,05).
Протягом клінічного дослідження показники додаткового прийому АБ у групах були порівняні незалежно від причини (персистування або погіршення симптомів: BNO 1045 – 66,0% та ФТ – 67,7%; рецидивні симптоми: BNO 1045 – 23,4% та ФТ – 25 ,8%, відсутність симптомів: BNO1045 – 10,6% та ФТ – 6,5%).
Середні сумарні показники шкали ACSS-typical у вибірці FAS станом на День 1 були порівнянними (BNO 1045 – 10,2; ФТ – 10,1) та суттєво знизилися до Дня 4 (BNO 1045 – 5,1; ФТ – 4,5 ), на момент завершення лікування (BNO 1045 – 2,1; ФТ – 2,1) та на момент завершення періоду наступного спостереження (BNO 1045 – 0,8; ФТ – 0,9; рис. 3). Порівняння середніх сумарних показників шкали ACSS-typical за Ходжесом і Леманом показало, що станом на День 4 зниження було дещо суттєвішим у групі застосування ФТ (р=0,0166), але на момент завершення лікування та на момент завершення періоду подальшого спостереження воно було порівнянним (р>0,05).
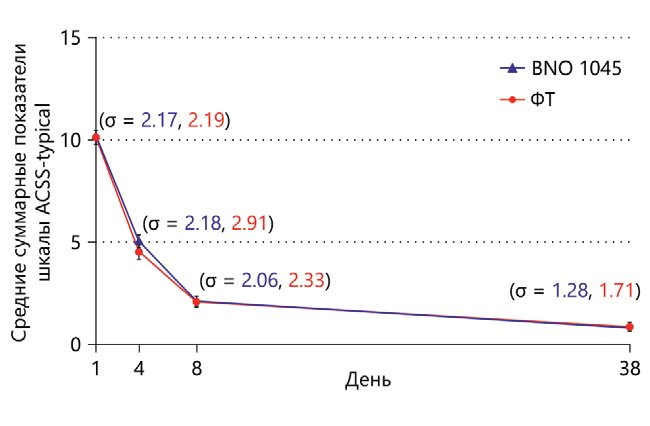
Рис. 3. Порівняння середніх сумарних показників шкали ACSS-typical у період між Днями 1 та 38±3 (у вибірці FAS)
Загалом, згідно з результатами аналізу показників шкали ACSS, при застосуванні BNO 1045 спостерігалася тенденція до зменшення тяжкості симптомів нІНМП у часовій динаміці та покращення якості життя за 4-бальною шкалою Лайкерта. Ці результати були порівняні зі зменшенням тяжкості симптомів нІНМП та покращенням якості життя, що спостерігаються у пацієнток, які приймали ФТ (рис. 4).
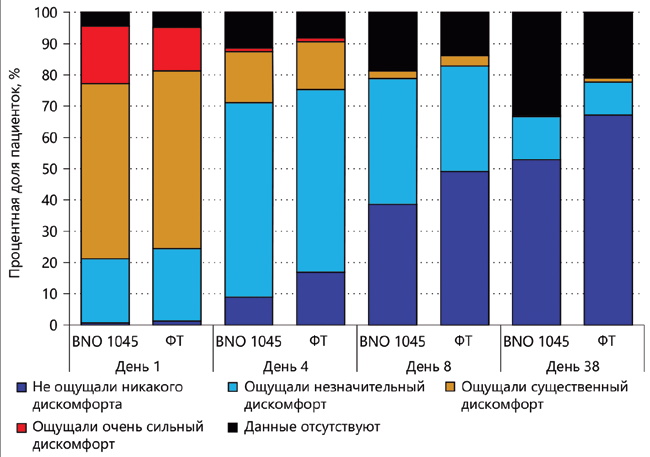
Рис. 4. Шкала ACSS-QoL; дискомфорт, викликаний симптомами, протягом останніх 24 годин (у вибірці FAS)
ACSS-QoL – «Шкала оцінки якості життя, пов'язаного із симптомами гострого циститу»; FAS – вибірка для повного аналізу даних: ФТ – фосфоміцин трометамол.
В обох групах відсоткова частка пацієнток без суттєвої бактеріурії (<103 КУО/мл) у вибірці FAS збільшилася з Дня 1 до завершення лікування (BNO 1045 – з 25,5% [n=83] до 31,1% [n=101] ;ФТ - з 21,4% [n = 71] до 36,7% [n = 122]). Відзначалася різниця між групами у частоті розвитку бактеріурії на момент завершення лікування на користь застосування ФТ (р=0,028). Станом на День 8 було зареєстровано зменшення лейкоцитурії щодо Дня 1 приблизно у третини пацієнток у вибірці FAS (BNO 1045 – зі 100,0% [n=325] до 37,2% [n=121]; ФТ – зі 100,0 % [n = 332] до 34,9% [n = 116]). Станом на День 8 не було виявлено суттєвої різниці між групами у частоті розвитку лейкоцитурину.
Більше 95% пацієнток в обох терапевтичних групах (у вибірці FAS) не приймали парацетамол протягом 24 годин до будь-якого візиту в рамках дослідження, різниці між групами не спостерігалося (р>0,05).
Загалом у ході клінічного дослідження у 92 (14,0%) пацієнток виникло хоча б одне небажане явище, що з'явилося в ході лікування (НВЛ (Treatment-emergent АЕ)). Кількість їх була приблизно однаковою в обох групах (BNO 1045 – 49 пацієнток [15,1%]; ФТ – 43 пацієнтки [12,9%]; таблиця 2).
Найчастішими НЯВЛ були порушення з боку шлунково-кишкового тракту, частота яких була більш високою у групі застосування ФТ (у 22 пацієнток), ніж у групі BNO 1045 (у 13 пацієнток). У період дослідження у 2 пацієнток виникли три серйозні НЯВЛ: у 1 пацієнтки у групі ФТ – загострення хронічного панкреатиту та перелом шийки стегна, у 1 пацієнтки у групі BNO 1045 – пієлонефрит середнього ступеня тяжкості. За оцінкою дослідника, жодне серйозне НЯВЛ був із застосуванням ИЛС.
Загальна частота розвитку пієлонефриту була низькою; проте у групі застосування BNO 1045 пієлонефрит відзначався у більшої кількості пацієнток (n=5, у 4 випадках – легкого ступеня, в 1 випадку – середнього ступеня), ніж у групі застосування ФТ (n=1, легкого ступеня). У групі застосування BNO 1045 у трьох із п'яти випадків пієлонефрит був зареєстрований у день включення до дослідження (1 випадок) або через 1 день після включення (2 випадки). Це свідчить, що станом на День 1 пієлонефрит, можливо, вже розвивався, але без очевидних діагностичних ознак.
|
Бажаний термін класу системи органів |
Група BNO 1045, n=325 |
Група ФТ, n=334 |
Усього, |
|||
|
n1 |
n2 (%) |
n1 |
n2 (%) |
n1 |
n2 (%) |
|
|
Усі НЯВЛ |
68 |
49 (15,1) |
64 |
43 (12,9) |
132 |
92 (14,0) |
|
Порушення зі сторони крові і лімфатичної системи |
3 |
2(0,6) |
0 |
0 |
3 |
2(0,3) |
|
Порушення зі сторони органів слуху і рівноваги |
0 |
0 |
2 |
2(0,6) |
2 |
2(0,3) |
|
Порушення з боку шлунково-кишкового тракту |
14 |
13 (4,0) |
27 |
22 (6,6) |
41 |
35 (5,3) |
|
Біль в животі |
0 |
0 |
4 |
4(1,2) |
4 |
4(0,6) |
|
Біль у животі (у нижніх ділянках) |
2 |
2(0,6) |
0 |
0 |
2 |
2(0,3) |
|
Біль у животі (у верхніх ділянках) |
1 |
1 (0,3) |
2 |
2(0,6) |
3 |
3(0,5) |
|
Діарея |
3 |
3(0,9) |
11 |
10(3,0) |
14 |
13(2,0) |
|
Нудота |
2 |
2(0,6) |
4 |
4(1,2) |
6 |
6(0,9) |
|
Блювота |
2 |
2(0,6) |
1 |
1 (0,3) |
3 |
3(0,5) |
|
Загальні порушення та реакції у місці введення |
2 |
2(0,6) |
1 |
1 (0,3) |
3 |
3(0,5) |
|
Інфекційні та паразитарні захворювання |
17 |
17 (5,2) |
17 |
16 (4,8) |
34 |
33 (5,0) |
|
Ларингіт |
0 |
0 |
2 |
2(0,6) |
2 |
2(0,3) |
|
Пієлонефрит |
3 |
3 (0,9) |
1 |
1 (0,3) |
4 |
4(0,6) |
|
Пієлонефрит (гострий) |
2 |
2(0,6) |
0 |
0 |
2 |
2 (0,3) |
|
Інфекція дихальних шляхів |
2 |
2(0,6) |
0 |
0 |
2 |
2 (0,3) |
|
Інфекція дихальних шляхів (ввірусна) |
1 |
1 (0,3) |
2 |
2(0,6) |
3 |
3(0,5) |
|
Інфекція верхніх дихальних шляхів (ввірусна) |
5 |
5(1,5) |
8 |
8 (2,4) |
13 |
13 (2,0) |
|
Лабораторні та інструментальні дослідження |
8 |
6(1,8) |
3 |
1 (0,3) |
11 |
7 (1,1) |
|
Підвищення рівня С-реактивного білка |
3 |
3(0,9) |
0 |
0 |
3 |
3(0,5) |
|
Підвищення рівня гамма-глутамілтрансферази |
2 |
2(0,6) |
1 |
1 (0,3) |
3 |
3(0,5) |
|
Порушення з боку обміну речовин та харчування |
2 |
2(0,6) |
2 |
2(0,6) |
4 |
4(0,6) |
|
Гіперглікемія |
2 |
2(0,6) |
0 |
0 |
2 |
2(0,3) |
|
Порушення з боку скелетно-м'язової та сполучної тканини |
4 |
3(0,9) |
3 |
3 (0,9) |
7 |
6(0,9) |
|
Порушення з боку нервової системи |
8 |
7(2,2) |
3 |
3 (0,9) |
11 |
10 (1,5) |
|
Дисгевзія |
2 |
2(0,6) |
0 |
0 |
2 |
2(0,3) |
|
Головний біль |
5 |
4(1,2) |
2 |
2(0,6) |
7 |
6(0,9) |
|
Порушення з боку нирок та сечовивідних шляхів |
3 |
3(0,9) |
2 |
2(0,6) |
5 |
5(0,8) |
|
Глюкозурія |
2 |
2(0,6) |
0 |
0 |
2 |
2(0,3) |
|
Порушення з боку статевих органів та молочних залоз |
5 |
5(1,5) |
1 |
1 (0,3) |
6 |
6(0,9) |
|
Виділення з піхви |
2 |
2(0,6) |
0 |
0 |
2 |
2(0,3) |
* MedDRA – Медичний словник регуляторної діяльності.
** SAF – вибірка для аналізу безпеки.
ФТ – фосфоміцин трометамол; N – кількість пацієнток у терапевтичній групі; n1 – кількість небажаних явищ;
n2 – кількість пацієнток, у яких виникло хоча б одне небажане явище;
% – відсоткова частка пацієнток із відповідними НЯВЛ щодо Р1; НЯВЛ – небажане явище, що виникло під час лікування.
Жодна пацієнтка не припинила участь у дослідженні через виникнення НЯВЛ і жодна пацієнтка не померла в період дослідження.
Коментар
Дане клінічне дослідження в масштабній популяції жінок з гострою ніНМП демонструє неменипу ефективність рослинного лікарського препарату в порівнянні з АБ для лікування гострої нінмп. Симптоматичне лікування препаратом ВNO 1045 було не менш ефективним, ніж АБ-терапія із застосуванням ФТ, з точки зору запобігання додатковому прийому АБ для лікування гострої НІНМП у жінок. Ці дані переконливо свідчать на користь заміни АБ-терапії симптоматичним лікуванням препаратом ВNO 1045 при нІНМП та проведення подальших досліджень у сфері застосування рослинних препаратів, альтернативних антибіотикам, при нІНМП.
Сучасні практичні посібники ЕАУ [4] рекомендують застосовувати АБ як препарати першої лінії при лікуванні ІМП. Враховуючи, що ІМП належать до найпоширеніших інфекційних захворювань у загальній медичній практиці [1, 2], ця рекомендація може значно сприяти поглибленню глобальної проблеми антибіотикорезистентності.
Отже, дуже важливо визначити альтернативні стратегії. У попередніх дослідженнях було висунуто припущення, що можна значно знизити споживання АБ шляхом первинного симптоматичного лікування НІНМП із застосуванням НСПЗП [9, 10], хоча лікування такими препаратами клінічно менш ефективне, ніж АБ-терапія. Проте отримані результати були досить переконливими, щоб у німецьких протоколах діагностики та лікування [22] з'явилася рекомендація застосовувати симптоматичне лікування без антибіотиків у випадках гострих НІМП з симптомами легкого або середнього ступеня тяжкості.
Кроненберг (Kronenberg) та ін [10] припустили, що комбінований підхід, що полягає в симптоматичному лікуванні з можливим відстроченим селективним застосуванням АБ може суттєво знизити загальне споживання антибіотиків. Оскільки 83,5% пацієнток, які приймали ВNO 1045, не потребували додаткового прийому АБ для лікування ніНМП, застосування цього альтернативного рослинного препарату знизило потребу амбулаторних пацієнтів в антибіотиках для лікування ніНМП більш ніж на 80% (рис. 2).
Результати основної гіпотези, що перевіряється у вибірці PPS, підтверджувалися аналізом у вибірці FAS – підгрупі, в якій враховувалися також умовні результати аналізу при найгіршому варіанті додаткового прийому АБ у період між Днями 1 та 38. Було встановлено, що продемонстрована при порівнянні препаратів не менша ефективність не залежить від віку пацієнток, статевої активності чи прийому гормональних лікарських засобів.
Клінічна користь обох препаратів у зменшенні основних симптомів за шкалою ACSS-typical спостерігалася після 3 днів лікування (на День 4), хоча у пацієнток, які приймали ФТ, середній показник зменшення був більшим, ніж у тих, хто приймав BNO 1045 (р=0 0166). Ці результати можна порівняти з даними, отриманими Кроненбергом та ін [10], згідно з якими тривалість вирішення симптомів була більш високою при застосуванні НСПЗП (4 дні), ніж при АБ-терапії (2 дні). Проте в даному клінічному дослідженні спостерігалася чітка тенденція до суттєвого зниження тяжкості симптомів нІНМП та покращення якості життя на момент завершення 7-денного періоду лікування. Це говорить про те, що загальна ефективність BNO 1045 у цій популяції пацієнток була порівнянна з ефективністю ФТ.
Препарат BNO 1045 загалом добре переносився; не було вираженої різниці між групами застосування BNO 1045 та ФТ у частоті виникнення небажаних явищ або сигналів, пов'язаних з безпекою, за винятком того, що у групі BNO 1045 виникло менше випадків порушень з боку шлунково-кишкового тракту (4,0%), ніж у групі ФТ (6,6%), та у групі BNO 1045 відзначалося дещо більше випадків пієлонефриту (1,5%) у порівнянні з групою ФТ (0,3%). Більш висока частота пієлонефриту була несподіванкою, враховуючи, що його початковий ризик у плацебо-контрольованих дослідженнях нІНМП становить 1–2% [23, 24]. Вища частота розвитку пієлонефриту раніше відзначалася при застосуванні ібупрофену (2,1%) порівняно з АБ (0,4%) [8] та диклофенаку (4,5%) порівняно з АБ (0,0%) [10] . Таким чином, можна зробити висновок, що застосування BNO 1045 у порівнянні з АБ не становить підвищеного ризику для пацієнтів, особливо з урахуванням того, що при появі симптомів, що вказують на інфекцію верхніх сечовивідних шляхів, виникла б необхідність застосування АБ-терапії. Тим не менш, у подальших дослідженнях необхідно отримати додаткові дані щодо частоти розвитку пієлонефриту при застосуванні BNO 1045.
Дане дослідження мало деякі обмеження, у тому числі негативні результати сівби сечі приблизно у чверті пацієнток. Це може пояснюватись двома причинами. По-перше, при межі виявлення, що становить 103 КУО/мл, може бути не виявлена уропатогенна бактерія Е. coli у малих кількостях [25, 26]. Проте включення до дослідження пацієнток із симптомами певної міри тяжкості може бути доцільним, враховуючи, що симптоми з боку сечовивідних шляхів та бактеріурія часто виникають незалежно один від одного [27]. По-друге, доставка зразків сечі в пробірках з боратним буфером із деяких клінічних центрів до центральної лабораторії займала понад 24 години, що могло вплинути на результати [28]. Крім того, при оцінці додаткового прийому АБ та дотримання вимог протоколу щодо застосування BNO 1045 дослідники покладалися на повідомлення пацієнток. Нарешті необхідність додаткового прийому антибіотиків для пацієнток, у яких погіршувалися симптоми НІМП, визначалася дослідником; у різних дослідницьких центрах могли застосовуватись різні критерії оцінки такої необхідності.
Загалом дане клінічне дослідження в масштабній популяції пацієнток підтверджує доцільність симптоматичного лікування гострих НІМП як альтернативи антибіотикотерапії. Було доведено неменшу ефективність рослинних препаратів у порівнянні з антибіотиками. До того ж вони викликали менше побічних реакцій з боку шлунково-кишкового тракту, таких як діарея та біль у животі. Поряд з результатами попередніх досліджень [8–10] дане дослідження може збільшити масив даних щодо варіантів лікування та сприяти ширшому застосуванню препаратів, альтернативних антибіотикам, таких як BNO 1045, для лікування НІМП у повсякденній клінічній практиці.
Дане клінічне дослідження зареєстровано на сайті clinicaltrials.gov за номером NCT02639520 та в реєстрі EudraCT за номером 2013-004529-99. Протокол дослідження, форми поінформованої згоди та будь-які інші документи, пов'язані з дослідженням, були перевірені та затверджені незалежним Комітетом з питань етики.
Спонсором клінічного дослідження виступала компанія "Біонорика СЕ" (Німеччина), координатором - контрактна дослідницька організація Clinipace Worldwide (CPWW). Співробітники компанії «Біонорика РЄ» брали участь у розробці дизайну дослідження, збиранні, аналізі та інтерпретації даних. У написанні медичного тексту допомагала Джеймі Турман-Ньюелл, доктор наук, представник компанії Synergy Vision (Великобританія), фінансову підтримку надавала компанія "Біонорика РЄ". Автори, які є співробітниками компанії "Біонорика РЄ", мали повний доступ до даних дослідження. Усі автори перевірили та затвердили остаточний варіант статті.
Автори висловлюють подяку Джахонгіру Ф. Аліджанову за поради та цінний внесок як у проведення дослідження, так і в написання статті; Люггарду Шпітцнагель-Шмінке, Мірьям Рітгмейєр, Бенедикту Гранделю, Сабіні Шарль, Біргіт Бом та Бернарду Наушу - за допомогу в медичних та наукових питаннях; Бьорну Вуллту - за рекомендації з наукового обґрунтування інтерпретації результатів.
Автори дякують усім наведеним нижче дослідникам, які брали участь у клінічному дослідженні: Адріан Пілатц, Торстен Брюнс, Стефан Ф. Регнер, Майке Бойці, Тім Шнайдер, Маттіас Шульце, Майкл Paг, Томас Бенуш, Крістел Концен, Ліана Вісмейн, Мануела Тінесе-Малл Екерманн, Інга Штайнебах, Андор Шмідт, Томаш Блічарський, Мацей Пашковський, Катажина Ланда, Ева Писарчик-Богацька, Рафаль Кмечак, Дорота Кничас, Рената Внетшак-Михальська, Магдалена Яруховська, Дмитро Соломчак, Тетяна , Олександр Шуляк, Павло Чабанов, Ігор Антонян, Ірина Дудар, Володимир Угаров, Олег Лесняк, Петро Іващенко, Лілія Мартинюк, Ігор Криворотко, Наталія Коломійчук.
Автори також висловлюють подяку всім іншим дослідникам, членам дослідних колективів та пацієнткам, які брали участь у дослідженні.
Спонсором клінічного дослідження виступала компанія "Біонорика СЕ" (Німеччина), координатором - контрактна дослідницька організація Clinipace Worldwide (CPWW). Співробітники компанії «Біонорика РЄ» брали участь у розробці дизайну дослідження, аналізу та інтерпретації даних. Професор Вагенленер відповідав за збір, перевірку та повторну перевірку даних. Відповідальний автор мав повний доступ до всіх даних дослідження та приймав остаточне рішення про надання статті для публікації.
Усі автори заповнили стандартну форму розкриття інформації на сайті Міжнародного комітету редакторів медичних журналів (ICMJE) www.icmjc.org/coi_disclosure.pdf, де заявили про те, що фінансування та допомогу у проведенні дослідження надавала компанія «Біонорика РЄ». Флоріан М. Вагенленер заявляє про отримання гонорарів за персональні консультації та інші послуги від компанії «Біонорика РЄ» у період проведення дослідження, про отримання персональних гонорарів, що не належать до цієї статті, від компаній Achaogen, AstraZeneca, Janssen, LeoPharma, MerLion, MSD, OM Pharma / Vifor Pharma, Pfizer, RosenPharma та VenatoRx; а також про інші виплати, що не стосуються цієї статті, від компаній Enteris BioPharma, Helperby Therapeutics та Shionogi. Курт Г. Набер заявляє про отримання гонорарів за персональні консультації та інші послуги від компанії «Біонорика РЄ» у період проведення дослідження, а також про отримання персональних гонорарів, які не належать до цієї статті, від компаній Adamed, Apogepha, Daiich-Sankyo, Enteris, GSK, Helperby, Hermes, Medice, MerLion, OMPharma/Wor, Paratek, Roche, Saxonia та Zambon. Дмитро Абрамов-Соммаріва, Губерт Штайндль та Мартіна Геллер є співробітниками компанії «Біонорика РЄ».
SHDM.FORUM'24: Головна подія року!
Конференція MEDONNA
Лідерська програма для лікарів MEDFUTURE
Інформація, опублікована на даному сайті, орієнтована на загальне ознайомлення та жодним чином не може бути використана в якості медичних, практичних або комерційних рекомендацій. У зв’язку з цим, Сайт «Школи доказової медицини» не несе жодної відповідальності за негативні наслідки, отримані через використання матеріалів, викладених на даному сайті. Документація з фармацевтичних продуктів не є рекламою та не призначена для того, щоб використовувати її замість консультації з кваліфікованими фахівцями в галузі медицини та інших галузях. Документація з фармацевтичних продуктів надається за вашою згодою відповідно до вимог ч.ч. 1, 2 ст. 15 Закону України «Про захист прав споживачів» від 12.05.1991 р. № 1023-XII. Якщо вам потрібна консультація з конкретного питання, пов’язаного зі здоров’ям, необхідно звернутися до фахівців- професіоналів.
Продовжуючи своє перебування на сайті, ви підтверджуєте свою згоду на дистанційне отримання інформації про лікарські та косметичні засоби (включаючи інформацію про рецептурні лікарські засоби) на підставі вимог ч.ч. 1, 2 ст. 15 Закону України «Про захист прав споживачів» від 12.05.1991 р. № 1023-XII.
Уся інформація, яка міститься на даному сайті, подана з освітньою метою виключно для медичних та фармацевтичних працівників і не замінює консультації лікаря.