Гавриленко Ю.В.
Національна медична академія післядипломної освіти імені П.Л. Шупика, Київ, Україна
Gavrylenko Iu.
Shupyk National Medical Academy of Post-Graduate Education, Kуiv, Ukraine
Здійснено вивчення клініко-лабораторної ефективності використання фітопрепарату Імупрет у комплексному лікуванні дітей із хронічним тонзилітом (ХТ) на фоні цукрового діабету 1-го типу (ЦД-1). Під спостереженням знаходилися 42 дитини з ЦД-1 та ХТ, із частотою загострення хронічного процесу 5 і більше разів на рік. Пацієнти групи порівняння (20 дітей) отримували загальноприйняту терапію. Пацієнти основної групи (22 дитини) отримували додатково Імупрет. Усім пацієнтам проводилося клініко-лабораторне обстеження під час загострення ХТ (ОХТ) та через 180±5 та 360±5 днів від початку лікування.
Використання імунореабілітації у дітей з ЦД-1 та ОХТ із застосуванням Імупрету протягом 6 тижнів сприяло зменшенню частоти ОХТ протягом року (у 3 рази) та потреби у повторних курсах антибіотикотерапії (у 5 разів), а також супроводжувалося зменшенням частоти колонізації піднебінних мигдаликів ( НМ) патогенними бактеріями та грибами роду Candida.
За результатами цитологічного дослідження в основній групі дітей у динаміці лікування виявлено цитологічні ознаки нормалізації стану лімфоїдної тканини НМ у 82% випадків, чого не спостерігалося у групі контролю.
Ключові слова: хронічний тонзиліт, цукровий діабет 1-го типу, діти, лікування, імунпрет.
Хронічний тонзиліт (ХТ) є досить частим захворюванням дитячого віку; його поширеність коливається від 20% у загальній популяції і до 43% – у групі дітей, що часто хворіють [3, 9]. За наявності ендокринної патології, серед якої провідне місце займає цукровий діабет 1-го типу (ЦД-1), поширеність ХТ згідно з проведеними нами раніше дослідженнями становить 33%, що диктує необхідність комплексного підходу до лікування із залученням не тільки дитячого ендокринолога, а й педіатра. , та дитячого отоларинголога.
Хронічний запальний процес у піднебінних мигдаликах (НМ) викликає значні зрушення у функціонуванні місцевого та загального імунітету [7, 8]. Визначається дисбаланс в імунному статусі: перерозподіл Т- та В-лімфоцитів та їх субпопуляцій, наявність циркулюючих імунних комплексів, сенсибілізація гранулоцитів до інфекційних алергенів. Циркулюючі імунні комплекси «антиген – антитіло», що фактично є прикладом незавершеного фагоцитозу, виявляють хемотаксичну активність і підвищують протеолітичну здатність ферментів макрофагів, що призводить до лізису власної тканини мигдаликів, денатурації білків, які в результаті набувають антигенних властивостей. Потрапляючи у кров, вони викликають утворення аутоантитіл, а в процесі тривалої персистенції мікрофлори відбувається індукція толерантності до неї. Це є основою спотворення імунної відповіді макроорганізму. При ХТ різко знижуються рівень sIgA у ротоглоточному секреті, рівень рецепторів та регуляторних пептидів-цитокінів, зменшується кількість В-лімфоцитів – потенційних продуцентів sIgA та IgM, змінюється субпопуляційний склад Т-лімфоцитів, дендритних клітин [6]. Внаслідок таких відхилень змінюється загальний рівень протиінфекційного захисту, формуються імунопатологічні синдроми, які згодом викликають аутоімунні та інфекційні ускладнення з боку інших органів та систем [9].
Поєднання ХТ і СД-1 з цілого ряду причин взаємно ускладнює перебіг один одного. З іншого боку, як загострення хронічного тонзиліту (ОХТ) саме собою, і його лікування антибіотиками (а/б) призводить до ускладненого течії СД-1. У цьому використання антибактеріальних засобів забезпечує лише тимчасовий ефект, впливаючи тривалість загострень, але з частоту розвитку ускладнень.
Варіант оптимальної терапії у таких випадках повинен включати імунокорекцію. В останні роки проведено низку переконливих клінічних та експериментальних досліджень впливу комплексного рослинного препарату Імупрет на різні параметри, у тому числі місцевого імунітету, які підтвердили достовірний вплив цього засобу на клітини мигдаликів, що виявлялося, зокрема, у посиленні експресії на клітинах CD 56 антигену, який є одним із основних маркерів природних кілерів. Важливо відзначити, що терапія Імупретом призводить до активації насамперед ланки клітинного імунітету, без зміни вектора імунної реактивності, підвищення синтезу інтерферону, імуноглобулінів та реалізації його противірусної та протизапальної дії [6]. Проведені експериментальні дослідження щодо імуномодулюючої дії на клітини крові Імупрету показали його різноспрямований вплив на продукцію різних цитокінів ефекторними клітинами системного імунітету, що дає підстави погодитися з думкою низки авторів щодо необхідності підбору саме таких препаратів для проведення комплексного лікування пацієнтів з патологією лімфоепітальних 5]. Крім того, дослідження цитологічного складу вмісту крипт НМ у пацієнтів з ХТ на сьогоднішній день є також важливим фактором для визначення їх цитоморфологічного стану, уточнення діагнозу та вибору методу лікування дітей з ХТ та ЦД-1 [4].
Вивчення клініко-лабораторної ефективності використання фітопрепарату Імупрет (Біонорика, РЄ, Німеччина) у комплексному лікуванні дітей із хронічним тонзилітом у фазі загострення на тлі цукрового діабету 1-го типу.
За період 2014–2015 років. в ендокринологічному відділенні Національної дитячої спеціалізованої лікарні «Охматдит» було обстежено 42 дитини з ХТ та ЦД-1 із частотою загострення хронічного процесу понад 5 разів протягом року.
Критеріями включення до дослідження були діти з ЦД-1 віком від 8 до 16 років, які мали легкий або середній ступінь ОХТ, згоду пацієнта брати участь у дослідженні та виконувати його вимоги.
Критеріями виключення з дослідження були наявність обтяженого алергологічного анамнезу, інфекційні захворювання, прийом антибактеріальних препаратів.
Ефективність лікування оцінювали за такими критеріями:
Залежно від обраної терапевтичної тактики пацієнти були поділені на дві групи. В основній групі (n=22) пацієнти отримували загальноприйняту терапію в період ОХТ (за стандартними показаннями – антибіотики, нестероїдні протизапальні засоби, місцеві антисептики тощо), а також додатково Імупрет по 1 таблетці (15 крапель) – для дітей від 6 до 11 років та 25 крапель (2 таблетки) – для дітей 12–16 років – 4 рази на день протягом усього періоду загострення, а далі – у віковій дозі 3 рази на день протягом наступних 6 тижнів. Повторний курс тривалістю 6 тижнів проводився через 6 та 12 місяців з динамічним наглядом за пацієнтами.
Контрольна група (n=20) отримувала загальноприйняту терапію без призначення Імупрету. У проміжках між загостреннями інших медикаментозних чи немедикаментозних методів лікування вони отримували.
Дітям обох клінічних груп було проведено загальноклінічні обстеження, згідно з локальними протоколами, а також бактеріологічне дослідження з НМ на мікрофлору та чутливість до антибіотиків та цитологічне дослідження з крипт НМ. Статистична обробка була проведена з використанням методу кутового перетворення за Фішером та непараметричного критерію U (Вілкоксона – Манна – Уітні).
Загальний стан пацієнтів обох груп, які були залучені до клінічного дослідження, переважно був середнім ступенем тяжкості. Перед початком лікування скарги дітей були на періодичні болі в горлі при ковтанні та в стані спокою, мерзлякуватість, слабкість, відчуття стороннього тіла. Клінічними ознаками ОХТ у дітей з ЦД-1 були гіперемія та набряклість передніх піднебінних дужок, гіперемія НМ, наявність гнійних (казеозних пробок) або рідкого гною в лакунах НМ, збільшення та помірна болючість підщелепних лімфовузлів, субфебрилітет. Дані показники оцінили в динаміці лікування у дітей обох груп спостереження.
Рис. 1. Тривалість скарг у дітей з ЦД-1 та ОХТ, дні (M+m)
Примітка: * - Достовірність відмінностей порівняно з показниками групи контролю (р<0,05).
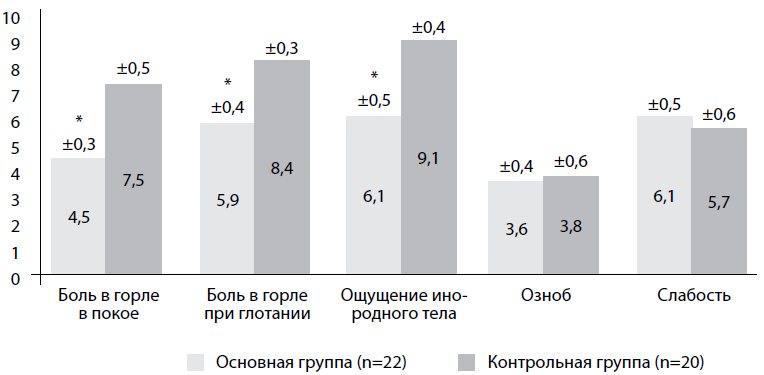
За результатами проведеного першого курсу комплексного лікування було виявлено суттєву різницю щодо тривалості скарг у пацієнтів, які отримували стандартну терапію, та тих, які додатково отримували Імупрет. У пацієнтів основної групи, як видно з цих рис. 1, достовірно швидше регресували наступні клінічні симптоми: біль у горлі у спокої та при ковтанні, відчуття стороннього тіла у горлі (р<0,05). При використанні стандартної базисної терапії суб'єктивні скарги залишалися майже у половини дітей до 6-7-го дня лікування.
Слід зазначити, що на фоні прийому Імупрету у дітей з ЦД-1 та ОХТ не спостерігалося підвищення рівня глюкози та глікозильованого гемоглобіну в крові та в жодного з пацієнтів, пролікованих Імупретом, не спостерігали алергічних реакцій.
При клінічному спостереженні за пацієнтами обох груп виявлено, що об'єктивні зміни з боку НМ та глотки також достовірно швидше регресували у дітей основної групи (табл. 1), у них також менший час тримався субфебрилітет, збільшення та болючість підщелепних лімфовузлів при пальпації (р<0 ,05).
|
Клінічні симптоми |
Контрольна група (n=20) |
Основна група (n=22) |
|
Наявність гнійних (казеозних) пробок або рідкого гною в лакунах НМ |
11,2±0,6 |
5,2±0,4* |
|
Гіперемія НМ |
16,3±0,4 |
9,1±0,3* |
|
Збільшення підщелепних лімфовузлів |
11,6±0,5 |
6,3±0,5* |
|
Болючість підщелепних лімфовузлів при пальпації |
10,3±0,4 |
5,4±0,4* |
|
Субфебрилітет |
14,1±1,1 |
7,2±0,6* |
Примітка: * - Достовірність відмінностей порівняно з показниками 1-ї групи (р<0,05).
Пацієнти обох груп проходили динамічне спостереження з інтервалами 180 та 360 днів з метою фіксації у них частоти ОХТ, курсів антибіотикотерапії, яка призначалася ним за потреби педіатром, ендокринологом або дитячим оториноларингологом. Вихідний рівень загострень до лікування у пацієнтів двох груп був однаковим – 5–7 разів на рік ОХТ, відповідно, стільки ж разів їм дільничний педіатр чи ендокринолог призначав а/б терапію із тривалістю періоду ОХТ від 12 до 16 днів. Після проведеного курсу лікування до наступного візиту пацієнти вели щоденник обліку прийому а/б та загострень за 6 міс., та при повторній госпіталізації вони були враховані. Ці дані наведено у табл. 2.
|
Клінічні симптоми |
Контрольна група (n=20) |
Основна група (n=22) |
|
Кількість загострень протягом року |
6,3±0,5 |
2,1±0,3* |
|
Середня тривалість одного загострення, днів |
14,5±0,9 |
10,1±1,1 |
|
Кількість курсів антибіотиків протягом року |
3,1±0,8 |
0,6±0,3* |
Примітка: * - Достовірність відмінностей порівняно з показниками 1-ї групи (р<0,05).
Як очевидно з табл. 2, у дітей основної групи у 3 рази зменшилася частота ОХТ протягом року порівняно з дітьми контрольної групи, та у 5 разів – кількість курсів прийому антибіотикотерапії (р<0,05), а також виявлена тенденція до скорочення тривалості ОХТ в основній групі (Р>0,05).
Проведені бактеріологічні дослідження у дітей із ЦД-1 та ОХТ визначили особливості стану мікробіоценозу НМ, якому було характерно те, що патогенні мікроорганізми практично не висівали у вигляді монокультур. Виявлення комбінованої патогенної мікрофлори у дітей із ЦД-1 та ОХТ вказувало на значне порушення стану колонізаційної резистентності у НМ таких пацієнтів, що нами було також раніше досліджено та опубліковано [1]. Отримані результати бактеріологічного дослідження НМ у дітей із ЦД-1 та ОХТ основної та контрольної груп відображені у табл. 3. Достовірної різниці щодо частоти виявлення бактерій та грибів в обох групах спостереження до початку лікування не відзначалося (р>0,05).
|
Мікрофлора |
Контрольна група (n=20) |
Основна група (n=22) |
|
Staph. aureus |
68,4 |
62,0 |
|
Str. pyogenes |
12,6 |
10,0 |
|
Klebsiela pneumoniae |
11,2 |
10,0 |
|
Str. viridans |
40,1 |
44,0 |
|
Candida spp. |
18,7 |
22,0 |
За результатами проведеного спостереження протягом 180 днів після комплексного лікування у пацієнтів контрольної групи, які отримували стандартне лікування при ОХТ, не відбулося істотних змін мікробіоценозу НМ, за винятком достовірного зростання частоти виявлення грибів роду Candida (р<0,05). Причиною цього може бути неодноразове застосування антибіотиків у цій групі пацієнтів. Наслідком цього може бути тенденція до зниження колонізаційної частоти Staph. aureus (р>0,05), оскільки антибактеріальні засоби в основному підбирають з урахуванням антибіотикочутливості домінуючого штаму патогенного мікроорганізму. Характерною особливістю пацієнтів групи порівняння було те, що повна елімінація Staph. aureus з НМ під впливом антибіотиків якщо й відбувалася у частини пацієнтів, то протягом короткого часу спостерігалася реколонізація тим самим мікроорганізмом.
Застосування комплексного лікування у пацієнтів основної групи сприяло суттєвому покращенню мікробіоценозу НМ, причому це стосувалося не лише бактерій Staph. aureus, а й грибків роду Candida. Цей результат пов'язаний, перш за все, із значно меншою частотою застосування антибіотиків у дітей із ЦД-1 та ОХТ основної групи (табл. 4). Також у пацієнтів основної групи знизилася частота виявлення інших патогенних мікроорганізмів (р<0,05), крім Klebsiela pneumoniae.
|
Мікрофлора |
Контрольна група (n=20) |
Основна група (n=22) |
|
Staph. aureus |
42,2 |
14,0* |
|
Str. pyogenes |
10,1 |
0,2* |
|
Klebsiela pneumoniae |
12,4 |
9,4 |
|
Str. viridans |
35,6 |
15,0 |
|
Candida |
38,4* |
3,0* |
Примітка: * - Достовірність відмінностей порівняно з показниками до лікування (р<0,05).
Цитологічне дослідження клітинного складу вмісту крипт НМ є додатковим інформативним методом і дає можливість зрозуміти ступінь цитоморфологічних змін НМ у результаті лікування. Слід зазначити, що цитологічний вміст клітин НМ у пацієнтів основної групи та групи контролю до лікування був практично однаковим і не мав достовірних відмінностей.
Результати цитологічного дослідження, яке проводилося до та після лікування ОХТ на 10–14-й день у дітей із ЦД-1, також підтвердили переваги комплексної схеми із застосуванням Імупрету.
Клінічний приклад цитологічного дослідження вмісту крипт НМ дитини з ЦД-1 та ОХТ до та після лікування із застосуванням Імупрету.
Пацієнт Михайло М., 12 років.
Первинне обстеження (рис. 2).
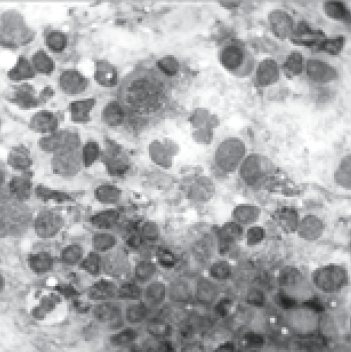
Рис. 2. Препарат вмісту крипт НМ при первинному обстеженні. Забарвлення за Паппенгеймом, х1000
Повторне обстеження (14 день).
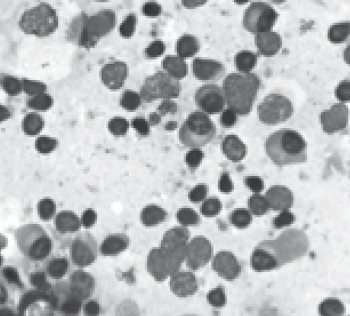
Рис. 3. Препарат вмісту крипт НМ при повторному обстеженні. Забарвлення за Паппенгеймом, х1000
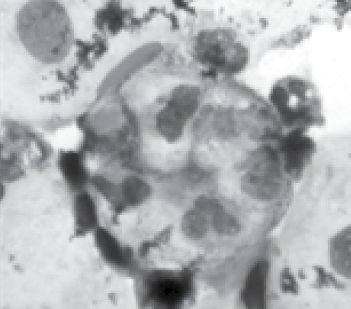
Рис. 4. Макрофаг, який містить у собі нейтрофільні лейкоцити в препараті крипт НМ. Забарвлення за Паппенгеймом, х1000
При повторному обстеженні відмічено збільшення кількості плазмоцитів із формуванням скупчень, базофілія цитоплазми гістіоцитів, що може опосередковано свідчити про можливу активізацію процесу синтезу антитіл лімфоїдною тканиною НМ.
На 10-14 добу лікування, при повторному дослідженні, у 82% випадків (9 пацієнтів) в основній групі (n=11) виявлено цитологічні ознаки поліпшення цитоморфологічної картини. Зміни в мазках характеризувалися зростанням кількості лімфоцитів, що знаходяться частково в стані бластної трансформації, і плазмоцитів з формуванням скупчень, а також базофілією цитоплазми гістіоцитів, що дає підстави передбачати активізацію процесу синтезу антитіл. Поява макрофагів, які містять нейтрофільні лейкоцити, може свідчити про активізацію процесів очищення тканини НМ. У цитологічних препаратах дітей групи контролю таких змін не виявлено.
«Otorhinolaryngology. Eastern Europe» 2016, volume 6, № 4
SHDM.FORUM'24: Головна подія року!
Конференція MEDONNA
Лідерська програма для лікарів MEDFUTURE
Інформація, опублікована на даному сайті, орієнтована на загальне ознайомлення та жодним чином не може бути використана в якості медичних, практичних або комерційних рекомендацій. У зв’язку з цим, Сайт «Школи доказової медицини» не несе жодної відповідальності за негативні наслідки, отримані через використання матеріалів, викладених на даному сайті. Документація з фармацевтичних продуктів не є рекламою та не призначена для того, щоб використовувати її замість консультації з кваліфікованими фахівцями в галузі медицини та інших галузях. Документація з фармацевтичних продуктів надається за вашою згодою відповідно до вимог ч.ч. 1, 2 ст. 15 Закону України «Про захист прав споживачів» від 12.05.1991 р. № 1023-XII. Якщо вам потрібна консультація з конкретного питання, пов’язаного зі здоров’ям, необхідно звернутися до фахівців- професіоналів.
Продовжуючи своє перебування на сайті, ви підтверджуєте свою згоду на дистанційне отримання інформації про лікарські та косметичні засоби (включаючи інформацію про рецептурні лікарські засоби) на підставі вимог ч.ч. 1, 2 ст. 15 Закону України «Про захист прав споживачів» від 12.05.1991 р. № 1023-XII.
Уся інформація, яка міститься на даному сайті, подана з освітньою метою виключно для медичних та фармацевтичних працівників і не замінює консультації лікаря.