На сучасному етапі загальноприйнята концепція щодо запальної природи РС. Існує загальне положення, що РС може бути визначений як запалення слизової оболонки носа та приносових пазух. Оскільки слизова оболонка порожнини носа і приносових пазух є продовженням одна іншої, запалення в порожнині носа зазвичай асоціюється із запаленням слизової оболонки пазух. Сьогодні усі науковці одностайно поділяють думку про те, що термін «риносинуїт» є, принаймні, більш точним, аніж термін «синуїт». Причинами для цього було те, що синуїт типово не розвивається без попереднього риніту, ізольоване ураження пазух без риніту практично не зустрічається (за винятком хіба що одонтогенного), і дві з провідних ознак синуїтів – утруднення носового дихання та виділення з носа – асоціюються із симптомами риніту.
За тривалістю перебігу розрізняють:
Гострий РС – процес, що виникає на фоні повного благополуччя, із гострим початком, при тривалості симптомів до 4 тижнів. Варіантом ГРС є підгострий РС, при якому тривалість симптомів становить 4-12 тижнів із наступним повним їх зникненням.
Рецидивуючий РС – симптоми виникають на тлі повного благополуччя, частота появи симптомів при цьому становить > 4 за рік, тривалість – понад 7-10 днів. Поміж епізодами настає повне одужання, а період між гострими атаками вільний від симптомів 8 або більше тижнів. Ознаки ХРС при цьому відсутні.
Хронічний РС – захворювання із тривалістю симптомів понад 12 тижнів, персистуючими запальними змінами на рентгенівських знімках протягом 4 і більше тижнів. У рамках хронічного РС визначено його загострення – погіршення існуючих симптомів або появу нових симптомів і повне зникнення гострих, але не хронічних симптомів між епізодами.
За характером патологічних змін розрізняють:
Згідно вимог Європейського меморандуму з лікування риносинуїту та поліпозу носа (EP3OS) у редакції 2012 року гострі риносинуїти поділяють на: вірусні, післявірусні та бактеріальні.
За характером патологічних змін при хронічному риносинуїті виділяють ексудативну (катаральний, серозний, гнійний, геморагічний), продуктивну (пристінково-гіперпластичний, поліпозний, кістозний), альтеративну (холестеатомний, казеозний, некротичний, атрофічний), змішану, вазомоторну і алергічну форми
Етіологічна класифікація ГРС:
За локалізацією розрізняють (рис. 1):

Рисунок 1. Класифікація ГРС за локалізацією.
Ізольоване ураження пазух (моносинуїти) зустрічається досить рідко. Серед них найчастіше (50-85%) зустрічаються етмоїдити (запалення пазухи решітчастої кістки). Трошки рідше, але також відносно часто, зустрічаються гайморити (45-50%). Сфеноїдити – 2-25% випадків. Велика розбіжність у показниках пов'язана з проблемами діагностики сфеноїдитів. Фронтити – 4-15%. Множинні ураження пазух (полісинуїти) при ГРС зустрічаються набагато частіше, а серед них найчастіше поєднання – гайморо-етмоїдит. Гемісинуїт – однобічне ураження приносових пазух, пансинуїт – тотальне ураження всіх приносових пазух.
Гострі риносинуїти належать до групи гострих респіраторних захворювань (ГРЗ). ГРЗ, в свою чергу, являють собою збірну групу захворювань, які спричинюють різні чинники, але поєднані на основі спільності патогенезу та клініки. Раніше запалення слизової оболонки носа та синусів асоціювалось з наявністю інфекції. Із надбанням нової інформації про природній перебіг РС, основаної на новітніх методиках візуалізації, таких як назальна ендоскопія, комп'ютерна томографія, магнітно-резонансна томографія, новому розумінню патофізіології і імунології запалення, завдяки покращенню мікробіологічних методик та останнім досягненням цитогістохімії запального процесу, стало очевидним, що в основі патологічних процесів лежить не тільки і не стільки інфекція. Тому в останні роки існує загальне погодження, що РС може бути визнаний як запалення (але не інфекція) слизової оболонки. На сьогоднішній день вважається більш прийнятним, коли термін РС вживається для описання запалення, а не інфекції. Термін запалення покриває як інфекційні, так і неінфекційні механізми. Гострий риносинуїт етіопатогенетично у переважній більшості випадків пов'язаний із гострими респіраторними вірусними інфекціями (ГРВІ) – ГРЗ, спричиненими вірусами. До ГРВІ належать хвороби, при яких ураження дихальної системи є провідним синдромом.
У патогенезі хронічного риносинуїту запалення також відіграє ключову роль. Основною патогенетичною ланкою цієї форми РС вважається порушення вентиляції і дренажу приносових пазух внаслідок блокади остіомеатального комплексу в середньому носовому ході, однак значення вірусної і бактеріальної інфекції є сумнівним.
Визначення хронічного РС, як правило, включає в себе наявність назальних поліпів або назального поліпозу. Клінічно термін «поліпоз носа» об'єднує усі види поліпозу носа, які локалізуються у зоні решітчастої кістки, середнього носового ходу, середньої носової раковини і виглядають як сіро-голубі випинання. Джерелом поліпів вважають слизову оболонку середньої носової раковини і середнього носового ходу, тоді як нижня носова раковина не має тенденції до формування поліпів. Причини цього невідомі.
Згідно із загальноприйнятою концепцією Мессерклінгера щодо причинності у виникненні риносинуїтів, особливості анатомії носа та ОМК визначають патофізіологічні зрушення в слизовій оболонці, а саме в роботі МТС, що потенціює ушкоджуючий вплив несприятливих факторів середовища (як зовнішніх, так і внутрішніх), а також випадкових факторів. Внаслідок впливу вищезазначених факторів формується один або декілька синдромів: порушення функції МТС, гіпоімунний, алергічний синдром та ін. Інфекційне (вірусне, рідше – бактеріальне чи грибкове) навантаження відіграє вирішальну роль в реалізації ГРС. Факт вирішального інфекційного впливу є загальновідомим та не підлягає сумніву. ГРС зазвичай розвивається як прояв ГРВІ. Таким чином, починається тригерний етап розвитку запального процесу у ВДШ. Під впливом патогенних мікроорганізмів (більше ніж 80% – це віруси) відбувається руйнування війчастого епітелію, а також зменшення відносної частки золь-фази, що призводить до порушення евакуації гель-фази. Відбувається скупчення вірусів на поверхні епітеліального шару слизової оболонки. Це стає сигналом для клітин, що беруть участь у її захисті – нейтрофілів, еозинофілів, опасистих клітин, макрофагів, базофілів, лімфоцитів. При активації цих клітин вивільняються медіатори запалення – гістамін, фактор агрегації тромбоцитів, простагландини, цитокіни, в результаті дії яких розвивається реактивний набряк слизової оболонки носової порожнини. Таким чином, вірусна інфекція надзвичайно швидко запускає каскад запалення і починається гострий вірусний риносинуїт.
Прогресуючий набряк слизової оболонки призводить до блокади співусть приносових пазух. Особливо швидко це відбувається за наявності анатомічних аномалій порожнини носа. Розпочинається 2-й етап розвитку запалення – альтерація тканин, а реактивний набряк слизової оболонки прогресує в запальний. Таким чином, гострий вірусний риносинуїт трансформується в гострий післявірусний. Порушується вентиляція та дренаж приносових пазух, що призводить до застою секрету, пошкодження епітелію, порушення функції МТС. Порушення функції МТС призводить до значного зниження локальної протиінфекційної резистентності й спричиняє зміну мікробіоценозу приносових пазух – відбувається патогенізація сапрофітної мікрофлори. Запальний процес поширюється на власну пластинку СО. Так замикається вадне коло етіопатогенезу ГРС. При порушенні відтоку вмісту, в пазусі відбувається накопичення слизистого секрету, який в результаті патогенізації мікрофлори нагноюється. Таким чином гострий післявірусний риносинуїт трансформується в бактеріальний (інфекційний) риносинуїт.
Реактивний, а пізніше – запальний набряк слизової оболонки, блокада співусть, накопичення секрету і його інфікування обумовлює появу симптомів, характерних для ГРС, а саме гіперемії, набряку, ринореї, закладеності носа. З часом симптоми регресують, переходячи у відновний етап, коли відбувається нормалізація слизової оболонки носа та відновлення її функціональної здатності, або за наявності несприятливих умов – формування хронічного риносинуїту (ХРС).
Величезна роль у формуванні ХРС відводиться порушенням аеродинаміки порожнини носа (аномалії носової порожнини, носових раковин та перегородки носа) та індивідуальним та віковим особливостям імунітету. На даний час роль інфекції у виникненні хронічних запальних процесів процесів носа та приносових пазухах – перебільшена, а центральне місце посідають місцеві анатомо-фізіологічні чинники. У 5 % хворих синуїт має одонтогенний генез. Якщо запальний процес у приносових пазухах не піддається санації або рецидивує, то причину цього слід шукати у порожнині носа, у решітчастому лабіринті, чи ділянці вивідних співусть синусів. Це має відношення і до первинних і до одонтогенних, посттравматичних і інших синуїтів, що рецидивують після, здавалось би, успішного курсу консервативного лікування. Як правило, рушійним моментом для порушення дренажу пазух є вузька ділянка, що знаходиться в передніх відділах середнього носового ходу – «остіомеатальний комплекс».
Риносинуїт можна визначити як запалення слизової оболонки порожнини носа і приносових пазух, яке призводить до виникнення певних клінічних ознак і симптомів. Усі симптоми умовно можна розділити на кілька груп: суб'єктивні прояви (скарги), об'єктивні прояви, які виявляються при рино-, фарингоскопії, ендоскопічному, радіологічному обстеженні, дані лабораторних досліджень. Використання тих чи інших методів діагностики ГРС та інтерпретацію отриманих даних залежно від рівня надання медичної допомоги регламентує ряд регуляторних документів, зокрема державні стандарти надання медичної допомоги, а також рекомендації EP3OS – Європейського меморандуму з лікування риносинуїту і поліпозу носа (остання редакція – 2012 року).
| Великі симптоми | Малі симптоми |
|---|---|
| Біль або розпирання в ділянці обличчя (ураженої пазухи) | Головний біль |
| Порушення носового дихання | Втомлюваність |
| Стікання виділень по задній стінці глотки | Неприємний запах з рота |
| Порушення нюху | Зубний біль |
| Слизисто-гнійні виділення з носа | Кашель |
| Гарячка | Вушний біль/відчуття повноти у вусі |
Рисунок 2. Суб'єктивні прояви (симптоми) риносинуїту, важливі для діагностики.
Діагноз РС встановлюється за наявності у хворого 2 або більше великих або 1 великого та 2 або більше малих симптомів, причому у більшості випадків утруднення носового дихання є провідним симптомом. Одним із важливих симптомів ураження приносових пазух є біль або розпирання в проекції ураженої пазухи. Цей симптом має свої топічні особливості, пов'язані з ураженою пазухою: при етмоїдиті біль спостерігається в ділянці перенісся та внутрішнього кута ока, верхньощелеповому синуїті – передня стінка середньої зони обличчя, фронтиті – лобній ділянці. При ураженні основної пазухи біль спостерігається у тім'янопотиличній ділянці.
ГРС переважно розпочинається як прояв ГРВІ (80% випадків).
Різні віруси обумовлюють різні клінічні особливості ураження ВДШ:
У зв'язку з тропністю вірусів до слизової оболонки певних відділів респіраторного тракту, клінічні форми гострих вірусних риносинуїтів є дуже різноманітними і можуть бути представлені супутнім фарингітом, ларингітом, трахеїтом, бронхітом і т.д., але усіх їх об'єднує наявність запального процесу у верхніх дихальних шляхах. Гострі вірусні РС у подальшому швидко трансформуються у післявірусні, частина з яких (від 0,5 до 12%) обумовлена бактеріями – гострі бактеріальні РС (ГБРС).
Про розвиток ГБРС треба думати, якщо:
Аналіз і оцінка суб'єктивних проявів захворювання особливо актуальні для лікарів-спеціалістів загальної практики-сімейної медицини, педіатрів, терапевтів, оскільки їх практика є основою в діагностиці риносинуїтів.
При зовнішньому огляді звертають увагу на стан м'яких тканин обличчя та зовнішнього носа. Проводять пальпацію зовнішнього носа з метою виявлення набряку тканин, а також болючих зон. Болючість носа у ділянці внутрішнього кута ока може свідчити про етмоїдит. Далі здійснюють пальпацію передньої та нижньої стінок лобних пазух, а також місця виходу верхньої гілочки очного нерва. Болючість у цих ділянках може свідчити про ураження лобної пазухи. Наступним етапом є пальпація передньої стінки верхньощелепної пазухи. Оцінюють стан м'яких тканин, а також болючість у місці виходу нижньоочного нерва (другої гілочки трійчастого нерва), його болючість характерна для запалення верхньощелепової пазухи. Далі проводять огляд і пальпацію бокових тканин шиї і обличчя, пальпацію лімфатичних вузлів. Перед проведенням пальпації голову пацієнта нахиляють у досліджуваний бік з метою розслаблення м'язів. Обстежують під- та защелепні лімфатичні вузли, лімфатичні вузли передньої і бокової групи, над- і підключичні. Аналогічно проводять огляд з протилежного боку.
Передня риноскопія проводиться за допомогою носового дзеркала. При цьому оцінюють стан СО передніх відділів носової порожнини (передніх відділів нижньої та середньої носових раковин). Встановлюють наявність гіперемії та набряку СО, а також патологічних виділень у просвіті носової порожнини. Залежно від ступеня вираженості набряку, може реєструватись легкий набряк, виражений набряк або обструкція носових ходів. Під час прицільного огляду середнього носового ходу виявляють смужку виділень з-під середньої носової раковини (патогномонічний симптом ГРС).
Орофарингоскопію проводять за допомогою шпателя, яким притискають язик і звільняють для огляду задні відділи ротової порожнини та глотку. Звертають увагу на стан м'якого піднебіння, бокових відділів глотки, мигдаликів. Відтискаючи корінь язика, оглядають задню стінку глотки з метою виявлення набряку, гіперемії, патологічних виділень, що стікають з носоглотки. При фарингоскопії у хворих на ГРС виявляють смужку виділень, що стікає по задній стінці глотки. Фарингоскопічний метод обстеження під силу лікарю будь-якої спеціальності.
4. Мікробіологічне дослідження: культуральне дослідження вмісту приносових пазух з виділенням патогенів у кількості > 104 КУО/мл дає змогу встановити діагноз ГБРС. Достовірне дослідження вмісту пазухи не може бути проведене шляхом дослідження виділень з носа або мазків з носа/носоглотки. У рутинній практиці мікробіологічне дослідження не показане.
5. Діагностична трепанопункція: здійснюється під місцевим знеболенням за допомогою пункційної голки Куликовського через латеральну стінку нижнього носового ходу, де кісткова стінка верхньощелепної пазухи вважається найтоншою. Пункція верхньощелепної пазухи проводиться з метою оцінки об'єму пазухи та наявного в ній вмісту. Оцінюють наявність і характер виділень, шприцом відсмоктують вміст. Останнім часом пункцію для діагностики ГРС практично не застосовують.
ВАЖЛИВО! Згідно з рекомендаціями EP3OS (редакція 2012 року), ні рентгенографія приносових пазух, ні тим більше КТ чи МРТ, ні діагностична пункція, ані мікробіологічне дослідження не вважаються необхідними для підтвердження діагнозу гострого риносинуїту, і в рутинній клінічній практиці використання цих методів дослідження не показане. Їх використання рекомендоване, в основному, у наступних випадках:
З метою адекватної інтерпретації отриманих даних і визначення емпіричної лікувальної тактики важливо визначити ступінь тяжкості перебігу гострого риносинуїту (рис. 3). В основу шкали оцінки покладені основні локальні й загальнозапальні симптоми риносинуїту.
| Легкий перебіг | Тяжкий перебіг |
|---|---|
| Слизова або гнійна ринорея | Те ж саме + |
| Кашель у денний час | Висока лихоманка (> 39 °С) |
| Температура тіла нормальна або незначно підвищена | Порушення загального самопочуття |
| Наявність неприємного запаху з рота (галітоз) | Головний біль |
| Іноді набряк тканин орбіти |
Рисунок 3. Ступені тяжкості ГРС.
Згідно з міжнародними документами (EP3OS, редакція 2012 року), визначення ступеня тяжкості ГРС повинно базуватись на суб'єктивній оцінці свого стану пацієнтом за 10-сантиметровою візуально-аналоговою шкалою (VAS) (рис. 4).
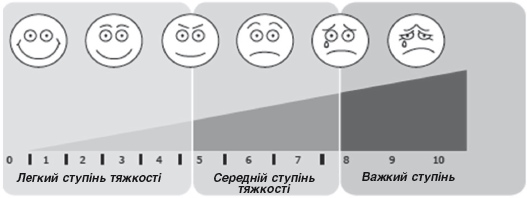
Рисунок 4. Ступені тяжкості ГРС згідно ВАШ.
Максимальна оцінка тяжкості симптомів становить 10 балів. Найчастіше стан пацієнтів оцінюють у 3-5 чи 6-8 балів, що відповідає перебігу легкої та середньої тяжкості, рідше – у 9-10 балів, що свідчить про тяжкий перебіг РС.
Особливості клінічного перебігу та тяжкість захворювання і визначають рутинну, або так звану емпіричну, лікувальну тактику.
Лікування гострого РС, як правило, не передбачає госпіталізації хворого, і проводиться в амбулаторному режимі. Традиційно лікування може бути ефективним тільки тоді, коли діятиме на всі ланки етіопатогенетичного ланцюга. У таких випадках застосовується комплекс препаратів етіотропної, патогенетичної та симптоматичної терапії.
Однак труднощі етіологічного лікування вірусного ГРС очевидні, оскільки вірусна інфекція надзвичайно швидко запускає патогенетичний каскад запалення і швидко зникає, тому як провідний етіологічний чинник є актуальним лише у перші години (рідше – дні) захворювання. У зв'язку з цим противірусні засоби використовують тільки у разі середньотяжкого або тяжкого перебігу РС і застосовують у перші години (дні) захворювання. Пацієнтам з легким ступенем тяжкості перебігу захворювання противірусна терапія не показана. Серед противірусних засобів найефективнішими є препарати, провідним механізмом дії яких є стимуляція утворення ендогенного інтерферону. Їх можна застосовувати для лікування переважної більшості ГРВІ. До них належать аміксин, кагоцел, арбідол, амізон, мефенамінова кислота. З урахуванням провідної ролі вірусів як етіологічного чинника, при гострому вірусному риносинуїті антибактеріальна терапія не показана.
В ряді випадків при ГРС у якості патогенетичного лікування рекомендується призначення топічних глюкокортикостероїдів (ГКС).
Топічні ГКС (мометазону фуроат – Назонекс) показані:
Сила рекомендацій GRADE* в обох випадках (поствірусному гострому риносинуїті та ГБРС) – А, тобто базується безпосередньо на доказах рівня І.
* GRADE – шкала оцінки сили рекомендацій. (англ. Grading of Recommendations Assessment, Development and Evaluation)
Патогенетично обґрунтоване лікування вимагає призначення препаратів з переважно протинабряковою, протизапальною, секретолітичною дією, як провідними патогенетичними ланками гострого вірусного риносинуїту (рис. 5). Крім того, враховуючи наявність фонового та поглибленого вірусною інфекцією локального імунодефіциту, а також ризику приєднання бактеріальної інфекції, показані також препарати з імуностимулюючою та антибактеріальною дією. У результаті прагнення вплинути на усі перераховані ланки етіопатогенезу вірусного риносинуїту, призводить у повсякденній практиці до призначення 4-5, а іноді й більшої кількості препаратів. Поліпрагмазія неминуче призводить до великого переліку небажаних ефектів як медичного, так і морального та фармакоекономічного характеру. Тому слід віддавати перевагу препаратам з комплексною фармакологічною дією, що дає змогу одночасно впливати на основні ланки етіопатогенезу захворювання.
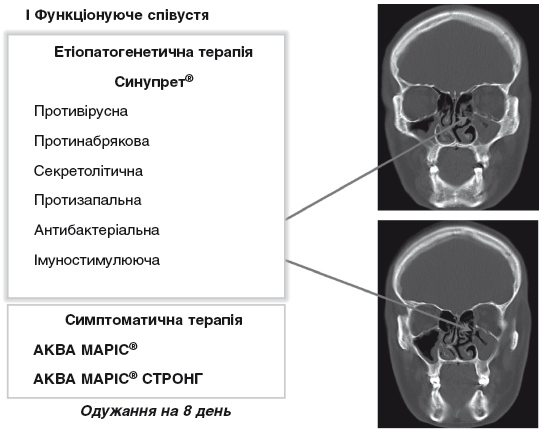
Рисунок 5. Провідні ланки патогенезу вірусного ГРС та їх корекція (І).
Основною вимогою до таких засобів у контексті лікування гострого вірусного риносинуїту є поєднання компонентів із протизапальною, протинабряковою, секретолітичною, імуностимулюючою та антиінфекційною (щодо вірусів та бактерій) дією.
Препаратом, у якому раціонально поєднуються фармакологічні ефекти, необхідні для комплексного патогенетично обґрунтованого лікування РС, є Синупрет – рослинний секретолітик, що виявляє протинабрякову, протизапальну, секретолітичну, імуностимулюючу, противірусну та антибактеріальну дію. Він містить 5 рослинних компонентів, зокрема це корінь горичавки, квітки первоцвіту, трава вербени, квітки бузини, трава щавлю. Препарат забезпечує ефективну боротьбу з вірусною інфекцією. У результаті цілого ряду досліджень було підтверджено in vitro дозозалежний противірусний ефект. Реплікація вірусів (аденовірус 5 и HRV 14) придушувалась, в середньому, на 60%, а в ряді випадків – більше 80% (RSV), що порівнюється з дією синтетичних препаратів (ремантадин, амантадин). Препарат посилює синтез α- і γ-інтерферонів, стимулюючи гуморальну ланку імунітету, і таким чином забезпечує противірусний ефект. У клініці через декілька днів його прийому спостерігають виражене інгібування активності вірусу грипу А, парагрипу типу 1 та RS-вірусу. Важливим елементом етіопатогенетичного лікування є підтримка захисних сил організму, яка здійснюється завдяки імуномодулюючій дії препарату: Синупрет збільшує кількість фагоцитів та стимулює гранулоцитарний фагоцитоз, покращуючи таким чином стан клітинної ланки імунітету (Shwenk V. 1997, Ito Het et al.1982. Wagner H et al. 1997). Доведений бактерицидний ефект Синупрету щодо низки грампозитивних бактерій, які є провідною причинною флорою при гострому бактеріальному риносинуїті (P.Stierna, 2002, 19th Congress ot the European Phinologic Society, 2002, World Allergy Congress, Munich, 2006). Цей аспект є особливо важливим з точки зору профілактики ГБРС, особливо з урахуванням, що профілактична антибактеріальна терапія не показана. Менш вираженою є дія Синупрету на грамнегативну флору.
Синупрет має протинабрякову дію. При експериментальних дослідженнях in vivo препарат пригнічує утворення запального набряку кінцівки щурів, провокованого фармацевтичним впливом, порівняним з синтетичним НПЗП – ібупрофеном та має дозозалежний ефект. Це пов'язано з дією сапонінів (Ziska T. та ін.). Препарат інгібує ЦОГ, знижує утворення медіатора запалення – простагландина Е2 (Wagner H et al., 1997). Завдяки своїм властивостям, Синупрет сприяє зменшенню реактивного та запального набряку слизової оболонки носа, що підтверджується багатьма клінічними дослідженнями за участі тисяч пацієнтів.
Крім того, препарат забезпечує адекватний відтік секрету з приносових пазух. Його секретолітична дія реалізується за допомогою 2 механізмів: непрямий секретолізис завдяки сапонінам, що входять до складу рослинних компонентів, а також рефлекторна секретолітична і деконгестивна дія шляхом впливу на систему блукаючого нерва (парасимпатична нервова система). Також препарат впливає на секрецію хлоридів респіраторним епітелієм через активацію трансмембранного хлорнатрієвого насоса (Virgin F. 2010, Laryngoscope 120: May). Це, у свою чергу, покращує гідратацію золь-фази назального секрету, нормалізує його в'язкість та активує мукоциліарний транспорт, що фактично є основною запорукою успішного лікування ГРС. Крім того, Синупрет збільшує частоту коливання війок, що, у поєднанні з секретолітичною дією, відновлює роботу МТС.
Таким чином, Синупрет має багатовекторну, комплексну і цілеспрямовану дію на слизову оболонку носа і додаткових пазух, включаючи співустя, що перекриває практично усі ланки етіопатогенетичного ланцюга гострого вірусного риносинуїту. У зв'язку з цим, при легкому його перебігу пацієнтам показана монотерапія вказаним фітопрепаратом. Дорослим Синупрет призначають по 2 таблетки (або по 50 крапель) 3 рази на добу, дітям віком 6-11 років – по 1 таблетці (25 крапель) 3 рази на добу, дітям віком 2-5 років – по 15 крапель 3 рази на добу.
Крім етіопатогенетично обгрунтованої, в клінічній ринології часто використовується симптоматична терапія. Симптоматичне лікування не є провідним, але фактично воно завжди використовується лікарем, а особливо пацієнтом, у плані самолікування. Симптоматичне лікування особливо потрібне для поліпшення якості життя пацієнта на перших порах етіопатогенетичного лікування. Як відомо, провідною ланкою патогенезу гострих вірусних риносинуїтів є виражений набряк слизової оболонки носа і приносових пазух. Тому найчастіше для симптоматичного лікування використовують деконгестанти (congestion – закупорка, застій) – групу препаратів, що викликають вазоконстрикцію (звуження) судин слизової оболонки носової порожнини. У якості деконгестантів найчастіше застосовують препарати нафазоліну, ксилометазоліну, фенілефрину.
Набряк слизової оболонки носа при гострому вірусному риносинуїті, на відміну від інших форм, має певні особливості. Реактивні набрякові зміни слизової оболонки обумовлені вивільненням величезної кількості вазоактивних речовин (гістамін, брадикінін та ін.) із зруйнованих клітин епітеліального шару, які, всмоктуючись із поверхневих шарів слизової оболонки, сприяють розширенню судин і гідратації тканин. Використання у даній ситуації судинозвужувальних препаратів призводить до пригнічення мікроциркуляції і секреції, що тягне за собою відчуття печії, сухості в носі. Крім того, пригнічення мікроциркуляції призводить до застою і накопичення у тканинах токсичних продуктів. У зв'язку з цим, повторне використання препарату призводить до прогресування запального процесу, а також до розвитку синдрому «рикошету» (rebound-syndrome) – зворотного ефекту від використання деконгестантів. Це потребує більш частого використання препарату, яке стає практично неконтрольованим ні за частотою, ані за дозою. З урахуванням високої системної біодоступності цих препаратів, вони спричиняють виражений системний симпатоміметичний вплив (збудження, головний біль, безсоння, нудота, тахікардія, підвищення артеріального та внутрішньоочного тиску), а в ряді випадків виникає висока вірогідність отруєння, особливо у дітей. У структурі найбільш частих причин отруєння у дітей, назальні деконгестанти займають третє місце.
У пацієнтів з гострим вірусним риносинуїтом патогенетично обґрунтованим є обмеження контакту слизової оболонки з вірусами та біологічно активними продуктами зруйнованих ними клітин респіраторного епітелію, як основної причини прогресування набряку і запального процесу в цілому. Для попередження їх прогресування, вторинного бактеріального інфікування, необхідне ефективне видалення слизу із носової порожнини і зменшення набряку слизової оболонки, по можливості без використання судинозвужувальних препаратів. Таким вимогам (зменшення і ліквідація набряку слизової оболонки носової порожнини, а також її очищення) відповідає використання іригаційної, осмотично активної терапії ізотонічними та гіпертонічними сольовими розчинами, приготованими на основі морської води, а саме назальних спреїв Аква Маріс та Аква Маріс Стронг. Як відомо, для ендоназального використання найбільш ефективними і зручними є аерозольні препарати. Але великі (150μm і більше) краплі аерозолю скочуються по слизовій оболонці у носоглотку, не затримуючись у носовій порожнині, а менше 10μm – можуть проникати у нижні дихальні шляхи, що небажано, тому величина крапель повинна знаходитись саме в цих межах. Назальні спреї Аква Маріс та Аква Маріс Стронг відповідають цим вимогам – розмір крапель аерозолю складає 30-150 μm, що забезпечує найбільш оптимальний розподіл препарату по поверхні слизової оболонки. Іригаційна терапія ізотонічним спреєм Аква Маріс сприяє змиванню вірусів і бактерій із слизової оболонки носової порожнини. Ізотонічний розчин морської води має також антисептичні властивості за рахунок того, що іони йоду та Cl активують продукцію захисного слизу бокаловидними клітинами слизової оболонки. Препарат активізує роботу миготливого епітелію за рахунок іонів Mg і Ca. Зменшує запальні явища і підвищує місцевий імунітет завдяки стимуляції утворення лізоциму, інтерферонів та імуноглобулінів іонами Zn та Se. Таким чином, ізотонічний спрей Аква Маріс сприяє зменшенню запалення та очищенню слизової оболонки носової порожнини як механічним шляхом, так і за рахунок стимулюючого діяльність миготливого епітелію ефектів. Завдяки вказаним ефектам, препарат відноситься до природніх деконгестантів, зменшує набряк слизової носа. Препарат призначається дорослим і дітям з однорічного віку по 1-2 інстиляції 3-5 разів на день.
При недостатньому деконгестивному ефекті ізотонічного Аква Маріс, показане використання спрею Аква Маріс Стронг. Основні його лікувальні ефекти пов'язані з осмотичною дією гіпертонічного розчину. Концентрація сольового розчину 3-3,5% оптимальна для деконгестивної дії на слизову оболонку, оскільки вона найбільш ефективна і безпечна. Крім того, патогенні мікроорганізми, що знаходяться у просвіті носової порожнини, також будуть втрачати рідину, зморщуватись і гинути – так реалізується протимікробний ефект гіпертонічного розчину морської води, що важливо для попередження ускладнень – розвитку бактеріального риносинуїту. Препарат показаний як альтернатива до застосування назальних деконгестантів, особливо у осіб з тривалим прийомом деконгестантів і тих, що страждають на підвищену чутливість до хімічних лікарських препаратів, вагітним, жінкам у період лактації, дітям з 1 року. Препарат призначається дорослим і дітям з одного року по 1-2 інстиляції 3-5 разів на день.
Завдяки своїй комплексній дії, препарати морської води впливають на такі важливі ланки етіопатогенезу ГРС, як набряк слизової оболонки, що спричиняє блокаду співусть приносових пазух, порушення реологічних та біологічних властивостей назального слизу, сприяють зменшенню інфекційного навантаження. Виразна деконгестивна дія гіпертонічного розчину не поступається за ефективністю судинозвужуючим препаратам, уникаючи при цьому всіх негативних наслідків їх застосування.
Таким чином, комплексна багатовекторна дія Синупрету та спреїв Аква Маріс спрямована на зменшення набряку, покращення реологічних властивостей назального слизу, реактивацію мукоциліарного кліренсу, зменшення явищ запалення, забезпечення найкращого лікувального ефекту. Крім того, противірусна та антибактеріальна дія, активація локального імунного захисту завдяки властивостям Синупрету є потужним фактором профілактики інфекційних (гнійних) ускладнень гострого вірусного риносинуїту.
Застосування патогенетично обґрунтованої терапії гострого вірусного риносинуїту препаратами з комплексною дією, тропною до слизової оболонки дихальних шляхів показане для лікування хворих на гострий риносинуїт, серед яких гострий вірусний зустрічається більше як у 54% випадків. Монотерапія гострого вірусного риносинуїту базовим комплексним фітопрепаратом Синупрет та допоміжна терапія препаратом Аква Маріс забезпечує одужання на 7-8 день лікування. Лікування не супроводжується небажаними побічними проявами, легко переноситься хворими. У зв'язку з невеликою кількістю призначених препаратів, хворі проявляють прихильність (комплаєнс задовільний) до лікування, що не суперечить основному Європейському керівництву з лікування риносинуїтів – EP3OS (редакція 2012 року).
Як відомо, гострий вірусний риносинуїт – швидкоплинний процес, тому в умовах відсутнього або неадекватного лікування швидко трансформується у наступну форму – гострий післявірусний риносинуїт. Він зустрічається у третини пацієнтів, хворих на ГРС – 30,4%. На фоні наростаючого набряку слизової оболонки, що особливо прогресує на фоні різноманітних анатомічних особливостей носової порожнини (деформації носової перегородки, аномалії носових раковин, решітчастого лабіринту та ін.), розпочинається наступний етап розвитку запалення, коли реактивний набряк слизової оболонки прогресує в запальний. Посилення набряку слизової оболонки у ділянці співусть призводить до їх дисфункції. Порушується вентиляція та дренаж приносових пазух, що призводить до застою і накопичення секрету, подальшого пошкодження епітелію. На фоні руйнування війчастого епітелію та набряку СО відбувається подальше порушення реологічних властивостей назального слизу, що призводить до «загущення» гель-фази, погіршення функції МТС із наступним порушенням евакуації вмісту з пазух. Вказані зміни посилюють запальні прояви у тканинах, а реактивний набряк слизової оболонки змінюється на запальний, приводячи вже до часткової блокади співустя з пазухою. Таким чином гострий вірусний риносинуїт трансформується в гострий післявірусний.
У діагностиці гострого післявірусного риносинуїту важливим є те, що тривалість захворювання – більше 7 днів, характерним є середній ступінь тяжкості перебігу захворювання, посилення головного болю. Важливою є зміна характеру головного болю, який із розлитого починає трансформуватись у лицевий (у проекції приносових пазух). Прогресує закладеність носа, з'являється серозно-слизова ринорея, слизиcті виділення на задній стінці глотки, гіперемія задньої стінки глотки, кашель, підвищена температура тіла. При оцінці тяжкості перебігу процесу за візуально-аналоговою шкалою (ВАШ), його ступінь, як правило, відповідає 5-7-8 балів, або середньо-тяжкому (рис. 6).
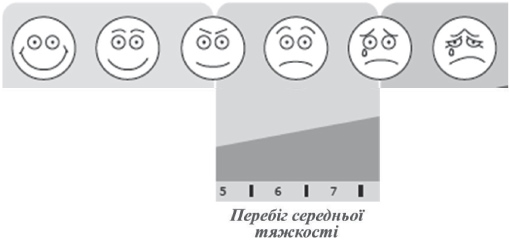
Рисунок 6. Середній ступінь тяжкості ГРС згідно ВАШ.
У контексті етіопатогенезу гострого післявірусного риносинуїту, противірусна чи антибактеріальна терапія не показані. У даному випадку показана патогенетична терапія, яка адекватно відповідала б усім особливостям запального процесу при даній формі захворювання. Як відомо, провідною ланкою патогенезу післявірусного РС є наростання запального набряку на фоні порушення реології назального секрету, функції МТС і часткова функціональна блокада співусть приносових пазух. Патогенетичне обґрунтування лікування вимагає призначення препаратів з переважно протинабряковою, протизапальною, секретолітичною дією, скерованою на провідні патогенетичні ланки гострого післявірусного риносинуїту (рис. 7).
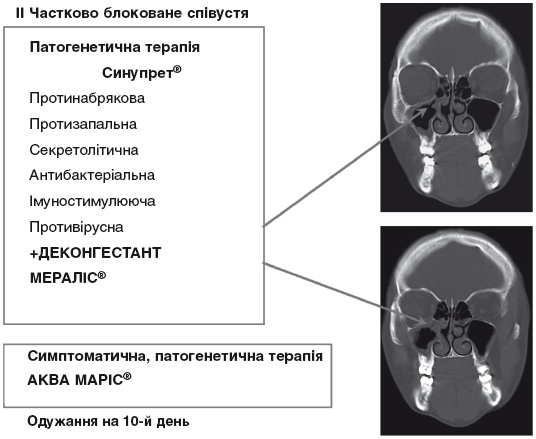
Рисунок 7. Провідні ланки патогенезу післявірусного ГРС та їх корекція (ІІ).
Для запобігання поліпрагмазії слід віддавати перевагу препаратам з комплексною фармакологічною дією, що дає змогу одночасно впливати на основні ланки патогенезу захворювання. Основною вимогою до таких засобів у контексті лікування гострого післявірусного риносинуїту є поєднання компонентів з протизапальною, протинабряковою, секретолітичною дією. Препаратом, який раціонально поєднує усі необхідні фармакологічні ефекти, є Синупрет.
Синупрет має виражену протинабрякову дію, сприяє зменшенню реактивного та запального набряку слизової оболонки носа. Його секретолітична дія реалізується через покращення гідратації золь-фази назального секрету, нормалізації його в'язкості. Покращення реології назального слизу разом із збільшенням частоти коливання війок миготливого епітелію, які характерні для Синупрету, активує роботу мукоциліарного транспорту, забезпечує адекватний відтік секрету з приносових пазух, що значно зменшує запальні прояви і фактично є основною запорукою успішного лікування ГРС.
Як відомо, порушення аерації пазух і функції МТС є фактором ризику розвитку інфекційних, зокрема бактеріальних, ускладнень. Проте профілактичне призначення антибактеріальних препаратів усіма без винятку сучасними керівництвами категорично не рекомендується. Тому в плані запобігання переходу гострих післявірусних риносинуїтів у бактеріальні цінною є імуностимулююча та антибактеріальна дія Синупрету. Препарат збільшує кількість фагоцитів та стимулює гранулоцитарний фагоцитоз, покращуючи таким чином стан імунітету і проявляючи бактерицидний ефект щодо низки грампозитивних та частково грамнегативних бактерій.
Таким чином, Синупрет має багатовекторну, комплексну й цілеспрямовану дію на слизову оболонку носа і додаткових пазух, включаючи співустя, що перекриває практично усі ланки етіопатогенетичного ланцюга гострого післявірусного риносинуїту. У зв'язку з цим, він є препаратом вибору. Дорослим Синупрет призначають по 2 таблетки (або по 50 крапель) 3 рази на добу, дітям віком 6-11 років – по 1 таблетці (25 крапель) 3 рази на добу, дітям віком 2-5 років – по 15 крапель 3 рази на добу.
Причиною часткової блокади співусть приносових пазух при гострих післявірусних риносинуїтах є виразний запальний набряк слизової оболонки носа і приносових пазух. У зв'язку з цим досить часто і обґрунтовано застосовується симптоматична терапія деконгестантами, які не тільки полегшують носове дихання, а й сприяють зменшенню обструкції співусть (таким чином, їх умовно можна віднести до патогенетичних засобів). Як правило, використовують місцеві деконгестанти, рідше – системні. Більш зручними і практичними у використанні є назальні спреї, оскільки вони дають змогу зменшити дозу препарату за рахунок більш рівномірного його розподілу по поверхні слизової оболонки носової порожнини. Місцеві інтраназальні деконгестанти поділяються на препарати короткої дії (протягом 4-6 год.): ефедрин, епінефрин (адреналін), нафазолін та ін.; середньотривалої дії (протягом 8-10 год.): ксилометазолін, та довготривалої дії (до 12 год.) – оксиметазолін. В амбулаторній практиці найбільш зручними, і тому доцільними для використання, є препарати ксилометазоліну, оскільки середньотривала дія препарату визначає частоту його використання – 2 рази на добу. Препарати ксилометазоліну, як і будь-які інші деконгестанти, слід застосовувати не довше ніж 4-5 днів. Дослідження показали, що використання ксилометазоліну в назальних краплях і спреях призводить до змін слизової оболонки носа і може бути причиною таких несприятливих ефектів препарату як зниження мукоциліарного транспорту, пошкодження клітин епітелію дихальних шляхів (циліотоксичний ефект), загострення медикаментозного риніту, та викликати дисфункцію нейтрофілів. Препаратом, який дозволяє запобігти вказаним негативним проявам, є Мераліс – перший в Україні інноваційний деконгестант нового покоління на основі морської води. До його складу входять ксилометазоліну гідрохлорид та вода Адріатичного моря, а особлива форма дозуючої помпи дозволяє обійтись без консервантів, оскільки попереджує інфікування вмісту балончика. Ксилометазолін забезпечує швидку (через 5-10 хвилин) і тривалу (8-10 годин) дію. Морська вода дозволяє використати усі переваги іригаційної терапії, а також нівелює всі негативні наслідки використання деконгестантів: зволожує і, за рахунок мікроелементів, що входять до її складу, покращує трофіку слизової оболонки, що сприяє її відновленню. Таким чином, попри виразний деконгестивний ефект, препарат забезпечує подвійну безпеку за рахунок наявності морської води й відсутності консервантів. Препарат призначається дітям від двох років і дорослим по одному – два впорскування на добу.
Застосування базової медикаментозної терапії гострого післявірусного риносинуїту комплексним препаратом для лікування синуїтів – Синупретом та її доповнення інноваційним деконгестантом Мераліс пов'язане із порушенням функціональної спроможності співусть, як основної ланки етіопатогенезу ГРС, з урахуванням ступеня тяжкості перебігу, показує високу ефективність. Використання такої методології лікування призводить до значної регресії суб'єктивної симптоматики і виразного лікувального ефекту вже на третій день практично у всіх хворих. Значний регрес симптоматики і відновлення функціонального стану співусть дозволяє відмінити лікування деконгестантом на 3-4 день і продовжити монотерапію Синупретом до повного одужання, яке настає практично у всіх пацієнтів на 8-10 день лікування. Після відміни Мералісу доцільно продовжити місцеву іригаційну терапію ізотонічними спреями Аква Маріс, а в разі необхідності – Аква Маріс Стронг.
Найбільш тяжкою формою гострого риносинуїту є гострий бактеріальний риносинуїт, який зустрічається у 15,2% хворих.
Наростаючий запальний набряк слизової оболонки посилює функціональну недостатність співусть приносових пазух і призводить до їх повної блокади. На фоні застою, накопичення в пазухах секрету і практично повного паралічу МТС формується ключова ланка бактеріального риносинуїту – патогенізація сапрофітної флори. Внаслідок зниження неспецифічної та специфічної ланок імунітету (резистентності) слизової оболонки в пазусі із повністю блокованим співустям, сапрофітна флора набуває патогенних властивостей. Провідну роль відіграють Streptococcus pneumoniae (42% випадків), Haemophilus influenzae (29-47%; до 38% штамів продукують β-лактамази), Moraxella catarrhalis (22%; до 100% штамів продукують β-лактамази), Staphylococcus aureus + ентеробактерії (10% випадків; до 100% штамів продукують β-лактамази). Атипові збудники при гострих інфекціях верхніх дихальних шляхів клінічного значення не мають.
Внаслідок приєднання бактеріального компоненту запальний процес поглиблюється, розповсюджується на власну пластинку слизової оболонки, що призводить до посилення її набряку і повного блоку співустя. Таким чином, гострий післявірусний риносинуїт трансформується у гострий бактеріальний (ГБРС). Про розвиток ГБРС треба думати, якщо:
У діагностиці гострого бактеріального риносинуїту важливим є те, що пацієнти відзначають посилення закладеності носа, наявні гнійні виділення з носа і по задній стінці глотки. Для нього характерні біль обличчя у проекції пазух або локальний відображений біль, підвищена температура тіла. Характерним є тяжкий ступінь перебігу захворювання. При оцінці тяжкості процесу за візуально-аналоговою шкалою (ВАШ) його ступінь, як правило, відповідає тяжкому перебігу: 7-8-10 балів (рис. 8).

Рисунок 8. Тяжкий перебіг ГРС згідно ВАШ.
ВАЖЛИВО! Згідно рекомендацій EP3OS (редакція 2012 року), ні рентгенографія приносових пазух, ані тим більше КТ чи МРТ, ні діагностична пункція не вважаються необхідними для підтвердження діагнозу гострого бактеріального риносинуїту й у рутинній практиці використання цих методів дослідження не показане. Їх використання рекомендоване, в основному, у наступних випадках: неефективність емпіричної антибактеріальної терапії, рецидивуючий характер перебігу, ознаки розвитку ускладнень, необхідність оперативного втручання.
При обґрунтуванні фармакотерапії ГБРС принципово важливим є положення про те, що провідною ланкою етіопатогенезу є бактеріальне запалення. Головним фактором, що визначає ефективність терапії й прогноз захворювання, є адекватність призначеного лікування саме цієї ланки. Метою лікування є ерадикація інфекції у вогнищі запалення, що і є основним показом до призначення антибактеріальних препаратів (АБП) (рис. 9).
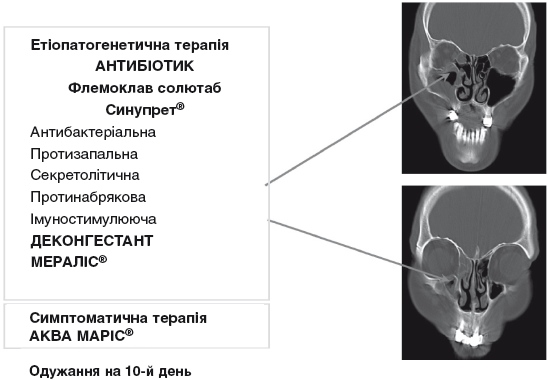
Рисунок 9. Провідні ланки патогенезу бактеріального ГРС та їх корекція (ІІІ).
Сучасні підходи до методології антибактеріальної терапії визначаються рекомендаціями EP3OS в редакції 2012 року: дифдіагностика між вірусною і бактеріальною етіологією процесу проводиться на підставі клінічних даних; мікробіологічне дослідження в рутинних випадках ГБРС не вважається необхідним; вибір антибіотика проводиться емпірично, з урахуванням найбільш вірогідного збудника та його чутливості до антибактеріальних препаратів. Згідно з вітчизняними (наказ МОЗ України № 181 від 24.03.2009 р.) та міжнародними рекомендаціями, препаратом вибору для лікування ГБРС є амоксициліну клавуланат (Флемоклав), який є високоактивним щодо типових збудників цього захворювання, а клавуланова кислота захищає його від руйнування ензимами бактерій.
В амбулаторних умовах у більшості випадків заборонено парентеральне застосування АБП. У зв'язку з цим, малопридатними для застосування в амбулаторних умовах є ампіцилін (через свою низьку біодоступність – 30-40%, у порівнянні з 90% – біодоступністю амоксициліну), а також більшість цефалоспоринів. Альтернативними препаратами вважають цефуроксим аксетил, цефаклор, азитроміцин, кларитроміцин, левофлоксацин.
Антибіотики для парентерального застосування використовують в умовах стаціонару у разі тяжкого перебігу ГРС. Препаратами вибору в такому разі є інгібіторозахищені амінопеніциліни (амоксициліну клавуланат, ампіциліну сульбактам), а альтернативними – цефалоспорини, інгібіторозахищені антисиньогнійні пеніциліни (тикарциліну клавуланат), фторхінолони, карбапенеми. Для лікування ГРС у дітей застосовують АБП пеніцилінового ряду, захищені клавулановою кислотою, у разі неефективності лікування – цефалоспорини III-IV генерації. Якщо захворювання спричиняються хламідіями або мікоплазмами, застосовують макроліди. Дані з ефективності АБТ ГБРС у дорослих наведені в табл. 1.
Таблиця 1. Рекомендована антибіотикотерапія ГБРС у дорослих та дітей (SAHP*)
| Препарат | Клінічна ефективність, % | Бактеріологічна ефективність, % | ||
|---|---|---|---|---|
| Дорослі | Діти | Дорослі | Діти | |
| Легкий перебіг без попередньої антибактеріальної терапії протягом 4-6 тижнів | ||||
| Амоксицилін/клавуланат(Флемоклав) | 90-91 | 91-92 | 97-99 | 97-99 |
| Цефподоксим | 87 | 87 | 91 | 92 |
| При алергії на β-лактами | ||||
| Ко-тримоксазол | 83 | 83 | 84 | 84 |
| Амоксицилін/клавуланат(Флемоклав) | 77 | 78 | 73 | 76 |
*SAHP – Товариство алергії та хвороб синусів (США)
Як видно із таблиці, клінічна ефективність інгібіторзахищених амінопеніцилінів і цефалоспоринів практично не відрізняється, водночас між їх мікробіологічною ефективністю уже є суттєві відмінності. Ці показники дають ще більш суттєвий виграш амінопеніцилінам і меншою мірою – цефалоспоринам, в порівнянні, зокрема, з макролідами. Отже, при лікуванні ГБРС амоксициліну клавуланат є препаратом вибору, що відповідає основним вимогам до АБП, які застосовують при інфекціях ЛОР-органів. Його клінічна та бактеріологічна ефективність вигідно відрізняється від цефалоспоринів та макролідів.
Флемоклав призначають дорослим та дітям старше 12 років у таблетках по 875/125 мг двічі на добу; дітям віком від 2 міс. до 12 років – по 45 мг/кг на добу в 2 прийоми у вигляді суспензії 228,5/5 мл. Тривалість антибактеріальної терапії: 5-денний курс адекватної АБТ може використовуватися при легкому, неускладненому перебігу гострого синуїту, який раніше не лікували. Відсутність відповіді на 2-5 день потребує переходу на один з альтернативних препаратів тривалістю 7-10 днів і більше (з урахуванням вірулентності та резистентності бактерій).
У разі неефективності АБП пеніцилінового ряду, альтернативним препаратом є цефуроксиму аксетил (Зіннат), що є стійким до дії β-лактамаз завдяки наявності оксим-групи. Зіннат належить до проліків, трансформується в травному тракті, у кров усмоктується активна сполука – цефуроксим. Препарат застосовують у дорослих по 250 мг 2 рази на добу; у дітей – по 125 мг 2 рази на добу (максимальна добова доза – 250 мг), дітям старше 2 років у разі тяжкого перебігу інфекцій – по 250 мг двічі на добу.
Результати численних клінічних випробувань довели високу ефективність пероральних форм захищених пеніцилінів та цефалоспоринів при лікуванні гнійно-запальних захворювань приносових пазух. У разі тяжкого перебігу захворювання і необхідності лікування в стаціонарі з парентеральним введенням антибіотиків, застосовують наступну схему: парентеральне введення АБП з переходом на пероральний прийом препарату цієї самої групи. У цьому полягає суть ступеневої АБТ, основною метою якої є зменшення тривалості парентерального застосування АБП, завдяки чому значно зменшується вартість лікування, а також скорочується термін перебування пацієнтів у стаціонарі. При цьому зберігається висока клінічна ефективність лікування. Як правило, тривалість парентеральної терапії складає 2-3 дні. Тривалість пероральної терапії – 5-7 днів.
Критеріями переходу з парентерального на пероральне застосування АБП є:
Ступенева АБТ має декілька варіантів:
Результати численних клінічних випробувань довели високу ефективність захищених пеніцилінів та цефалоспоринів при лікуванні гнійно-запальних захворювань приносових пазух. Тому Європейське керівництво з лікування риносинуїтів – EP3OS (редакція 2012 року) рекомендує антибактеріальну терапію для лікування гострого бактеріального риносинуїту з найвищим рівнем доказовості: клас Іb, рівень доказовості – А.
Антибактеріальна терапія гострого бактеріального риносинуїту виконує роль етіотропної терапії. Проте, крім антибактеріального впливу, патогенетично обґрунтоване лікування вимагає призначення препаратів з протинабряковою, протизапальною, секретолітичною дією, як провідними патогенетичними ланками гострого бактеріального риносинуїту (рис. 9). Крім того, враховуючи наявність бактеріальної інфекції, бажано також використовувати препарати з додатковою антибактеріальною та імуностимулюючою дією. Препаратом, у якому раціонально поєднуються вказані ефекти, необхідні для комплексного патогенетично обґрунтованого лікування ГБРС, є Синупрет – рослинний секретолітик, що виявляє протинабрякову, протизапальну, секретолітичну, антибактеріальну та імуностимулюючу дію. Фармакологічні ефекти Синупрету сприяють зменшенню реактивного та запального набряку слизової оболонки носа. Його секретолітична дія призводить до нормалізації реології назального слизу, покращання роботи війок миготливого епітелію і, як наслідок, – активізації роботи мукоциліарного транспорту, що забезпечує відтік секрету з приносових пазух і фактично є основною запорукою успішного лікування ГБРС. Завдяки своїй комплексній дії, Синупрет проявляє виразний синергічний ефект відносно антибактеріальної терапії. Включення препарату в комплексну терапію гострого ГБРС дозволяє покращити результативність лікування на 27% (рис. 10).
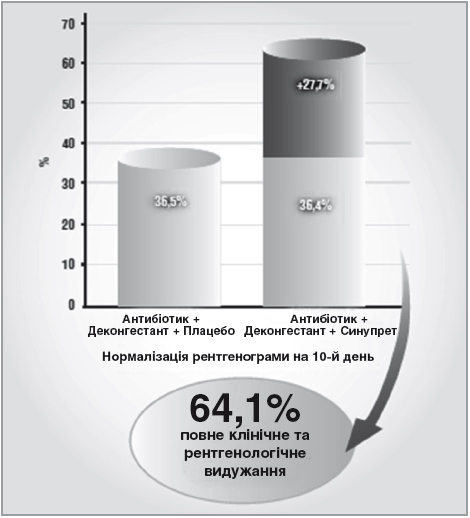
Рисунок 10. Синергічний вплив Синупрету на антибактеріальну терапію (Neubauer Marz).
Дорослим Синупрет призначають по 2 таблетки (або по 50 крапель) 3 рази на добу, дітям віком 6-11 років – по 1 таблетці (25 крапель) 3 рази на добу, дітям віком 2-5 років – по 15 крапель 3 рази на добу.
Причиною блокади співусть приносових пазух при гострих бактеріальних риносинуїтах є виразний запальний набряк слизової оболонки носа і при носових пазух. У зв'язку з цим для застосування показані деконгестанти, які сприяють зменшенню набряку слизової оболонки і обструкції співусть пазух, і таким чином їх використання можна віднести як до симптоматичної, так і до патогенетично обґрунтованої фармакотерапії ГБРС.
Серед великої кількості місцевих деконгестантів препаратом вибору є Мераліс – перший в Україні інноваційний деконгестант нового покоління на основі морської води. Швидку (через 5-10 хвилин) і тривалу (8-10 годин) судинозвужуючу дію забезпечує ксилометазоліну гідрохлорид, а морська вода дозволяє нівелювати усі негативні наслідки використання деконгестантів: зволожує і, за рахунок мікроелементів, що входять до її складу, покращує трофіку слизової оболонки, що сприяє її відновленню. Крім того, Мераліс виявляє виразний симптоматичний ефект, оскільки полегшує носове дихання. Препарат призначається дітям від двох років і дорослим по одному – два впорскування на добу.
Таким чином, застосування базової комплексної медикаментозної терапії гострого бактеріального риносинуїту, що включає етіотропну емпіричну антибактеріальну терапію амоксициліну клавуланатом (Флемоклавом), комплексним фітопрепаратом для лікування синуїтів – Синупретом та її доповнення інноваційним деконгестантом Мераліс, показує високу ефективність. Використання такої методології лікування призводить до значної регресії суб'єктивної симптоматики і виразного лікувального ефекту вже на третій – п'ятий день практично у всіх хворих.
У ці терміни клінічно спостерігається позитивна динаміка суб'єктивних і об'єктивних проявів. На цьому фоні у переважної більшості хворих відмічається значне збільшення кількості патологічних виділень з носа і на задній стінці глотки, які із слизисто-гнійних набувають слизистого характеру. Значне збільшення кількості виділень свідчить про відновлення функції співусть з пазухами і не є ознакою погіршення перебігу захворювання та підставою вважати лікування неефективним. Значний регрес симптоматики і відновлення функціонального стану співусть дозволяє відмінити антибактеріальну терапію і використання деконгестантів на 5-7 день лікування і продовжити системну монотерапію Синупретом.
Після відміни антибактеріальної та деконгестивної терапії актуальним завданням є видалення слизу із носової порожнини і зменшення набряку слизової оболонки, по можливості, уже без використання судинозвужуючих препаратів. Таким вимогам відповідає використання іригаційної терапії ізотонічними сольовими розчинами, приготовленими на основі морської води – спреями Аква Маріс. Ізотонічний розчин води Адріатичного моря володіє антисептичними властивостями, активізує роботу миготливого епітелію, зменшує запальні явища і підвищує місцевий імунітет, зменшує набряк слизової носа. Препарат Аква Маріс призначається дорослим і дітям з однорічного віку по 1-2 інстиляції в кожну половину носа 3-5 разів на день до повного одужання, яке настає практично у всіх пацієнтів на 10-11 день лікування.
Таким чином, застосування базової медикаментозної терапії комплексним препаратом для лікування синуїтів – рослинним секретолітиком Синупрет, та її доповнення, залежно від функціональної спроможності співусть, як основної ланки етіопатогенезу ГРС, з урахуванням ступеня тяжкості перебігу, показало високу ефективність. Використання такої методології лікування забезпечує виразний лікувальний ефект практично у всіх хворих. У пацієнтів з гострим вірусним риносинуїтом, для якого характерним є збереження функціонального стану співустя і легкий ступінь тяжкості захворювання, монотерапія базовим препаратом призводить до повного одужання на 7-8 день лікування. У пацієнтів з гострим післявірусним риносинуїтом захворювання перебігає на фоні середнього ступеня тяжкості процесу, зумовленого частковою блокадою співустя, викликаною більш виразними реактивнозапальними змінами слизової оболонки приносових пазух. З урахуванням виявлених змін, базова терапія Синупретом доповнюється інноваційним деконгестантом Мераліс, і дозволяє досягнути одужання практично у всіх пацієнтів на 7-8 день. При гострому бактеріальному риносинуїті виразні запальні зміни слизової оболонки внаслідок інфекційного її запалення, призводять до повної блокади співусть приносових пазух. Перебіг захворювання характеризується як тяжкий. Це є обґрунтуванням для додаткового призначення до базової терапії Синупретом емпіричної антибактеріальної терапії Флемоклавом та деконгестанта Мераліс. Значний регрес симптоматики і відновлення функціонального стану співусть дозволяє відмінити антибактеріальну терапію і використання деконгестантів на 5-7 день лікування і продовжити системну монотерапію Синупретом до повного одужання, яке настає практично у всіх пацієнтів на 10-11 день лікування.
Застосування препаратів природного походження із комплексною дією дозволяє проводити лікування незначною кількістю препаратів, не супроводжується небажаними побічними проявами, легко переноситься хворими. У зв'язку з невеликою кількістю призначених препаратів, хворі проявляють прихильність (комплаєнс задовільний) до лікування.
У зв'язку з цим, основне Європейське керівництво з лікування риносинуїтів – EP3OS (редакція 2012 року) – рекомендує використання усіх компонентів, які застосовуються у лікуванні ГРС: фітопрепаратів, виготовлених за сучасними технологіями, іригаційної та антибактеріальної терапії з найвищим рівнем доказовості: клас Іb, рівень доказовості А
Запропонована методологія лікування має наступні переваги:
Значне місце серед причин формування хронічного риносинуїту, попри аномалії носової порожнини, займають індивідуальні та вікові особливості імунітету. У свою чергу, часті риносинуїти призводять до ще більшого ослаблення захисних сил організму (місцевої та загальної імунної опірності) та пригнічення імунної системи в цілому. У наступному все це призводить до виникнення синдрому поствірусної астенії та вторинної імунодепресії. У патогенезі хронічного риносинуїту ключову роль відіграє запалення. Основною патогенетичною ланкою цієї форми РС вважається порушення вентиляції та дренажу приносових пазух внаслідок блокади остіомеатального комплексу в середньому носовому ході набряклою слизовою оболонкою. Порушується вентиляція та дренаж приносових пазух, що призводить до порушення реологічних властивостей секрету і функції МТС. Порушення функції МТС призводить до значного зниження локальної протиінфекційної резистентності й спричиняє зміну мікробіоценозу приносових пазух.
Метою медикаментозної терапії хронічного риносинуїту є зменшення набряку слизової оболонки, що сприяє покращенню дренування приносових пазух і санації вірусної та бактеріальної інфекції, яка присутня в уражених пазухах із тривало заблокованими співустями. Це часто вимагає поєднання препаратів, які покращують реологічні властивості назального слизу, імуномодулюючих препаратів, топічних, іноді системних глюкокортикостероїдів, антибіотиків та іригаційної терапії.
Разом з цим, виникає проблема вибору препарату, який би мав комплексну дію: протиінфекційну, протизапальну та імуномодулюючу. Важливою вимогою до таких препаратів є ефективність та висока безпечність. Дані властивості мають препарати, створені на основі фітонірингу, тобто фітопрепарати. Яскравим представником даної групи, що використовується для лікування та профілактики хронічних риносинуїтів, є комбінований препарат - Імупрет. До складу препарату входять екстракти з кореня алтея (Althaea officinalis), квітів ромашки (Matricaria chamomilla), трави тисячолистника (Achillea millefolium), кори дуба (Quercus robur), листя грецького горіха (Juglans regia), трави хвоща польового (Equisetum arvense) і трави кульбаби (Taraxacum officinale).
Екстракти даних лікарських рослин мають протизапальну дію, підвищують захисні сили організму, мають антибактеріальну та противірусну дію, безпосередньо спрямовану на інфекційного агента.
Так, екстракт кореня алтея містить у своєму складі полісахариди та флавоноїди, які мають імуномодулюючу та протизапальну дію за рахунок стимуляції фагоцитозу. Крім того, полісахариди мають обволікаючу дію, внаслідок чого зменшується подразнення слизових оболонок дихальних шляхів і поліпшується стан пацієнта, що страждає непродуктивним кашлем.
До складу квіток ромашки аптечної входять терпеноїди (у тому числі матріцин та альфа-бісеболол), флавоноїди (у тому числі апігенін і лютеолін) та мукополісахариди. Ці біологічно активні речовини мають протизапальну, антибактеріальну, імуномодулюючу, ранозагоювальну і антиоксидантну дію. Протизапальний ефект квіток ромашки базується, в першу чергу, на здатності біологічно активних компонентів інгібувати ферменти циклооксигеназу та ліпооксигеназу, внаслідок чого знижується продукція простагландинів та лейкотрієнів і зменшується активність запального процесу.
Трава хвоща польового містить кремнієву кислоту і флавоноглікозиди, похідні кверцетину. Завдяки цим з'єднанням трава плюща польового має протизапальну, противірусну та імуномодулюючу дію.
Листя горіха і кора дуба містять флавоноїди, еллагову та галлову кислоти, яким властива протизапальна та противірусна активність. Крім того, активні компоненти листя горіха і кора дуба мають дублячий і ранозагоювальний ефект.
Ефірна олія трави деревію має антимікробну та протизапальну активність. До складу ефірної олії входять полісахариди, алкаміди, апігенін, азулен та дегідродезацетилматрикарин.
Трава кульбаби містить ряд біологічно активних компонентів (у тому числі тритерпени, глікозиди апігеніну і лютеоліну), які мають імуномодулюючу і протизапальну дію, що здійснюється за рахунок підвищення проліферації лімфоцитів.
Імупрет відноситься до групи високоефективних засобів, здатних стимулювати неспецифічні фактори захисту: підвищення фагоцитарної активності макрофагів і гранулоцитів, елімінацію мікроорганізмів. Використання препарату Імупрет при загостренні хронічного риносинуїту сприяє зниженню вираженості больових відчуттів, набряку слизової оболонки приносових пазух, має місцеву обволікаючу дію, що перешкоджає подразненню слизової дихальних шляхів.
За результатами численних досліджень показано, що застосування препарату Імупрет сприяє підвищенню противірусного імунітету у хворих переважно за рахунок підвищення продукції γ- та α-інтерферону. Тому використання даного препарату сприяє підвищенню імунної толерантності до респіраторних інфекцій і попереджує загострення хронічних інфекційних захворювань дихальних шляхів.
Комбінований препарат Імупрет використовують як профілактичний засіб, що сприяє зниженню частоти первинних гострих риносинуситів та вторинних бактеріальних ускладнень. Профілактика здійснюється за рахунок поліпшення реакції фагоцитозу і активації природних кілерів, підвищення противірусної резистенції за рахунок активації інтерфероногенезу й стимуляції кілерних реакцій та антитілогенезу навіть в умовах імуносупресії.
Отже, Імупрет є високоефективним та безпечним лікарським засобом з основною імуномодулюючою дією при профілактиці та лікуванні риносинуситів завдяки його терапевтичному впливу на різні ланки патологічного процесу при комплексному лікуванні чи монотерапії.
Імупрет приймається в таблетках і краплях (2 драже або 25 крапель 5-6 разів на день протягом 6-ти тижнів). Препарат приймають перорально, незалежно від прийому їжі. Тривалість курсу лікування при гострих запальних захворюваннях верхніх дихальних шляхів становить не менше 1 тижня. Тривалість курсу лікування при хронічних запальних захворюваннях верхніх дихальних шляхів становить не менше 6 тижнів.
Для профілактики гострих респіраторних риносинуситів Імупрет призначають 5-6 разів на день перші 3-4 дні, потім 3 рази на добу протягом місяця.
Проте коли медикаментозна терапія неефективна, або процес набуває характеру частих (більше 2-3-х разів на рік) загострень, ставиться питання про хірургічне лікування хронічного риносинуїту.
Синдромно орієнтована оториноларингологія у загальній лікарській практиці. Діагностика та раціональна фармакотерапія Д.м.н., професор Попович В.І.
Запрошуємо переглянути запис прямого ефіру на тему "Запалення як мета комплексної терапії хронічних захворювань верхніх дихальних шляхів"
Науково-практичний кейс-марафон SHDM.SCHOOL
SHDM.FORUM'24: головна подія року!
Розповсюдженість алергічного риніту. Клінічні рекомендації EPOS-2020 та ARIA-2019. ARIA-2019 та EPOS-2020: лікування. Ступені тяжкості перебігу АР. Принцип ступеневого підходу до лікування АР. ARIA-2019 та EPOS-2020: основні проблеми.
Інформація, опублікована на даному сайті, орієнтована на загальне ознайомлення та жодним чином не може бути використана в якості медичних, практичних або комерційних рекомендацій. У зв’язку з цим, Сайт «Школи доказової медицини» не несе жодної відповідальності за негативні наслідки, отримані через використання матеріалів, викладених на даному сайті. Документація з фармацевтичних продуктів не є рекламою та не призначена для того, щоб використовувати її замість консультації з кваліфікованими фахівцями в галузі медицини та інших галузях. Документація з фармацевтичних продуктів надається за вашою згодою відповідно до вимог ч.ч. 1, 2 ст. 15 Закону України «Про захист прав споживачів» від 12.05.1991 р. № 1023-XII. Якщо вам потрібна консультація з конкретного питання, пов’язаного зі здоров’ям, необхідно звернутися до фахівців- професіоналів.
Продовжуючи своє перебування на сайті, ви підтверджуєте свою згоду на дистанційне отримання інформації про лікарські та косметичні засоби (включаючи інформацію про рецептурні лікарські засоби) на підставі вимог ч.ч. 1, 2 ст. 15 Закону України «Про захист прав споживачів» від 12.05.1991 р. № 1023-XII.
Уся інформація, яка міститься на даному сайті, подана з освітньою метою виключно для медичних та фармацевтичних працівників і не замінює консультації лікаря.

