Райнер Юнд, Мартін Мондіглер, Хольгер Штаммер, Понтус Стієрна, Клаус Бахерт,
Відділення оториноларингології, шпиталь Гентського університету (Гент, Бельгія)
Резюме: Висновок: Щоденний прийом 480 мг речовини BNO 1016 протягом 15 днів є ефективним лікуванням гострого вірусного риносинуситу.
Мета роботи: Аналіз узагальнених даних щодо ефективності, отриманих у ході двох подібних рандомізованих плацебо-контрольованих клінічних досліджень. Безпеку препарату оцінювали на основі індивідуальної оцінки пацієнтів.
Методи: Ефективність оцінювали у 589 пацієнтів. Лікування проводили шляхом орального прийому 3×160 мг BNO 1016 (n=294) або 3× плацебо (n=295) протягом 15 днів. У ході обох досліджень пацієнти пройшли п'ять візитів у дослідницькі центри. Симптоми оцінювали відповідно до Європейських рекомендацій щодо риносинуситу та назального поліпозу 2012 року (EPOS 2012). Ультрасонографію використовували для підтвердження діагнозу на початку лікування та ремісії симптомів під час останнього візиту. Ефективність оцінювалася дослідником у вигляді середнього значення за шкалою виразності основного симптому (MSS) наприкінці лікування (візит 5, 14 день). Пацієнти повідомляли про симптоми та соціальні/емоційні наслідки риносинуситу, користуючись німецькою адаптованою версією спеціальної анкети шкали якості життя, обумовленого станом здоров'я, що складається з 20 питань (SNOT-20, Sino-Nasal Outcomes Test, German Adapted Version).
Результати: За період лікування значення MSS покращилися в середньому на 10,02±1,61 бала до 2,47±2,55 для BNO 1016 та на 9,87±1,52 бала до 3,63±3,63 для плацебо . Відмінності між групами лікування наприкінці терапії (1,16 ± 3,14 бала; p<0,0001) та якість життя за оцінками пацієнтів (p = 0,0015) були статистично значущими на користь BNO 1016.
Ключові слова: сухий екстракт, шкала виразності основного симптому, MSS, SNOT-20, EPOS 2012, ультрасонографія.
Гострий риніт є першою стадією розвитку риносинуситу. Грань між гострим та хронічним риносинуситом, в основному, визначається тривалістю захворювання, а не специфічними симптомами. Згідно з визначеннями EPOS 2012, гострий риносинусит повністю виліковується, без залишкових симптомів, через 12 тижнів, тоді як при хронічному риносинусіті після цього періоду один або кілька симптомів залишаються. Гострий вірусний риносинусит триває менше 10 днів, а гострий пост-вірусний риносинусит понад 10 днів. В останньому випадку часто можна бачити картину двофазного симптому із збереженням або погіршенням симптомів до кінця 10-денного періоду.
Основною причиною ОРС є, головним чином, ряд вірусів (риновіруси, віруси парагрипу-1 та -2, коронавірус та віруси грипу), всі вони підвищують концентрацію прозапальних цитокінів та нейтрофілів [2]. Подібний тип реакції зустрічається при бактеріальній інфекції. Таким чином, ОРС легко можна помилково діагностувати як бактеріальну інфекцію і, отже, лікувати антибіотиками, які на цій стадії хвороби не сприяють лікуванню. ОРС є найпоширенішим інфекційним захворюванням і має величезний соціально-економічний вплив на суспільство, крім індивідуального дискомфорту зі зниженою якістю життя [3]. Стратегією лікування є зниження тяжкості симптомів, мінімізація тривалості захворювання та запобігання ускладненням, а також подальшого розвитку на хронічну хворобу.
Останніми роками запропоновано новий спосіб лікування ГРС – фітотерапевтичний препарат [4-6]. BNO 1016 (Біонорика SE, Ноймаркт, Німеччина) є новим препаратом на основі сухого екстракту фіксованої комбінації п'яти рослинних екстрактів, що містить корінь тирличу (Gentianae radix), квіток первоцвіту (Primula flos), трави щавлю (Rumicis herba), квітки Flos) та трави вербени (Verbenae herba) у співвідношенні 1:3:3:3:3. Препарат є стандартним високодозованим продуктом для лікування ОРС. Фармакологічні дослідження показали, in vitro і на тваринних моделях, що BNO 1016 має протимікробні та противірусні ефекти, включаючи секретолітичну та протизапальну активності [6]. Попередня фаза 2b/3 дослідження документально зафіксувала позитивну ефективність та безпеку BNO 1016 при добовій дозі 160 мг (прийом тричі на день) протягом 15 днів [7], Це було підтверджено у наступній підтверджуючій фазі 3 дослідження [8].
Щоб підтвердити спостеріганий ефект лікування для більшої популяції пацієнтів, під час цієї оцінки були об'єднані дані фази 2b/3 (код ARhiSi-1) та фази 3 (код ARhiSi-2). Для аналізу використовували дані 589 пацієнтів, у яких порівнювали ефективність 480 мг BNO 1016 на день (3х160 мг) з плацебо при лікуванні ГРС.
Для вивчення об'єднаних даних застосовували критерії включення до дослідження ARhiSi-2. Для аналізу залучали дорослих амбулаторних пацієнтів обох статей віком ≥ 18 та ≤ 75 років з клінічним діагнозом ГРС (МКХ-10: J01.9), підтвердженим УЗД, верхньощелепними пазухами для всіх пацієнтів. ОРС був визначений раптовою появою принаймні трьох основних симптомів (нежить/виділення з передніх відділів носа, стікання слизу по задній стінці глотки, закладеність носа, головний біль, лицьовий біль/відчуття тяжкості). Для включення в дослідження симптоми мали тривати протягом 3 днів або менше. Усі включені пацієнти повинні були мати перевірене дослідником значення MSS ≥ 8 та ≤ 12 балів (з максимальних 15 балів). Крім того, має бути закладеність носа та легкий-помірний лицевий біль/відчуття тяжкості (≥ 1 та ≤ 2 бали). Наявність лицьового болю знизили до помірного, щоб обмежити включення пацієнтів лише з неускладненим ГРС.
Були виключені пацієнти, яких лікували кортикостероїдами або антибіотиками (локально або систематично) протягом 4 тижнів перед першим візитом до дослідника (візит включення). Крім того, не включали людей, які приймали ліки від звичайних симптомів застуди, імуномодулюючі препарати (за 7 днів до включення), вагітних або жінок, що годують груддю, і людей з тяжкими захворюваннями нирок або печінки, тяжкими соматичними або нейрологічними, та/або психіатричними захворюваннями.
Аналіз базується на двох однакових проспективних рандомізованих, подвійних сліпих, плацебо-контрольованих, мультицентрових дослідженнях із паралельними групами, проведених у 2009-2010 рр. у 37 центрах (16 спеціалістів з оториноларингології, 21 спеціаліст з внутрішніх хвороб та лікарі загального профілю) по всій Німеччині. При 1-му візиті на день 0 до дослідження включили амбулаторних пацієнтів, які страждають на ГРС, рандомізували на групи і забезпечили письмовою згодою. Пацієнти приймали 3 х 160 мг BNO 1016 або 3 плацебо протягом 15 днів. Розподіл лікування у обох дослідженнях провели у співвідношенні 1:1. Ні учасники, ні дослідник не знали, який препарат дають, проводячи лікування подвійним сліпим способом.
У ході лікування пацієнти фіксували свої симптоми щоденно. При кожному візиті в центр дослідження (дні 3, 7, 10 і 14; візити 2, 3, 4, і 5, відповідно) дослідник оцінював п'ять симптомів MSS і відповідь на лікування. Крім того, під час візитів пацієнти заповнювали анкету шкали якості життя, зумовленого станом здоров'я (SNOT-20 GAV) [9].
УЗД приносових пазух проводили в ході обох досліджень при першому візиті, щоб підтвердити діагноз. УЗД наприкінці лікування (візит 5) проводили лише за другому дослідженні.
Дослідження були схвалені німецьким регуляторним органом та отримали позитивний висновок від Комітету з Етики; структура досліджень відповідає Гельсінській Декларації та узгодженому тристоронньому керівництву з Належної Клінічної Практики (CPMP/ICH/135/95).
Критерії ефективності. Усі аналізи ефективності базуються на об'єднаних даних досліджень ARhiSi-1 та ARhiSi-2, див. розділ Статистичний аналіз.
Первинною кінцевою точкою аналізованої сукупності було середнє значення MSS при візиті 5 (день 14, населення для повного аналізу - FAS, і протокольна популяція - PP). Крім того, аналізували поодинокі симптоми за шкалою MSS при візиті 5, 14 день (FAS і PP). Більш того, для FAS та PP провели аналіз анкети SNOT-20 як загальної суми показників при 3 (день 7) і при візиті 5 (день 14). Додатково дослідник класифікував (FAS та PP) пацієнтів з лікувальним ефектом за 4-бальною оцінною шкалою при візиті 2 (день 3), візит 3 (день 7), візит 4 (день 10) та візит 5 (день 14).
Оцінка тяжкості симптомів. Дослідники оцінювали тяжкість кожного з п'яти симптомів MSS при кожному візиті, використовуючи 4-бальну оцінну шкалу тяжкості, що підвищується (0 = ні/не присутній, 1 - незначний, 2 - помірний, 3 - важкий). Параметри болю та стікання слизу по задній стінці глотки оцінювали відповідно до описів пацієнтів.
Шкала виразності основного симптому (MSS). MSS поєднує п'ять найбільш важливих симптомів риносинуситу, заснованих на експертних клінічних рекомендаціях (нежить/виділення з передніх відділів носа, стікання слизу по задній стінці глотки, закладеність носа, головний біль, лицьовий біль/відчуття тяжкості), цю шкалу використовували як основний у кількох клінічних випробуваннях [10-12]. Значення MSS розраховували як суму п'яти оцінок кожного із симптомів.
Оцінка пацієнтів із лікувальним ефектом та без лікувального ефекту. Дослідник оцінював загальну відповідь на лікування при кожному візиті, використовуючи 4-бальну оцінкову шкалу (0 – симптоми зникли/вилікувані; 1 – симптоми полегшені порівняно з візитом 1; 2 – симптоми не змінилися порівняно з візитом 1,3 – симптоми погіршилися за порівняно з візитом 1). Пацієнтів, яких вилікували, або повідомили, що їхні симптоми полегшені (оцінка 0 балів та 1 бал) класифікували як пацієнтів із лікувальним ефектом, тоді як пацієнтів із незміненими або погіршеними симптомами (оцінка 2 та 3 бали) вважали пацієнтами без лікувального ефекту.
Загальне визначення популяції. У комбінований аналіз були включені лише групи лікування 'плацебо' та 'BNO 1016 480 мг' з випробування ARhiSi-1: коли для такого аналізу застосували критерії включення та виключення в ARhiSi-2, пацієнти, при включенні в ARhiSi-1, з лицьовим болем /тяжкістю > 2 або значенням MSS > 12 або MSS < 8, були виключені з сукупностей, що підлягають аналізу, оскільки це було порушенням критерію включення в ARhiSi-2. Розподіл пацієнтів за різними сукупностями проведено відповідно до правил 'Зустріч для Розгляду Даних Сліпого Методу' відповідних досліджень ARhiSi-1 та ARhiSi-2.
Сукупності даних, що підлягають аналізу, та поводження з пропущеними даними.
Аналізи ефективності проводили в основному на FAS, яка включає дані для всіх рандомізованих пацієнтів з гострим риносинуситом, які отримали як мінімум одну дозу препарату (використовуваного в дослідженні) і, як мінімум, одну оцінку ефективності. PP включає всіх рандомізованих пацієнтів з FAS, за винятком тих, хто мав великі протокольні порушення. Для оцінки безпеки об'єднання даних не проводили. Натомість для опису результатів безпеки використовували вибірку кожного дослідження, що підлягає оцінці безпеки (SEP).
Тут вихідні дані були використані для введення відсутніх значень у разі раннього відсіву пацієнтів через недостатню ефективність аналізу на FAS. Як правило, за відсутності значень у разі одужання пацієнтів та припинення їхньої участі в дослідженні, останнє документоване значення кожної кінцевої точки ефективності використовували для введення відповідних 'зниклих' значень по всіх наступних візитах, які не були виконані (Метод Перенесення Даних Остання Спостереження Вперед, LOCF ).
Якщо пацієнт вибув із дослідження з причин, пов'язаних із досліджуваним препаратом, наприклад, несподіване погіршення симптомів захворювання/стану під час дослідження або недостатня ефективність, дослідник використав найгіршу категорію для глобальної оцінки ефективності.
У разі відсутності значення для розрахунку симптому за шкалою SNOT-20 використовували найгіршу категорію, якщо пропущено не більше двох значень, інакше значення не враховувалося.
Усі дані аналізували за допомогою комп'ютерної програми Система Статистичного Аналізу (SAS), версія 9. Оскільки більшість статистичних тестів були односторонніми, значення p≤0,025 вказують на статистичний рівень значущості.
Якщо не вказано інше, відхилення є стандартною помилкою середнього значення (SEM).
Усі аналізи ефективності проведено із сукупністю об'єднаних даних (див. розділ Статистичні аналізи). При аналізі об'єднаних даних первинну кінцеву точку дослідження ARhiSi-2 оцінювали за допомогою коваріаційного аналізу (ANCOVA).
Різниця один бал значення MSS між групами лікування вважалася (за аналогією з ARiSi-2) клінічно значущою.
Усі вторинні кінцеві точки були проаналізовані як експерименту. Категоріальні змінні тестували за допомогою хі-квадрату. Безперервні дані аналізували за допомогою тесту ANCOVA аналогічно первинної кінцевої точки або за допомогою критерію Кохрана-Мантелі-Гензеля. Вихідні значення порівнювали між групами лікування та перевіряли за допомогою тесту Манна-Уітні-Вілкоксону (безперервні змінні) або тесту хі-квадрат (категоріальний тест).
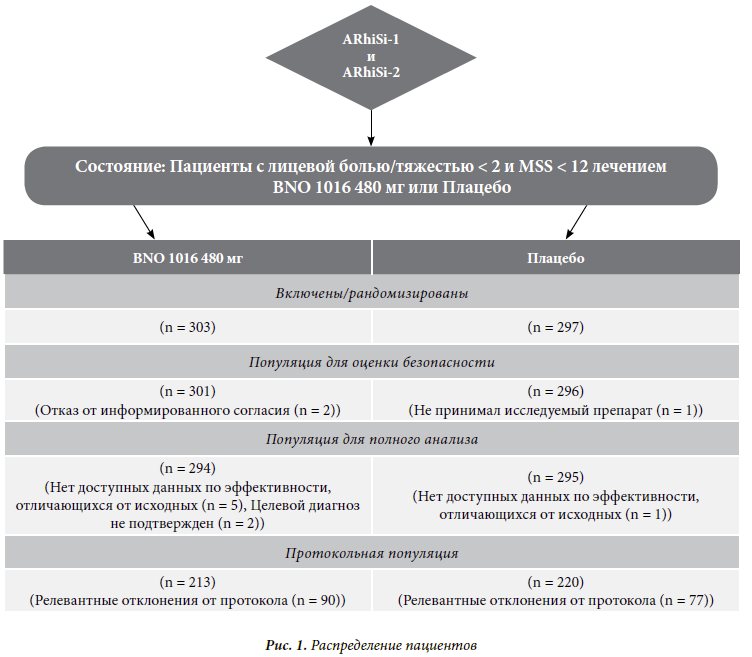
Розподіл пацієнтів показано на рис. 1. Загалом 303 пацієнти склали групу лікування BNO 1016, для групи плацебо виділено 297 пацієнтів (у сукупності об'єднаних даних). Крім того, 589 з цих 600 рандомізованих пацієнтів були розглянуті в межах FAS, 294 пацієнти у групі BNO 1016 (97%) та 295 пацієнтів у групі плацебо (98,2%).
Критеріями для включення до PP відповідали 213 (70.3%) пацієнтів у групі BNO 1016 та 220 (74.1%) пацієнтів у групі плацебо.
Тривалість дослідження та дотримання режиму лікування. Середня тривалість участі у дослідженні склала 29 днів для обох груп, з діапазоном 3-57 днів для групи BNO 1016 та 3-86 днів для групи плацебо. Відсоток дотримання режиму лікування, судячи з підрахунку таблеток, становив 99,7% у групі BNO 1016 та 100,2% у групі плацебо.
Шкала виразності основного симптому (MSS). Вихідні дані (середнє значення MSS) при включенні не мали статистичних відмінностей між двома групами лікування (таблиця I). Значення MSS поступово покращувалося в обох групах протягом 15-денного періоду лікування в середньому на 10,02±1,61 до 2,47±2,55 для BNO 1016 та 9,87±1,52 до 3,63±3, 63 у групі плацебо (таблиця I, рис 2). Різниця між групами лікування під час візиту 5 була статистично значущою на користь продукту BNO 1016 (FAS, p<0,0001).
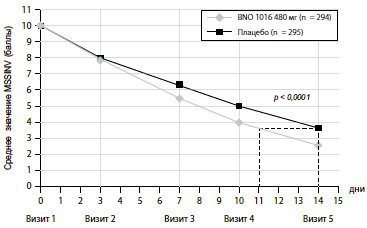
Рис. 2. ARhiSi-комбінований аналіз ARhiSi-1 та ARhiSi-2: середнє значення MSSINV ± 1,96
* – Стандартна помилка середнього значення з дня 0 до дня 14 (FAS, населення для повного аналізу, n = 589). MSS – шкала виразності основного симптому
| Значення MSS під час візиту | FAS | PP | |||
|---|---|---|---|---|---|
| BNO1016 480 мг (n = 294) |
Плацебо (n = 295) |
BNO1016 480 мг (n = 213) |
Плацебо (n = 220) |
||
| Візит 1 (день 0) | Середнє (SD) | 10.02 (1.61) | 9.87 (1.52) | 9.70 (1.28) | 9.65 (1.27) |
| Візит 2 (день 3) | Середнє (SD) | 7.71 (2.40) | 7.86 (2.71) | 7.50 (2.11) | 7.78 (2.53) |
| Візит 3 (день 7) | Середнє (SD) | 5.54 (2.74) | 6.15 (3.13) | 5.15 (2.45) | 6.14 (3.06) |
| Візит 4 (день 10) | Середнє (SD) | 4.11 (2.66) | 5.05 (3.44) | 3.77 (2.32) | 4.93 (3.42) |
| Візит 5 (день 14) | Середнє (SD) | 2.47 (2.55) | 3.63 (3.63) | 2.06 (2.31) | 3.76 (3.76) |
| Різниця [плацебо – BNO1016 480 мг] (SD) | p < 0.0001 1.17 (3.14) |
p < 0.0001 1.70 (3.13) |
|||
Очевидна різниця у значеннях MSS між двома групами вже була явною при візиті 4 (день 10), що вказує на швидше відновлення в групі BNO 1016, показуючи різницю в 0,94 бала, з середніми значеннями 4.11 проти 5.05. При візиті 5 (день 14) значення були 2,47±2,55 (BNO 1016) та 3,63±3,63 (плацебо), відповідно – різниця у 1,16±3,14 бала. Переводячи ці цифри в стан досліджуваних, отримуємо майже 3-денне прискорення їх відновлення з BNO 1016 (11 день та 14 день відповідно). Різниця між групами лікування наприкінці терапії при аналізі PP склала 1,70±3,13 бала (р<0,0001). Це означає прискорену на 4 дні нормалізацію стану пацієнтів, які отримували BNO 1016, наприкінці терапії (10 день і 14, відповідно).
У таблиці II показані поодинокі симптоми MSS під час візиту 5 (день 14). У FAS кожен індивідуальний симптом демонструє статистичний рівень значущості на користь BNO 1016 (p<0.0001).
| Одиночний симптом MSS під час візиту 5 (день 14) | FAS, середня (SD) | PP, середня (SD) | ||
|---|---|---|---|---|
| BNO1016 480 мг (n = 294) |
Плацебо (n = 295) |
BNO1016 480 мг (n = 213) |
Плацебо (n = 220) |
|
| Нежить | 0,62 (0,65) p*+ < 0,0001 |
0,86 (0,82) | 0,56 (0,63) p*+ < 0,0001 |
0,87 (0,85) |
| Стікання слизу по задній стінці глотки | 0,53 (0,71) p*+ < 0,0001 |
0,79 (0,85) | 0,43 (0,65) p*+ < 0,0001 |
0,80 (0,87) |
| Закладеність носу | 0,71 (0,80) p*+ = 0,0028 |
0,91 (0,95) | 0,61 (0,75) p*+ = 0,0001 |
0,93 (0,95) |
| Головний біль | 0,31 (0,62) p*+ < 0,0001 |
0,57 (0,85) | 0,23 (0,55) p*+ < 0,0001 |
0,61 (0,88) |
| Лицьовий біль | 0,31 (0,64) p*+ < 0,0003 |
0,51 (0,82) | 0,23 (0,58) p*+ < 0,0001 |
0,56 (0,87) |
* – Односторонній; α = 0.025. † – ANCOVA. FAS – популяція для повного аналізу; PP – протокольна популяція; SD – стандартне відхилення.
Відповідь лікування. Абсолютні та відносні результати лікування наведено в таблиці 3. Статистично значуще покращення (і для FAS і для PP) на користь BNO 1016 було видно вже на день 7 (візит 3). На рис. 3 наведено комбінований аналіз ARhiSi-1 та ARhiSi-2: відповідь на (одужання або покращення) на лікування від візиту 2 (день 3) до візиту 5 (день 14).
Вимірювання якості життя. Загальна кількість балів з SNOT-20 наведено в таблиці IV. Наприкінці лікування балу очевидною є високо значуща різниця на користь BNO 1016 (р = 0,0015).
Результати безпеки. Не повідомлялося про серйозні небажані явища (SAEs) під час випробувань ARhiSi-1 або ARhiSi-2. В ході ARhiSi-1 було всього 42 небажані явища (AEs) у 33 пацієнтів з популяції для оцінки безпеки (SEP, n = 450): 33 AEs у 26 з 300 пацієнтів (8,7%) при лікуванні BNO 1016 (2 групи лікування BNO 1016 у добовій дозі 240 мг або 480 мг) та 9 AEs у 7 із 150 пацієнтів (4,7%) при лікуванні плацебо.
| FAS, среднє (SD) | PP, среднее (SD) | |||
|---|---|---|---|---|
| BNO1016 480 мг (n = 288) |
Плацебо (n = 291) |
BNO1016 480 мг (n = 213) |
Плацебо (n = 218) |
|
| Візит 1 (день 0), візит до включення | 41,24 (13,32) | 41,24 (13,52) | 40,87 (12,22) | 40,06 (12,15) |
| Візит 3 (день 7) | 24,55 (14,71) | 27,00 (15,11)++ | 23,09 (13,66) | 26,84 (14,67) |
| Візит 5 (день 14) | 12,49 (13,78) | 16,41 (16,43) | 10,47 (12,10) | 16,11 (15,99) |
| p value*+ | p = 0,0015 | p = 0,0001 | ||
* - Односторонній; α = 0.05. † – Повторні вимірювання – ANCOVA. ++ - Два розрахунки по SNOT-20 не були оцінені; FAS – популяція для повного аналізу; PP – протокольна популяція
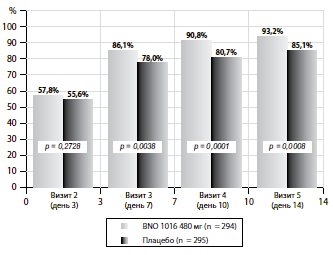
Рис. 3. ARhiSi комбінований аналіз ARhiSi-1 та ARhiSi-2: твет (одужання або покращення) на лікування від візиту 2 (день 3) до візиту 5 (день 14) (FAS, популяція для повного аналізу, n = 589))
| Відповідь на лікування | FAS | PP | ||
|---|---|---|---|---|
| BNO1016 480 мг (n = 294) |
Плацебо (n = 295) |
BNO1016 480 мг (n = 213) |
Плацебо (n = 220) |
|
| Візит 2 (день 3) | 57,8% p*+ = 0,5455 |
55,6% | 60,6% p*+ = 0,3243 |
55,9% |
| Візит 3 (день 7) | 86,1% p*+ = 0,0076 |
78,0% | 89,7% p*+ = 0,0002 |
76,4 |
| Візит 4 (день 10) | 90,8% p*+ = 0,0002 |
80,7% | 95,8% p*+ < 0,0001 |
80,5% |
| Візит 5 (день 14) | 93,2% p*+ = 0,0016 |
85,1% | 94,8% p*+ = 0,0002 |
83,6% |
* – Двосторонній; α = 0.05. † – Тест Кохрана-Мантеля-Гензеля. FAS – населення для повного аналізу; PP – протокольна популяція
При дослідженні ARhiSi-2 було всього 53 не бажаних реакцій у 46 пацієнтів з усіх пацієнтів (n = 385): 21 не бажаних реакцій у 19 з 194 пацієнтів (9,8%), які отримували лікування BNO 1016 480 мг і 32 не бажаних реакцій у 27 із 191 пацієнтів (14,1 %), які отримували лікування плацебо. Повідомлялося, що більшість небажаних реакцій у пацієнтів, яких лікували BNO 1016, мали невелику-помірну інтенсивність.
Даний аналіз свідчить про ефективність 480 мг (3 x 160 мг) рослинного препарату BNO 1016. Ця нова концепція лікування ОРС, яка протікає та закінчується у певний термін, прискорює нормалізацію симптомів порівняно з плацебо та покращує якість життя пацієнтів. Аналіз PP перевершував результати FAS протягом усього дослідження.
Досі наші знання про корисні ефекти рослинних лікарських засобів при лікуванні ГРС були обмеженими. Фармакологічні дослідження BNO 1011* показали його противірусну активність [13], а також стимуляцію частоти биття вій респіраторного епітелію in vitro шляхом активації форсколін-стимульованої секреції хлориду [14]. BNO 1011 – це сухий екстракт без допоміжних речовин, тоді як BNO 1016 ці допоміжні речовини додають, щоб з цього сухого екстракту можна було пресувати таблетки.
Нещодавно опубліковано огляд клінічних властивостей BNO 101 (Синупрет) (препарат з тими самими компонентами, що й BNO 1016, але в нижчій дозі), який при лікуванні демонструє сприятливий ефект [15]. Цей рослинний лікарський засіб має суттєвий протизапальний ефект, знижуючи експресію циклооксигенази (COX)-2 та утворення простагландину (PG) E(2) [16]. Таким чином, механізм дії препарату виправдовує своє терапевтичне застосування при лікуванні синуситу та інших вірусних/мікробних респіраторних інфекцій, пов'язаних із запаленням. Експериментальні дослідження синупрету показують зниження зростання бактерій лише після 4-денного прийому [6]. Інші рослинні препарати, хімічний склад яких менш відомий, мабуть, також мають деякий протизапальний ефект, наприклад при хронічному синуситі [17].
Хоча інтраназальні кортикостероїди (застосовувані окремо або у комбінації з антибіотиками), загалом, рекомендовані для лікування ГРС, необхідне подальше документальне обґрунтування їх клінічного застосування [18]. Недавній мета-аналіз ефективності кортикостероїду мометазону для лікування ГРС показав, що у 10 (кількість, необхідна для лікування) з 11 пацієнтів симптоми були полегшені або усунені [19]. Для BNO 1016 було розраховано (для об'єднаного набору даних) кількість препарату, необхідне лікування 10 пацієнтів. Таким чином, рослинний препарат BNO 1016, також корисний, як деякі кортикостероїди, що локально застосовуються для лікування ОРС.
Використання MSS у нашому аналізі проведено відповідно до рекомендацій EPOS 2012, які поєднують п'ять найбільш релевантних ознак ОРС та часто використовуються як стандарт для первинних критеріїв ефективності у клінічних дослідженнях [1]. Крім того, УЗД підтвердило лікувальний ефект [8]. Наш аналіз та дослідження ARhiSi-2 з клінічної ефективності BNO 1016 [8] були першими строго контрольованими дослідженнями (для оцінки ефекту комбінованого рослинного препарату з фіксованою дозою), що відповідають усім сучасним стандартам якості для проспективного, подвійного сліпого, рандомізованого, плацебо-контролю.
Золотого стандарту лікування ГРС не існує Для лікування неускладненого ГРС антибіотики не показані. Через велику кількість різних вірусів, що викликають ОРС, виробництво ефективної вакцини утруднене. Соціально-економічні витрати цього захворювання надзвичайно високі, потрібні значні ресурси охорони здоров'я, і це призводить до втрати продуктивності [3]. У середньому, кожен дорослий схильний до захворювань верхніх дихальних шляхів від двох до п'яти разів на рік. З цієї точки зору, кожен спосіб лікування, який скорочує тривалість хвороби та покращує якість життя окремих пацієнтів, вигідний як для суспільства, так і для кожної людини.
Оскільки кількість не побічних та несприятливих явищ при лікуванні BNO 1016, а також частота та інтенсивність небажаних явищ однакові для BNO 1016 та плацебо, можна зробити висновок, що BNO 1016 має аналогічний з плацебо профіль безпеки. Відповідно, BNO 1016 має сприятливе співвідношення користь/ризик.
Насамкінець, даний аналіз підтверджує результати підтверджуючої фази 3 випробування з препаратом BNO 1016. Аналіз показав, що щоденний прийом 480 мг BNO 1016 протягом 2 тижнів є безпечним та ефективним методом лікування при неускладнених ГРС. Препарат забезпечує швидку та клінічно значущу ремісію симптомів та покращує якість життя порівняно з плацебо.
Acta Otolaryngol Dawnloaded from informahealthcare.com by 62.157.87.154 on 04/08/15
Запрошуємо переглянути запис прямого ефіру на тему "Закладеність носа"
Необґрунтований антибіотик при риносинуситі. Як запобігти?
Алергічний риніт у дітей. Проблема, що не дає дитині нормально розвиватись
Лідерська програма для лікарів MEDFUTURE
Розповсюдженість алергічного риніту. Клінічні рекомендації EPOS-2020 та ARIA-2019. ARIA-2019 та EPOS-2020: лікування. Ступені тяжкості перебігу АР. Принцип ступеневого підходу до лікування АР. ARIA-2019 та EPOS-2020: основні проблеми.
Інформація, опублікована на даному сайті, орієнтована на загальне ознайомлення та жодним чином не може бути використана в якості медичних, практичних або комерційних рекомендацій. У зв’язку з цим, Сайт «Школи доказової медицини» не несе жодної відповідальності за негативні наслідки, отримані через використання матеріалів, викладених на даному сайті. Документація з фармацевтичних продуктів не є рекламою та не призначена для того, щоб використовувати її замість консультації з кваліфікованими фахівцями в галузі медицини та інших галузях. Документація з фармацевтичних продуктів надається за вашою згодою відповідно до вимог ч.ч. 1, 2 ст. 15 Закону України «Про захист прав споживачів» від 12.05.1991 р. № 1023-XII. Якщо вам потрібна консультація з конкретного питання, пов’язаного зі здоров’ям, необхідно звернутися до фахівців- професіоналів.
Продовжуючи своє перебування на сайті, ви підтверджуєте свою згоду на дистанційне отримання інформації про лікарські та косметичні засоби (включаючи інформацію про рецептурні лікарські засоби) на підставі вимог ч.ч. 1, 2 ст. 15 Закону України «Про захист прав споживачів» від 12.05.1991 р. № 1023-XII.
Уся інформація, яка міститься на даному сайті, подана з освітньою метою виключно для медичних та фармацевтичних працівників і не замінює консультації лікаря.

