Сучасні погляди на патофізіологію алергічного риніту
Попович В.І.1, Вільчинська Т.2, Кошель І.В.1
1 Івано-Франківський національний медичний університет, Івано-Франківськ, Україна
2 Університет Шеффілд Галлам, Шеффілд, Великобританія
Popovich V.1, Wilczyńska T.2, Coshel I.1
1 National Medical University of Ivano-Frankivsk, Ivano-Frankivsk, Ukraine
2 Sheffield Hallam University, Sheffield, United Kingdom
Алергічний риніт (АР) – інтермітує або персистуюче запалення слизової оболонки верхніх дихальних шляхів, що характеризується закладеністю носа, наявністю відокремлюваного, свербінням, чханням (можливе поєднання кількох симптомів). Захворювання може бути визначене як алергічний риносинусит (алергічна риносинусопатія), в основі якого лежить IgE-залежна реакція. Фактично це «ведмежа послуга» імунної системи у вигляді негативної реакції організму на будь-яку, в принципі, нешкідливу речовину. Важливо відзначити, що ця речовина є алергеном тільки для людей, хворих на алергію, які мають підвищену чутливість, а у нормальних індивідуумів той же алерген не викликає хворобливих проявів. АР характеризується широкою поширеністю: від 10 до 35% дорослого населення та до 40% дітей страждають від симптомів алергії. За прогнозами фахівців до 2050 року кожен другий житель Землі страждатиме від алергії. Захворювання, як правило, починається з легких симптомів, але має тенденцію до обтяження клінічних проявів та формування цілого ряду коморбідних захворювань та ускладнень. Захворювання бронхолегеневого апарату, шкіри в осіб з алергією зустрічаються в 2-2,5 рази частіше. Досі до кінця не з'ясовано механізми виникнення та прогресування цього захворювання. Складна взаємодія між різними медіаторами, гістаміном, цитокінами, хемокінами, нейропептидами, адгезійними молекулами та різними типами клітин зумовлює наявність безлічі клініко-патогенетичних варіантів перебігу та формування коморбідних захворювань, що істотно впливають на «якість життя» пацієнтів. Захворювання істотно впливає когнітивні функції: пам'ять, увагу, мислення. Понад 70% пацієнтів відзначають вплив АР на професійну діяльність та зниження здатності до навчання та близько 90% відзначають вплив АР на якість життя.
Перша фаза захворювання характеризується негайною IgE-опосередкованою відповіддю опасистих клітин, проявляється гістамін-опосередкованими ефектами; друга, пізня фаза - постійним алергічним запаленням. Розуміння основних патофізіологічних механізмів алергічного риніту є запорукою ефективності терапії та розробки нових схем впливу на причини та патогенез захворювання. У статті розглянуто ключові моменти сучасних поглядів на патофізіологію алергічного риніту.
Ключові слова: алергічний риніт, патофізіологія, патогенез.
Allergic rhinitis (AR) is intermittent or persistent inflammation of upper respiratory ways mucosa. The most prominent symptoms of AR are sore nose, presence of discharge, itching, sneezing, which can manifest separately or in combination. This disorder may be defined as allergic rhinosinusitis (allergic rhinosinusopathy) induced by Ig E based allergic reaction. In fact it represents a “help” of immune system rendered as negative reaction of human body to any substance which is not harmful in principle. It is important that this substance acts as allergen only for those who have increased sensitivity to it. Individuals with normal sensitivity do not have any symptoms. AR prevalence rates are rather high: 10–35% of adult population and 40% of children have symptoms of allergy. By 2050, per experts’ estimate, each second inhabitant of the Earth will experience allergy symptoms. Allergic rhinitis manifests with light symptoms but as a rule has a tendency to more severe course of disease leading to a series of different complications. Individuals with allergy experience bronchorespiratory and skin diseases twice more than healthy individuals.
The exact mechanisms what induces and leads to further disease progress remain unknown. Complex connections between different mediators, hystamine, cytokines, chemokines and neuropeptides, adhesion molecules and different cell types serve the reason for existence of a variety of clinical/pathogenetic disease types and comorbidities affecting the patient quality of life. The disorder significantly affects cognitive functions: memory, concentration, thinking abilities. More than 70% patients admit its negative effects on professional life and reduced ability to study. Near 90% patients consider its negative impact on quality of life.
First stage of disease is characterized by immediate IgE-mediated mast cells response manifesting as histamin-mediated effects. Second, late stage of disease is characterized by persistent allergic inflammation. The understanding of the basic pathogenic mechanisms of allergic rhinitis ensures effective management and elaboration of new etiology and pathogenesis-based therapy protocols. The current article presents modern approaches to the pathophysiology of allergic rhinitis.
Keywords: allergic rhinitis, pathophysiology, pathogenesis.
Алергічний риніт (АР) – це хронічне запальне захворювання верхніх дихальних шляхів, що суттєво впливає на якість життя пацієнтів, будучи серйозною соціоекономічною проблемою. Розуміння основних імунних механізмів розвитку алергічного риніту є запорукою ефективності терапії та розробки нових схем на причини захворювання. Патофізіологічний механізм розвитку захворювання полягає в IgE-опосередкованій запальній реакції слизової оболонки носа внаслідок стимуляції її алергенами при безпосередньому контакті. У процес імунної відповіді залучено багато клітин та медіаторів запалення.
Перша фаза захворювання характеризується негайною IgE-опосередкованою відповіддю опасистих клітин, друга, пізня, фаза – постійним алергічним запаленням і відповіддю, до якої залучаються еозинофіли, базофіли, Т-клітини, що експресують Th2-цитокіни, включаючи інтерлейкін-4 (IL-4 фактор зростання еозинофілів, фактор "перемикання" для синтезу IgE та IL-5. Сучасні концепції патофізіології захворювання розглядають і такі механізми, як локальний синтез IgE, вплив каскаду реакцій IgE - IgE-рецептори опасистих клітин на алергічну запальну реакцію, епітеліальну експресію цитокінів, що регулює відповідь Т2-цитокінів (тимічний стромальний лімфо3 ). Нижче представлені ключові моменти патофізіології алергічного риніту, глибоке розуміння імунних механізмів яких забезпечує ефективну терапію захворювання.
Після осадження та елюції алергенів у слизовій оболонці носа відбувається їх захоплення антиген-презентуючими клітинами, які презентують їх Т-лімфоцитам. Активовані Т-хелпери вивільняють такі цитокіни, як IL-4 і IL-13, а також взаємодіють з В-лімфоцитами, щоб індукувати синтез алерген-специфічного IgE. Далі відбувається зв'язування алерген-специфічного IgE з високоафінним рецептором до IgE на поверхні опасистих клітин.
Молекула імуноглобуліну складається з важких та легких ланцюгів, що кодуються іншими групами генів. Гени, які кодують утворення легкого ланцюга Ламбда, знаходяться на 22 хромосомі, а гени легкого ланцюга Каппа - на 2-й. Гени, що кодують важкі ланцюги, знаходяться на 14 хромосомі. Спочатку В-лімфоцити продукують антитіла класу IgM. Касета VH(D)JH, що кодує різні послідовності, об'єднується з екзоном Cm, який, у свою чергу, кодує постійні фрагменти IgM після закінчення 5 (prim) місця IgH (локус для важких ланцюгів).
Екзони Cg, Ce та Ca кодують константну область важких ланцюгів імуноглобулінів IgH, IgE та IgA. Під впливом стимуляції цитокінів (IL-4, IL-13) і завдяки безпосередньому контакту з лімфоцитом CD4+ В-лімфоцит може змінити ізотопи імуноглобулінів, що виробляються ним. Такий процес вимагає поділу геному ДНК та його сполуки з елементом VDJ. Цей процес називається рекомбінатною зміною (deletional shwitch recombination). IL-4 та IL-3 стимулюють В-клітини. Відбувається заміна імуноглобуліну IgM на IgE. IL-4 та IL-3 – мультимірні цитокіни, які мають загальний ланцюжок IL-4RI, та їх дії достатньо для зміни синтезу IgM на IgE. Стимуляція рецептора IL-4 ініціюється кіназами JAK1 та JAK3, рецептора IL-13Ralfa – кіназами JAK2 та TYK2. Ці кінази фосфорилують тирозинові фрагменти транскрипційних факторів STAT6. Потім STAT6 поєднується зі специфічними послідовностями (TTCNNN[N]GAA) промоторів на генах, включаючи туди гени, пов'язані із синтезом IgE.
Генетичний чинник грає величезну роль особливостях IgE-опосередкованого імунної відповіді. Ранні та негайні фази відповіді тривають близько 2-3 годин, виникаючи безпосередньо після мінімального контакту з алергеном. Одним із найважливіших критеріїв ранньої фази відповіді є дегрануляція опасистих клітин. У сенсибілізованих пацієнтів в епітеліальному шарі слизової оболонки носа є велика кількість опасистих клітин, які можуть бути легко активовані при повторному впливі алергенів [3]. Після зв'язування специфічного IgE з високоафінним рецептором на поверхні опасистих клітин відбувається їхня дегрануляція з вивільненням різних медіаторів.
Рівень IgE у виділеннях з носа корелює з рівнем залучених у процес дегрануляції еозинофілів. Вважається, що рання алергічна реакція (чхання і рідкі виділення з носа) настає як внаслідок вироблення IgE, так і внаслідок вироблення ECP. Підвищення рівня їх у плазмі крові, що спостерігається при цьому, має вторинний характер. Інтерес представляє той факт, що підвищення рівня IgE та ECP у виділеннях з носа з'являється іноді навіть за кілька днів до очікуваного контакту з алергеном, і навіть за 1-2 тижні до сезону цвітіння та значного збільшення концентрації пилку у повітрі. Рівень ECP зростає вже при концентрації пилкових алергенів 25 частинок на 1 м3, коли симптоми захворювання у пацієнта ще незначні, а при супутньому захворюванні на астму значення ECP ще зростають [1]. Ознаки мінімального персистуючого запалення спостерігаються у таких пацієнтів ще до появи симптомів захворювання.
Незважаючи на підвищення рівня еозинофілів у периферичній крові, одночасного збільшення рівня ECP у виділеннях з носа не спостерігається. Це свідчить про те, що активація еозинофілів відбувається в основному в ділянці, де має місце алергічна реакція (слизова оболонка), а не в периферичній крові. Дослідження рівнів IgE, ЕСР та еозинофілів на початку сезону цвітіння та запилення показали дуже цікаві результати. Під час цвітіння трав відзначалося інтенсивне зростання рівня специфічних IgE, але при цьому рівень загального IgE залишався без змін, що може пояснюватися антиген-специфічною активацією В-лімфоцитів.
Рання фаза відповіді завжди спричиняє пізню фазу, яка виникає через 4-6 годин після антигенної стимуляції. Пізня фаза відповіді характеризується наростанням тих самих симптомів, що спостерігаються і в ранній фазі – виділення з носа та нежить, але головним її симптомом є стійка закладеність носа, що триває близько 18–24 годин.
Пізня фаза відповіді має переважно запальний характер і характеризується інтенсивною міграцією Т-лімфоцитів, базофілів та еозинофілів у осередок запалення. Різні медіатори, що вивільняються цими клітинами, включаючи лейкотрієни, кініни та гістамін, призводять до персистенції симптомів та повного розвитку пізньої фази. Ключовим моментом у її перебігу є вироблення та вивільнення різних цитокінів та хемокінів (IL-4, IL-13) з опасистих клітин та апрегуляція ними експресії адгезійних молекул, таких як судинні молекули клітинної адгезії 1 (VCAM-1), на ендотеліальних клітинах. тим самим процес інфільтрації еозинофілів, Т-лімфоцитів та базофілів у слизовій оболонці носа.
Далі такі хемокіни, як RANTES, еотаксин, MCP-4 і тимус-активований регульований хемокін (TARC), вивільняються з епітеліальних клітин та діють як хемоатрактанти на еозинофіли, базофіли та Т-лімфоцити. Інші цитокіни, що вивільняються клітинами епітелію, IL-5 з гладких клітин, такі як колонієстимулюючий фактор макрофагів та гранулоцитів, і Т-лімфоцити пролонгують процес інфільтрації еозинофілів у слизову оболонку носа. У недавніх дослідженнях було показано, що в пізній фазі імунної відповіді огрядні клітини посилюють його шляхом гістамін/триптаз-індукованої апрегуляції активації GM-CSF в епітеліальних клітинах носа та синергічною дією IL-4/IL-13 та TNF-α, що викликають активацію еотаксину та вироблення TARC в епітеліальних клітинах [5] (рис. 1).
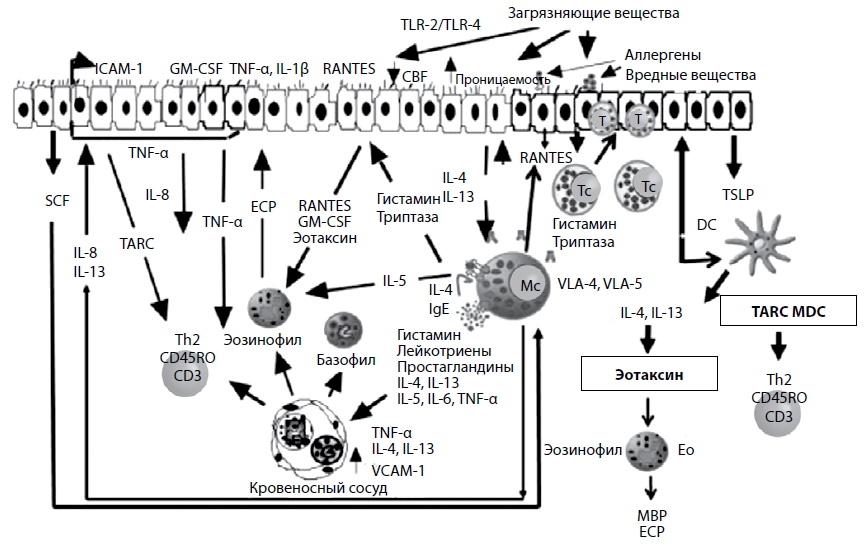
Крім того, інші медіатори, що вивільняються в цій фазі, такі як еозинофільний катіонний білок (ECP), фактор активації тромбоцитів, основний білок позаклітинного матриксу (протеоглікан-2) (МВР) також активно залучаються в пізню фазу відповіді. Гістамін, який є одним з головних медіаторів при АР, стимулює чутливі нервові закінчення V (трійчастого) нерва та викликає чхання, а також посилює секрецію слизу через стимуляцію відповідних залоз. Інші медіатори, лейкотрієни та простагландини, впливаючи на кровоносні судини, викликають закладеність носа [7].
Гладкі клітини. Гладкі клітини грають центральну роль імунному механізмі алергічного риніту. Вони діляться на дві різні фенотипічні субпопуляції на підставі експресованого ними типу нейтральних протеаз. Перший тип – MC (T) – містить лише триптазу, другий – MC (TC) – містить хімази, катепсин G та карбоксипептидази на додаток до триптаз. У пацієнтів з АР в епітелії слизової оболонки носа постійно накопичуються опасисті клітини, переважно з фенотипом MC(T) [5]. Згідно з даними різних дослідників, ключовими субстанціями, що регулюють міграцію опасистих клітин в епітелії носа, є фактор стовбурових клітин (SCF), TGF-β, RANTES [2]. Крім відомих медіаторів, задіяних в активації IgE-залежного механізму при алергічному риніті, огрядні клітини виділяють різні цитокіни, такі як IL-4, IL-5, IL-6, IL-8, IL-10, IL-13 та TNF-α . Крім того, опасисті клітини у пацієнтів з АР демонструють експресію більш високих рівнів антигенів 4 і 5 з дуже пізньою активацією, а екстрацелюлярні матричні взаємодії посилюють секрецію цитокінів з цих клітин [2]. Такий механізм може сприяти підвищенню активації опасистих клітин і, безумовно, посилює назальну гіперактивність. Гладкі клітини також індукують синтез IgE у В-клітинах і відіграють ключову роль у патерні каскаду IgE – IgE-рецептори опасистих клітин [2]. Таким чином, опасисті клітини не тільки є ефекторними клітинами фази негайної відповіді, але також виступають як імунорегуляторні клітини на пізній стадії алергічної реакції і під час хронічного алергічного запалення.
Базофілі. Базофіли, як і гладкі клітини, також мають ключове значення при розвитку алергічного запалення, беручи свій початок від плюрипотентних CD34+ та гемопоетичних клітин-попередників. Хоча базофіли зазвичай не виявляються ні в периферичних тканинах, ні в слизовій оболонці носа у здорових людей, вони присутні в назальному секреті у пацієнтів з АР, причому їх рівень корелює з тяжкістю захворювання [2]. У відповідь на FcεRI-залежну активацію базофіли вивільняють гістамін або цитокіни IL-4 та IL-3 (але не триптазу або PGD2) і, в основному, залучені до пізньої фази алергічної відповіді.
Лейкотрієни. Різні медіатори вивільняються лейкотрієну. Лейкотрієни є ліпідами, що містять 20 атомів вуглецю, що утворюються в результаті ланцюжка реакцій арахідонової кислоти. Всі лейкотрієни синтезуються з арахідонової кислоти (АК) за участю фосфоліпази, зокрема фосфоліпази А2. Активація клітин та синтез лейкотрієнів – це імунологічний процес, у якому важливу роль відіграють медіатори. Тим не менш, неспецифічні фактори (такі як фізична активність, зміни температури, тиск) також відіграють не менш важливу роль. Метаболізація АК відбувається по різних шляхах, основними з яких є шляхи ліпоксигенази та циклоксигенази. При метаболізації АА за допомогою циклоксигенази утворюються також простагландини та тромбоксан. При метаболізації за допомогою липоксигенази відбувається зв'язування ліпоксигенази-5 з клітинною мембраною, де за участю FLAP відбувається утворення нестійких сполук (часток) гідролази LTA4. Подальша конверсія LTA4 залежить від клітини та специфіки її ферментативної регуляції. У клітинах, що містять гідролазу LTA4, за участю глутатіону виробляються цистеїнові лейкотрієни, що містять у структурі молекули цистеїну. До цієї групи належать LTA4, LTD4, LTE4. У клітинах, що містять гідролазу LTA4, остання може трансформуватися на LTB4. Синтез LTC4 у великих кількостях відбувається в еозинофілах, гладких клітинах та макрофагах. LTC4-синтетаза присутня в нейтрофілах, моноцитах та макрофагах. Наявність тіоефірного пептидного зв'язку відрізняє цистеїнові лейкотрієни від лейкотрієнів LTB4, які не належать до цієї групи (рис. 2).
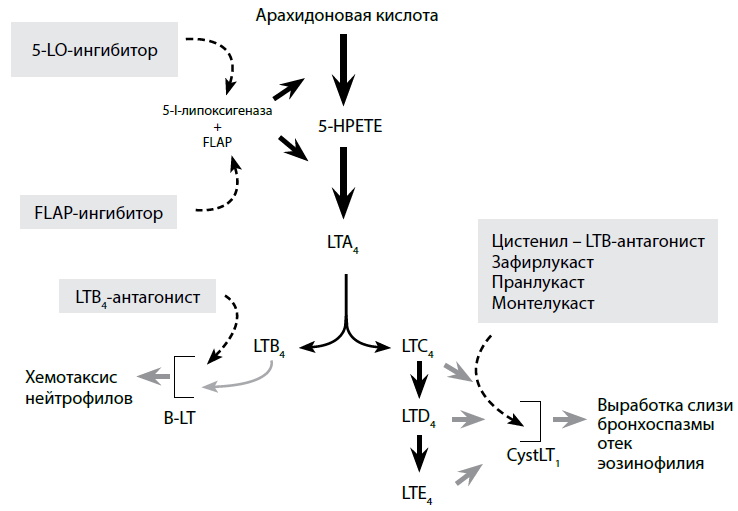
Відбувається стимуляція BLT-рецепторів LTB4; цистеїнові лейкотрієни (CysLT) здійснюють свою функцію за допомогою двох типів рецепторів: CysLT1 та СysLT2. Стимуляція рецептора CysLT11 спричиняє бронхоспазм. Це зумовлено наявністю великої кількості цього рецептора у гладкому м'язі бронхів. Рецептор CysLT2 більш поширений у людському організмі, присутні у макрофагах, волокнах Пуркіньє, головному мозку, клітинах надниркових залоз, периферичних лейкоцитах. Рецептор CysLT2 нечутливий до дії антилейкотрієнових препаратів.
Еозинофіли. Еозинофіли відіграють важливу роль при АР, оскільки місцева еозинофілія та активація цих клітин є характерною рисою алергічного запалення. Трансміграція еозинофілів із кровоносних судин у тканині є важливим фактором у виникненні еозинофільного інфільтрату. Така трансміграція включає безліч етапів, таких як прокатка, адгезія, хемотаксис і міграція. Еотаксини та IL-5 відіграють важливу роль у дозріванні та функції еозинофілів. Трансміграція є результатом синергічної дії IL-5 та еотаксинів. IL впливає на зростання та дозрівання еозинофілів, а еотаксини посилюють їх динамічні функції (адгезія та трансміграція). Еозинофіли утворюються з кісткового мозку, клітин-попередників (CD34+) під впливом еотаксинів. Такі хемокіни, як RANTES, також спричиняють активацію еозинофілів. Зрілі еозинофіли містять протеоглікан 2, ECP, еозинофільний нейротоксин (ЕРС), еозинофільну пероксидазу, які відіграють важливу роль у імунних механізмах алергічного запалення, особливо у змінах поверхневого епітелію. Крім того, еозинофіли синтезують і вивільняють такі цитокіни, як IL-3, IL-5, GM-CSF, прозапальні цитокіни, хемокіни (RANTES, IL-8, MIP-1α) [42], які відіграють вирішальну роль у пізній фазі імунного відповіді та при персистуючому алергічному запаленні [6].
Лімфоцити. Вважається, що Т-лімфоцити грають вирішальну роль в етіопатогенезі алергічних захворювань, регулюючи та координуючи імунні реакції. Лімфоцити типу Th1 в основному виробляють IL-2, IL-1, IFN-гамма та TNF-бета. Цей тип лімфоцитів залучений до гіперчутливої реакції уповільненого типу, у той час як лімфоцити Th2-типу виробляють IL-4, IL-5, IL-6, IL-10 і IL-13 і переважно беруть участь у розвитку IgE-опосередкованого алергічного запалення. Т2-лімфоцити експресують ліганди для хемокінів TARC, CC R4, і залучення Th2-клітин за допомогою TARC може бути ключовим механізмом алергічних реакцій. На користь цієї гіпотези свідчить виражена кореляція між рівнем TARC у слизовій оболонці носа та кількістю CD4+/CC R4+. Обидва типи лімфоцитів, як Th1, так і Th2, виробляють IL-3, GM-CSF та TNF-альфа. Лімфоцити типу Th1 індукують, за допомогою секреції IL-2 та IFN-гаму, активацію специфічних активованих цитотоксичних лімфоцитів (CD8+-клітин та природних кілерів). Нещодавні дослідження показали, що CD8+-клітини можуть функціонувати як клітини-помічники та виробляти проалергічні цитокіни [8].
Запалення слизової оболонки носа при алергічному риніті характеризується тканинною інфільтрацією Т-лімфоцитів (CD4+ T-клітини та CD25+ (активовані) T-клітини) як в епітелії, так і в підслизовому шарі. Існує значна кореляція між збільшенням числа CD4+ T-клітин під час пізньої фази алергічної реакції після контакту з алергеном та кількістю еозинофільного інфільтрату у слизовій оболонці носа, що пов'язано зі збільшенням експресії у ній IL-3, IL-4, IL-5, GM- CSF на мікро-РНК рівнях [8]. При хронічному алергічному риніті відзначається збільшення CD4+ T-клітин пам'яті, CD4+ T-клітин та B-клітин у слизовій оболонці носа, пов'язане зі збільшенням кількості IL-4, IL-5 та IL-13 позитивних клітин, а також інтраепітеліальних γ/δT- клітин. Останні відіграють особливу роль, оскільки їх здатність індукувати синтез IgE-клітинами забезпечує, у свою чергу, здатність до регуляції алергічної імунної відповіді.
Регуляторні Т-клітини (Treg) є однією з субпопуляцій CD4+-клітин, що пригнічують функцію інших лімфоцитів і характеризуються поверхневою експресією CD4 та CD25 та ядерного фактора транскрипції, пов'язаного з Х-хромосомою (FOXP3). Роль ядерного фактора транскрипції та його вплив на імунну систему було вивчено порівняно недавно. T-регуляторні клітини впливають на розвиток та експресію атопії та алергічної відповіді. Адаптивні клітини FOXP3+ Treg визначають рівень толерантності слизової оболонки і пригнічують вироблення IL-4. Кількість цих клітин знижується при астмі та алергічному риніті і збільшується після імунотерапії, що асоціюється з індукцією IL-10 & TGF-β продукуючих Tr-1 клітин, так само як і FOXP3-експресуючих IL-10 T-клітин, з супресією в результаті оточення Th2 -цитокінів. Відзначено, що при алергічних захворюваннях активація та експансія антиген-специфічних CD4+, CD25+ T-клітин (Tregs) за допомогою фармакологічних засобів (стероїдів у низьких дозах та вітаміну D3) сприяють розвитку антиген-специфічної толерантності [9]. У слизовій оболонці носа у пацієнтів з хронічним алергічним ринітом частка В-клітин становить 20% усієї популяції лімфоцитів, і недавні дослідження показують, що при сезонному алергічному риніті В-клітини здатні змінювати клас на IgE локально в слизовій оболонці носа [9]. Крім того, як при сезонному, так і при хронічному риніті спостерігається значне збільшення макрофагів у слизовій оболонці. Клітини Лангерганса є важливою групою дендритних клітин, що характеризується експресією CD1 і гранул Бірбека. Їхня кількість зростає після контакту з антигеном у пацієнтів з АР, можливо, тому що вони функціонують у верхніх дихальних шляхах як антиген-презентуючі клітини [2].
Багато років вважалося, що епітеліальні клітини виконують лише бар'єрну роль, беручи участь у процесах секреції слизу та очищення слизової. Однак останні дослідження продемонстрували, що вони мають широкий спектр імуномодулюючих властивостей, сприяючи викиду ейкозаноїдів, ендопептидаз, цитокінів та хемокінів (IL-6, IL-8, GM-CSF, TNF-α, RANTES, TARC, еотаксин, SCF), а також експресії адгезійних молекул, таких як молекула міжклітинної адгезії-1 та VCAM-1, посилюючи таким чином алергічний запалення [2]. Крім того, клітини носового епітелію при алергічному риніті виділяють матриксні металопротеази (MMP)-2, MMP-9 та MMP-13 з експресією альфа/гамма-FcεRI, HLA-DR та CD86, а також можуть презентувати антиген Т-клітин [2] . Білок Der p1 має здатність впливати на сполуки епітеліальних клітин, збільшуючи проникність епітелію. Також відомо, що алергени за рахунок ензиматичної протеолітичної активності можуть викликати пряму активацію клітин, призводячи до виділення цитокінів та хемокінів та таким чином індукуючи запалення верхніх дихальних шляхів, незалежне від IgE-опосередкованих механізмів. Однак відносна важливість цих незалежних механізмів у порівнянні з IgE-опосередкованими механізмами залишається невивченою [10].
Тимічний стромальний лімфопоетин (ТСЛ), що продукується епітеліальними клітинами, індукує алергічне запалення, опосередковане дендритними клітинами. Недавні дослідження продемонстрували надмірну експресію ТСЛ у пацієнтів з астмою, алергічним ринітом і носовими поліпами, локалізованими в епітелії, а дослідження на мишах свідчать, що гладкі клітини регулюють епітеліальну експресію ТСЛ при алергічному риніті, можливо, за допомогою експресії FcεRI IL 1, високі рівні якого спостерігаються при астмі [11, 12]. Інфільтрація ефекторними клітинами є ключовим моментом у розвитку таких алергічних захворювань, як астма та алергічний риніт. Структурні клітини (клітини ендотелію) виконують дві функції, що мають значення для патогенезу алергічного риніту: 1) сприяють концентрації лейкоцитів у місці первинної реалізації імунної відповіді; 2) є важливим джерелом деяких цитокінів та хемокінів, таких як RANTES та еотаксин [8]. Крім того, подібно до епітеліальних клітин, клітини ендотелію також мають властивість експресії H1-гістамінових рецепторів, і стимуляція гістаміном індукує активацію цих клітин. Чхання та рідкі виділення з носа повністю усуваються блокадою H1-гістамінових рецепторів. Однак утруднення носового дихання (носова блокада) лише частково реагує на типові антигістамінні препарати. Блокатори Н2-гістамінових рецепторів можуть зменшувати прояви блокади носа, але при цьому вони не мають синергізму з класичними антигістамінними препаратами. Це яскраво ілюструє те, що дія як Н1-, так і Н2-блокаторів відноситься до одного і того ж патологічного процесу і що носова блокада усувається тільки шляхом блокади як Н1-, так і Н2-рецепторів, а також вказує на те, що вона може бути наслідком стимуляції Н3- та Н4-рецепторів [1]. H1, H2, H3 та H4-рецептори є структурами, що зв'язуються з білком G на мембранах багатьох ефекторних клітин. Н2-рецептори головним чином стимулюються через 2-метилгістамін, що призводить до збільшення рівня IP3 (інозитолу-1, 4, 5-трифосфату) та Ca++ усередині клітини. Н2-рецептори стимулюються за допомогою 4-метилгістаміну, а H3- та H4-рецептори відповідають на дію альфа-метилгістаміну, що призводить до того ж кінцевого ефекту – збільшення рівнів внутрішньоклітинного Ip3 та Ca++ [1, 2].
Структурні клітини (клітини епітелію), резидентні клітини (огрядні клітини) та клітини, що викликають інфільтративно-запальні зміни (еозинофіли, базофіли та Т-клітини) відіграють провідну роль у патогенезі персистуючого алергічного запалення. Цитокіни IL-4 і IL-13, що вивільняються з гладких клітин та Т-клітин, стимулюють синтез IgE у В-клітинах, а також сприяють збільшенню місцевого синтезу IgE у слизовій оболонці носа у пацієнтів з алергічним ринітом [13]. Дослідження показують, що в умовах алергічного запалення активовані опасисті клітини демонструють значну експресію високоафінного рецептора IgE та ліганда поверхневого антигену CD40, залученого у взаємодію T- та B-клітин, що стимулюють вироблення IgE [2]. Гладкі клітини мають також потенціал антиген-презентуючих клітин, і IL-4, що вивільняється ними, може «направляти» T-хелпери по патерну Th2, одночасно сприяючи апрегуляції експресії FcεRI в гладких клітинах і базофілах [2]. Ці дані свідчать, що гладкі клітини сприяють підтримці персистуючого алергічного запалення, а локально синтезований IgE за рахунок апрегуляції експресії FcεRI у них сприяє зв'язуванню IgE-Ag-комплексів. Ці комплекси, у свою чергу, збільшують чутливість опасистих клітин до алергену, що призводить до збільшення вироблення імуномодулюючих цитокінів та хімічних медіаторів, посилюючи таким чином ефект каскаду реакцій IgE – IgE-рецептори опасистих клітин.
Механізми місцевого синтезу IgE в слизовій оболонці носа на сьогоднішній день досить добре вивчені. Дослідження продемонстрували ефект «перемикання» між класами клітин (клас IgE) та збільшення числа IL-4 позитивних клітин [14]. Провокаційні проби з алергеном in vitro свідчать про апрегуляцію IgE-продукуючих B-клітин [15]. Місцево синтезований IgE відіграє згодом ключову роль в ампліфікації активності опасистих клітин шляхом апрегуляції експресії FcεRI у них та подальшому вивільненні медіаторів імунної відповіді [2].
Пацієнти з АР порівняно зі здоровою популяцією виявляють збільшену симптоматичну чутливість до зовнішніх подразників, таких як тютюновий дим [2]. «Візитною карткою» АР є гіперчутливість до специфічних алергенів, так само як і до неспецифічних стимулів (наприклад, сильних запахів) – феномен, відомий як «праймінг», причини якого, однак, залишаються неясними. Можливо, що активовані запальні клітини збільшують проникність слизової оболонки, прискорюючи, таким чином, проникнення в них алергену та створюючи додаткові ділянки для антигенспецифічної стимуляції, чому сприяє також вивільнення медіаторів запалення.
Фактор зростання нервів (ФРН), гіперекспресія якого спостерігається при алергічному риніті, тісно пов'язаний з розвитком гіперреактивності, що також асоціюється з розвитком алергічного запалення, що поєднує АР та астму. ФРН синтезується, відкладається і вивільняється у клітинах, що відіграють ключову роль у патогенезі алергічного запалення дихальних шляхів – опасистих клітинах, еозинофілах, CD4+ T- та B-клітинах, а також у клітинах респіраторного епітелію. Гладкі клітини експресують і секретують ФРН, а інші клітини в пізній фазі запального процесу також сприяють вивільненню його в дихальних шляхах, що підтверджується зростанням рівня ФРН в мокротинні, отриманої в результаті бронхолаважу через 18 годин після провокаційної проби алергеном у пацієнтів з астмой [16].
Існують докази на користь існування мінімального персистуючого запалення навіть за ремісії АР та астми, що зумовлює необхідність довгострокового протизапального лікування для таких пацієнтів [17]. АР не асоціюється лише з місцевим запаленням слизової оболонки носа – запалення має системний елемент. У пацієнтів з сезонним алергічним ринітом, які не страждають на астму, провокаційні проби з алергеном призводили до збільшення експресії адгезійних молекул, еозинофільної інфільтрації як у верхніх, так і в нижніх дихальних шляхах та гіперреактивності бронхів [2]. Ці результати свідчать, що назальная алергічна реакція призводить до системним запальним змін. У пацієнтів з АР експозиція алергену призводить до активації імунних клітин, включаючи Th2-лімфоцити, дендритні клітини, мононуклеари, опасисті та інші клітини як у носовій порожнині, так і в асоційованих з нею лімфатичних тканинах. Деякі Th2-клітини мігрують у кістковий мозок для подальшої стимуляції міграції запальних клітин, таких як базофіли, еозинофіли та попередники опасистих клітин у ділянки запалення.
| Нерви | Результат провокаційних проб | Патофізіологічні наслідки |
|---|---|---|
| Чутливі нерви шкіри | Підвищена чутливість | Розширення судин |
| Чутливі нерви слизових оболонок | Підвищена чутливість та посилення виділень | Кашель, чхання, бронхоспазм |
| Центральна нервова система | Збільшення синтезу нейропептидів | Посилення рефлексів |
| Парасимпатичні ганглії | Поліпшення синаптичної активності | Збільшення напруги симпатичної нервової системи |
| Симпатичні ганглії | Збільшення синаптичної активності | Збільшення напруги парасимпатичної нервової системи |
| Парасимпатичні нерви, що не проходять через ганглії | Збільшення секреції ацетилхоліну | Спазм бронхіального дерева |
Багато досліджень вказують на те, що провокаційні проби призводять до змін функції нервової системи (див. таблицю). Крім впливу на активність центральної нервової системи експозиція алергену та контакт з ним шкіри та слизових оболонок може призводити до патологічних змін на периферії. Крім збільшення проникності судин гістамін зв'язується з чутливими нервовими закінченнями типу С. Нейрони чутливих нервів широко розгалужуються на дендрити як в епітелії слизових оболонок, так і під ним (1-а та 2-га гілки трійчастого нерва). Їх деполяризація в епітелії може призводити до вивільнення різних нейротрансмітерів, таких як субстанція Р, кальцитонін-ген-споріднений пептид, що вивільняє гастрин пептид, нейрокінін А, і активації різних аксональних механізмів. Вважається, що саме аксональні механізми відіграють провідну роль у патогенезі утворення лейкоцитарного інфільтрату; Що стосується збільшення проникності судинних стінок, тут відомості про роль і значущість їх суперечливі, і остаточна відповідь, мабуть, буде отримана тільки після проведення досліджень з використанням тахониніну антагоністів, що блокують дію субстанції Р у пацієнтів з АР. Однією з основних функцій чутливих нервів є активація механізмів, відповідальних посилення парасимпатичних рефлексів, що призводять, своєю чергою, до посилення виділень з носа. Гіпотези про зв'язок парасимпатичних нервових реакцій із реакціями на клітинному рівні вимагають подальших досліджень.
Алергічний риніт характеризується розвитком ранньої та пізньої стадії алергічного запалення та утворенням інфільтрату, що складається з різних клітин. Клітинна відповідь включає хемотаксис і трансендотеліальну міграцію клітин, локалізацію їх у різних відділах слизової оболонки носа, активацію та збільшення життєвого терміну різних типів клітин, вивільнення ними медіаторів імунної відповіді, регуляцію синтезу місцевого та загального IgE. Така клітинна відповідь характерна для сенсибілізованих пацієнтів зі сформованими алерген-специфічними антитілами IgE, що зв'язуються з мембранами опасистих та інших клітин. IgE-опосередкована реакція відіграє важливу роль у ранній фазі імунної відповіді; в пізній фазі імунної відповіді включаються перераховані вище механізми. Складна взаємодія між різними медіаторами, гістаміном, цитокінами, хемокінами, нейропептидами, адгезійними молекулами та різними типами клітин призводить до появи специфічного симптомокомплексу та назальної гіперреактивності. Патофізіологія АР далі ускладнюється залученням до процесу нервової системи, зв'язок реакцій якої з реакціями на клітинному рівні є об'єктом подальших досліджень.
Запрошуємо переглянути запис прямого ефіру на тему "Запалення як мета комплексної терапії хронічних захворювань верхніх дихальних шляхів"
Конференція SHDM.SCHOOL
Науково-практичний кейс-марафон SHDM.SCHOOL
SHDM.FORUM'24: головна подія року!
Розповсюдженість алергічного риніту. Клінічні рекомендації EPOS-2020 та ARIA-2019. ARIA-2019 та EPOS-2020: лікування. Ступені тяжкості перебігу АР. Принцип ступеневого підходу до лікування АР. ARIA-2019 та EPOS-2020: основні проблеми.
Інформація, опублікована на даному сайті, орієнтована на загальне ознайомлення та жодним чином не може бути використана в якості медичних, практичних або комерційних рекомендацій. У зв’язку з цим, Сайт «Школи доказової медицини» не несе жодної відповідальності за негативні наслідки, отримані через використання матеріалів, викладених на даному сайті. Документація з фармацевтичних продуктів не є рекламою та не призначена для того, щоб використовувати її замість консультації з кваліфікованими фахівцями в галузі медицини та інших галузях. Документація з фармацевтичних продуктів надається за вашою згодою відповідно до вимог ч.ч. 1, 2 ст. 15 Закону України «Про захист прав споживачів» від 12.05.1991 р. № 1023-XII. Якщо вам потрібна консультація з конкретного питання, пов’язаного зі здоров’ям, необхідно звернутися до фахівців- професіоналів.
Продовжуючи своє перебування на сайті, ви підтверджуєте свою згоду на дистанційне отримання інформації про лікарські та косметичні засоби (включаючи інформацію про рецептурні лікарські засоби) на підставі вимог ч.ч. 1, 2 ст. 15 Закону України «Про захист прав споживачів» від 12.05.1991 р. № 1023-XII.
Уся інформація, яка міститься на даному сайті, подана з освітньою метою виключно для медичних та фармацевтичних працівників і не замінює консультації лікаря.

